二甲双胍格列吡嗪片人体生物等效性研究
李媛媛,梁宇光,郝光涛,曲恒燕,高洪志,刘伟丽,刘泽源(军事医学科学院附属医院药学部,北京 100071)
二甲双胍格列吡嗪片是由盐酸二甲双胍和格列吡嗪组成的复方制剂。盐酸二甲双胍是双胍类糖尿病治疗药物,格列吡嗪是磺脲类降糖药物,二者联合用药,具有协同降糖作用,降低了两者用药的初始剂量,增加了用药的广泛性,为糖尿病的治疗提供了一个新途径[1-2]。我们采用高效液湘色谱-质谱(HPLCMS/MS)法测定服用二甲双胍格列吡嗪片或盐酸二甲双胍片和格列吡嗪片后人血浆中二甲双胍和格列吡嗪的浓度,并对受试制剂的药动学特性、生物利用度及其与参比制剂的生物等效性进行研究。二甲双胍格列吡嗪片药代动力学研究国内已有报道,但所用试验药物二甲双胍与格列吡嗪的含量分别是250 mg和2.5 mg[3-5],而本研究的试验药物两制剂含量分别为500 mg和2.5 mg。本试验对该规格的二甲双胍格列吡嗪复方制剂的药代动力学特性进行研究,为该药的临床应用提供参考,同时本研究中的血浆样品预处理方法较文献报道的方法简便、快速、重复性强,为两种药物的血药浓度检测提供新思路。
1 材料
1.1 仪器
API 3000型三重四极杆串联质谱仪,配有电喷雾离子化源以及Analyst 1.4.2 数据处理软件(美国AB公司);Agilent 1200 高效液相色谱系统(美国Agilent公司);高效液相色谱-质谱联用仪(岛津);串联质谱仪为API 3200型三重四极杆串联质谱仪,含电喷雾离子化源以及串联三重四极杆质谱检测器;GL-88B 旋涡混合仪(海门市其林贝尔仪器制造有限公司);AB104 电子分析天平(瑞士 METTLER TOLEDO公司);2K-15 高速低温离心机(美国 Sigma 公司);B600A型低速自动平衡离心机(中国白洋离心机厂);Milli-Q Plus 纯水器(美国密理博中国有限公司)。
1.2 药品与试剂
受试制剂:二甲双胍格列吡嗪片(德州博诚制药有限公司,规格:每片含盐酸二甲双胍500 mg,格列吡嗪2.5 mg,批号100802)。参比制剂:格列吡嗪片(迪沙药业,规格:每片含格列吡嗪2.5 mg,批号091211);盐酸二甲双胍片(中美上海施贵宝制药有限公司,规格:每片含盐酸二甲双胍500 mg,批号1004063)。
二甲双胍对照品(中国药品生物制品检定所,批号100664-200602),内标:苯乙双胍对照品(中国药品生物制品检定所,批号100922-201001);格列吡嗪对照品(中国药品生物制品检定所,批号100281-200602),内标:地西泮对照品(中国药品生物制品检定所,批号1230-9601)。
甲酸、乙腈为色谱纯(DIMA公司);其余试剂均为分析纯;空白人血浆由军事医学科学院附属医院血液科提供。
2 方法
2.1 研究对象
24名男性健康受试者,平均年龄为(24.8±3.0)岁,平均身高为(169.8±4.3) cm,平均体重为(61.3±4.7) kg,体重指数(21.2±1.1) kg·m-2,均无烟酒嗜好,无药物过敏史、药物依赖史及慢性病史;均接受全面体检,试验前生命体征、血常规、尿常规、肝功能、肾功能、心电图及胸透等检查未发现异常;受试前2周内未服用任何其他药物;受试期间统一清淡饮食,禁止剧烈活动,禁饮茶、酒及含咖啡因的饮料,或某些可能影响代谢的果汁等。受试者均自愿参加并签署知情同意书。本研究方案经军事医学科学院附属医院伦理委员会批准实施。
2.2 给药方案与血样采集
本试验采用双周期自身交叉设计,单剂量口服给药。24名受试者随机进入2个试验组,每组12名。每组受试者每次试验时分别服用受试制剂二甲双胍格列吡嗪片一片;或参比制剂盐酸二甲双胍片和格列吡嗪片各一片,同时服用。
受试者于用药前一日入住Ⅰ期临床试验病房,统一进清淡平衡膳食,晚餐后禁食不禁水12 h,次日晨8:00左右空腹以200 mL温开水(含50 g葡萄糖)服药,服药后2 h饮水200 mL(含50 g葡萄糖),服药后4 h统一进低脂膳食。两次用药间隔7 d。分别于给药前及给药后0.5,1,1.5,2,3,4,5,6,8,10,12,15,24 h采集上肢静脉血,肝素抗凝,3000 r·min-1离心10 min,分离血浆,血浆样品置- 40 ℃冰箱保存待测。
2.3 二甲双胍血浆药物浓度测定方法
2.3.1 色谱条件及质谱条件 色谱柱:Luna 5u CN 100A(2.0 mm×150 mm,5 μm);流动相:甲醇-30 mmol·L-1乙酸铵水溶液(80∶20);流速:0.3 mL·min-1;柱温:25 ℃;进样量:5 μL。
离子源:电喷雾离子化源(ESI源);离子极性:正离子;离子检测方式:多反应监测(MRM)方式;喷射电压:5400 V;离子源温度:450 ℃;源内气体1(GS1,N2)压力:12 psi;源内气体2(GS2,N2)压力:7 psi;CE电压:30 V;用于定量分析的离子反应对分别为质荷比m/z130.0→m/z71.0(二甲双胍)和m/z206.2→m/z105.2(苯乙双胍,内标)。
2.3.2 血浆样品处理与测定 精密量取血浆样品200 μL,加入内标溶液(1000 µg·L-1苯乙双胍乙腈溶液)50 μL,涡旋混合均匀,加入乙腈700 mL,涡旋混合均匀,15 000 r·min-1,4 ℃低温离心10 min,取上清液进样5 μL进行 HPLC-MS/MS分析。
2.3.3 标准曲线的制备 取空白血浆200 μL,分别精密加入二甲双胍标准系列溶液200 μL和内标溶液50 μL,涡旋混合均匀,配制成相当于二甲双胍血浆浓度分别为25,50,100,250,500,1000,2000和2500µg·L-1的血浆样品,按血浆样品处理方法进行处理、测定,以血浆中待测物浓度(x)为横坐标,待测物与内标的峰面积比值(y)为纵坐标,用加权(w = 1/x2)最小二乘法进行回归运算,得回归方程:y= 0.002 79x- 0.054 9,r= 0.996 0。二甲双胍血药浓度在25 ~2500 µg·L-1范围内呈良好线性关系,定量下限为25µg·L-1。
2.3.4 精密度与准确度 在空白人血浆中加入不同量的二甲双胍制成低、中、高(50,250,2000 µg·L-1)不同浓度的标准血浆样品,每个浓度各6 个样品,按上述测定方法分别测定日内、日间变异,得二甲双胍血浆中低、中、高三个浓度的平均日内精密度分别为2.58%,1.74%和1.69%,日间精密度分别为2.61%,9.96%和6.16%,均<15%,平均相对回收率分别为(89.33±2.30)%,(90.27±1.57)%和(102.50±1.73)%。
2.3.5 样品稳定性 二甲双胍血浆样品在经过反复3次- 40 ℃冻融,- 40 ℃冰冻放置2个月,样品处理后进样器中放置24 h,样品室温放置4 h的条件下,进行稳定性考察,RE均在±15%内,稳定性良好。
2.4 格列吡嗪血浆药物浓度测定方法
2.4.1 色谱条件及质谱条件 色谱柱:Agilent Zorbax-extend-C18柱(4.6 mm×150 mm,5 μm);流动相:乙腈-0.1%甲酸水溶液(30∶70);流速:1.2 mL·min-1(80%分流);柱温:25 ℃;进样量:10 μL。
离子源:电喷雾离子化源(ESI源);离子极性:正离子;离子检测方式:多反应监测(MRM) 方式;喷射电压:5400 V;离子源温度:450 ℃;源内气体1(GS1,N2)压力:60 psi;源内气体2(GS2,N2)压力:60 psi;气帘气体(N2)压力:8 psi;CE电压:20 V;用于定量分析的离子反应对分别为质荷比m/z446.0→m/z321.0(格列吡嗪)和m/z285.0→m/z193.0(地西泮,内标)。
2.4.2 血浆样品处理与测定 精密量取血浆样品50 μL,加入内标溶液(100 µg·L-1地西泮乙腈溶液)50 μL,涡旋混合均匀,加乙腈100 mL,涡旋混合均匀,15 000 r·min-1,4 ℃低温离心10 min,取上清液进样10 μL进行 HPLC-MS/MS分析。
2.4.3 标准曲线的制备 取空白血浆50 μL,分别精密加入格列吡嗪标准系列溶液50 μL 和内标溶液50 μL,涡旋混合均匀,配制成相当于格列吡嗪血浆浓度分别为5,10,20,50,100,200,500和1000 µg·L-1的血浆样品,按血浆样品处理方法进行处理、测定,以血浆中待测物浓度(x)为横坐标,待测物与内标的峰面积比值(y)为纵坐标,用加权(w = 1/x2)最小二乘法进行回归运算,得回归方程:y= 0.002 7x-0.002 18,r= 0.998 5。格列吡嗪血药浓度在5 ~ 1000µg·L-1范围内呈良好线性关系,定量下限为5 µg·L-1。
2.4.4 精密度与准确度 在空白人血浆中加入不同量的格列吡嗪制成低、中、高(15,80,800 µg·L-1)不同浓度的标准血浆样品,每个浓度6个样品,按上述测定方法分别测定日内、日间变异,得格列吡嗪血浆中低、中、高三个浓度的平均日内精密度分别为3.46%,3.54%和2.42%,日间精密度分别为4.04%,7.29%和6.03%,均<15%,平均相对回收率分别为(109.89±3.80)%,(89.31±3.16)%和(90.10±2.18)%。
2.4.5 样品稳定性 格列吡嗪血浆样品在经过反复3次- 40 ℃冻融,- 40 ℃冰冻放置2个月,样品处理后进样器中放置24 h,样品室温放置4 h的条件下,进行稳定性考察,RE均在±15%,稳定性良好。
2.5 数据处理
采用Phoenix WinNonlin 6.1数据统计软件,计算24名受试者单次口服受试及参比制剂后个体药代动力学参数,并对两种制剂进行生物等效性评价。根据每一个受试者口服受试制剂和参比制剂后AUC0-tn和AUC0-∞,求得受试制剂的相对生物利用度,并求出其均值及标准差。
3 结果
3.1 血药浓度-时间曲线
受试者口服受试制剂和参比制剂后,二甲双胍和格列吡嗪平均血药浓度-时间曲线见图1。
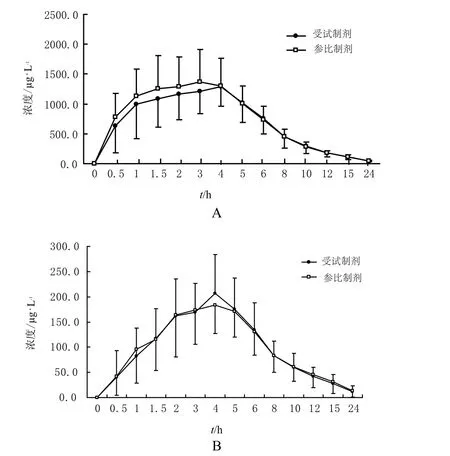
图1 受试者服用受试制剂和参比制剂后平均血药浓度-时间曲线A - 二甲双胍;B - 格列吡嗪Fig 1 Mean plasma concentration-time curves after taking the test and reference drugs in 24 healthy volunteersA - metformin; B - glipizide
3.2 药代动力学参数
24名健康受试者口服受试制剂和参比制剂后的主要药代动力学参数见表1。

表1 受试者口服受试制剂及参比制剂后二甲双胍和格列吡嗪的主要药代动力学参数Tab 1 The main pharmacokinetic parameters of metformin and glipizide after taking the test and reference drugs in 24 healthy volunteers
3.3 生物等效性评价
中国健康成年男性受试者口服受试制剂二甲双胍格列吡嗪片和参比制剂盐酸二甲双胍片、格列吡嗪片后,主要药代动力学参数进行方差分析,结果表明两制剂间的差异无统计学意义(P> 0.05);对参数AUC、Cmax经对数转换后进行方差分析、90%置信区间检验,二甲双胍AUC0-tn、AUC0-∞、Cmax90%的置信区间分别为87.41% ~ 102.59%,87.46% ~ 102.11%,83.13% ~ 101.45%;格列吡嗪AUC0-tn、AUC0-∞、Cmax的90%置信区间分别为92.44% ~ 105.89%,92.49% ~105.60%,96.17% ~ 112.95%;对tmax进行非参数法检验,两制剂无显著性差异。结果表明受试制剂和参比制剂具有生物等效性。
4 讨论
二甲双胍格列吡嗪片药代动力学研究之前也有文献报道,但其样品处理方法采用二氯甲烷进行液液萃取[3],或者采用高氯酸加二氯甲烷萃取[4,6]进行二甲双胍的血药浓度分析,或者加入乙酸、乙腈离心,上清液吹干石油醚复溶再提取[7],操作步骤繁多。本研究为了简化样品处理方法,在流动相中分别加入了乙酸铵(二甲双胍)和甲酸(格列吡嗪),提高了分析的灵敏度,样品预处理只需乙腈蛋白沉淀后离心即可,简便可靠、重现性好。同时文献[3-4,8]报道的方法需要样本量较大,而本研究需要血浆量较少,二甲双胍需要200 μL,而格列吡嗪仅需50 μL,大大减少了对受试者身体的损害。
本研究中受试制剂二甲双胍格列吡嗪片与参比制剂盐酸二甲双胍片、格列吡嗪片的药代动力学参数表明,二者在人体内吸收、分布、消除规律较为接近。受试制剂中二甲双胍的相对生物利用度F0-tn、F0-∞分别为(97.18±23.26)%和(96.83±22.43)%,格列吡嗪的相对生物利用度F0-tn、F0-∞分别为(100.73±19.66)%和(100.59±19.70)%。经生物等效性评价,表明受试制剂二甲双胍格列吡嗪片与参比制剂盐酸二甲双胍片、格列吡嗪片在体内的吸收、分布、消除过程相似,二者具有生物等效性。
综上所述,两种制剂复方后所得复方制剂口服与两种单药共同服用具有生物等效性,本实验为临床选择二甲双胍格列吡嗪复方制剂提供参考。
[1] Otto M, Breinholt J, Westergaard N. Metformin inhibits glycogen synthesis and gluconeogenesis in cultured rat hepatocytes[J].Diabetes Obes Metab, 2003, 5(3): 189-194.
[2] Feinglos M, Dailey G, Cefalu W,et al. Effect on glycemic control of the addition of 2.5 mg glipizide GITS to metforminin patients with T2DM[J]. Diabetes Res Clin Pr, 2005, 68(2): 167-175.
[3] 孙红生,王本杰,魏春敏,等. 二甲双胍格列吡嗪片人体药动学研究[J]. 中国现代药物应用,2007,1(6):12-14.
[4] 马智宇, 曲斌,丁娅,等. 盐酸二甲双胍格列吡嗪胶囊的健康人体药动学研究[J]. 药物分析杂志,2012,32(1):7-14.
[5] 李筱旻,曹伟,吴建平,等. 复方盐酸二甲双胍格列吡嗪片在健康人体的药动学[J]. 中国医院药学杂志, 2007,27(7):869-872.
[6] 袭荣刚,王晓波,石焱,等. 高效液相色谱法研究人体内盐酸二甲双胍药动学和生物等效性[J].中国新药杂志,2009,18(3):230-233.
[7] 冯文利,吴华,朱莹,等. 用HPLC-MS/MS法测定人血浆中二甲双胍浓度[J]. 药学服务与研究,2008,8(2):116-118.
[8] 魏敏吉,齐慧敏,吕媛,等. 格列吡嗪控释片在健康人体的生物等效性[J]. 中国临床药理学杂志,2007,23(5):348-352.

