同分异构体齐墩果酸和熊果酸对CYP450酶抑制作用的差异
王亚平,董瑞华,刘泽源,胡 园,刘皈阳(. 解放军总医院第一附属医院药剂药理科,北京 0007;2. 河北北方学院,河北 张家口 075000;. 军事医学科学院附属医院临床药理室,北京 0007;.解放军总医院临床药理室,北京 0085)
细胞色素P450(cytochrome P450,CYP450)是肝微粒体混合功能氧化酶中最重要的一族,在外源性和内源性物质的代谢中起着极其重要的作用。CYP450可受多种因素的影响,尤其是药物,并引起自身或其他药物的药代动力学改变,使得药效增强(中毒)或减弱(无效),从而导致药物-药物相互作用[1]。
近年来有关中药活性成分对CYP450酶系影响的研究备受关注[2-3]。齐墩果酸和熊果酸属于五环三萜类化合物,存在于多种药用植物中,具有多种生物学活性,如保肝、抗炎、抗肿瘤、抗HIV等[4-5]。我们的前期实验结果表明,齐墩果酸不经过CYP450酶代谢,而CYP450酶参与了熊果酸的代谢[6]。本文以此为基础,以人肝微粒体温孵系统为模型,进一步对比研究齐墩果酸和熊果酸对CYP450酶的抑制作用,为临床合理用药提供参考。
1 材料与方法
1.1 仪器与试剂
Agilent 1100 高效液相色谱仪,包括G1311A 四元泵,G1316A 柱温箱,G1329A 自动进样器,G1379A在线脱气机,G1314A VWD 可变波长紫外检测器,G1321A FLD 荧光检测器和HP 色谱工作站;色谱柱Krosmail 100-5C18(250 mm×4.6 mm,5 μm)购自迪马科技公司;高速冷冻离心机(德国Sigma公司);恒温混匀仪(杭州奥盛仪器有限公司);电子天平(瑞士梅特勒-托利多公司)。
齐墩果酸、熊果酸、非那西丁、双氯芬酸钠、右美沙芬氢溴酸盐、氯唑沙宗、S-美芬妥英、香豆素、呋拉茶碱、8-甲氧补骨脂素、槲皮素、磺胺苯吡唑、奎尼丁、克拉霉素、氯美噻唑、D-葡萄糖-6-磷酸(G-6-P)、葡萄糖-6-磷酸脱氢酶(G-6-PDH)、氧化性辅酶Ⅱ(NADP+)均购自Sigma公司;咪达唑仑注射液(江苏恩华药业股份有限公司);混合人肝微粒体(15例)(美国BD公司);其余试剂为色谱纯或分析纯。
1.2 齐墩果酸和熊果酸对CYP亚型的抑制作用
200 μL孵育体系包括磷酸钾缓冲液(pH = 7.4,100 mmol·L-1);NADPH 生成体系(1 mmol·L-1NADP+,10 mmol·L-1葡萄糖-6-磷酸,1 U·mL-1葡萄糖-6-磷酸脱氢酶,4 mmol·L-1MgCl2);肝微粒体(0.5 mg·mL-1)和底物。
在孵育体系加入NADPH生成体系前,加入CYP探针药物和齐墩果酸或熊果酸 50 μmol·L-1,并以CYP探针药物的特异性抑制剂作为阳性对照,考察齐墩果酸或熊果酸对CYP各亚型的抑制作用。8种CYP亚型探针底物及其浓度分别为:非那西丁(40 μmol·L-1,CYP1A2);香豆素(1.0 μmol·L-1, CYP2A6);紫杉醇(10 μmol·L-1, CYP2C8);双氯芬酸(10 μmol·L-1,CYP2C9);右美沙芬(25 μmol·L-1,CYP2D6);氯唑沙宗(120 μmol·L-1,CYP2E1);咪达唑仑(10 μmol·L-1,CYP3A4);S-美芬妥英(10 μmol·L-1,CYP2C19)。CYP各亚型的抑制剂及其对应的浓度分别为:呋拉茶碱(10 μmol·L-1,CYP1A2);8-甲氧补骨脂素(2.5 μmol·L-1,CYP2A6);槲皮素(20 μmol·L-1,CYP2C8);磺胺苯吡唑(10 μmol·L-1,CYP2C9);奎尼丁(10 μmol·L-1,CYP2D6);克拉霉素(10 μmol·L-1,CYP3A4);氯美噻唑(50 μmol·L-1,CYP2E1);奥美拉唑(10 μmol·L-1,CYP2C19)。37 ℃预孵育3 min后,加入NADPH生成体系起始反应,孵育一定时间后,加入100 μL甲醇或乙腈终止反应。然后4 ℃,20 000×g离心10 min,取上清液20 μL进行HPLC分析。呋拉茶碱、8-甲氧补骨脂素是基于机理的抑制剂[7-9],所以它与人肝微粒体、缓冲液和NADPH产生体系在37 ℃孵育20 min后,加入探针底物起始反应,后续操作同上。探针底物及其产物的检测参考文献[10-11],所有孵育样品均做复管,结果取平均值。
为确定齐墩果酸和熊果酸是否为CYP基于机理的抑制剂,进行NADPH-时间依赖性的抑制实验。齐墩果酸或熊果酸(50 μmol·L-1)和NADPH产生体系、人肝微粒体孵育一定时间(0,5,10,15 min),加入相对应的底物起始反应,并测定活性。
1.3 齐墩果酸对CYP3A4抑制常数的测定
固定人肝微粒体蛋白浓度为0.5 mg·mL-1,孵育时间为30 min,咪达唑仑的终浓度选择10,25,50,100 μmol·L-1,作为抑制剂的齐墩果酸终浓度选择10,25,50,100 μmol·L-1。
使用Dixon作图法和Lineweaver-Burk作图法来确定抑制反应的类型,以Lineweaver-Burk作图所得斜率同齐墩果酸浓度的二次作图求得齐墩果酸的抑制动力学常数Ki。
2 结果
2.1 齐墩果酸和熊果酸对CYP亚型的抑制作用
齐墩果酸和熊果酸对CYP450酶活性的抑制作用结果见图1,在考察的8种CYP亚型当中,齐墩果酸对CYP3A4的活性抑制作用最强,抑制率接近50%,CYP1A2次之,对其他几种酶的活性抑制率都在30%以下,不具有统计学意义。熊果酸对8种酶的活性抑制率均小于20%,没有统计学意义。为了测定齐墩果酸和熊果酸对CYP各个亚型基于机理抑制作用的活性,进行了NADPH-时间依赖性的抑制试验。对所测定的CYP亚型,均没有发现NADPH-时间依赖性的抑制表现。
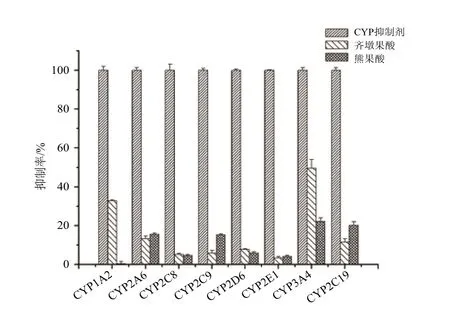
图1 齐墩果酸和熊果酸对CYP450酶活性的抑制率Fig 1 The inhibition ratio of oleanolic acid and ursolic acid on cytochromes P450
2.2 齐墩果酸对CYP3A4抑制常数的测定
根据抑制实验的结果(图1),齐墩果酸对CYP3A4酶的活性抑制超过了50%,因此我们进一步实验计算半数抑制浓度(IC50)和抑制常数(Ki)。齐墩果酸对CYP3A4催化咪达唑仑羟化反应的抑制程度随浓度增加而增强,在100 μmol·L-1的浓度范围内,其IC50值为(35.0±5.0) μmol·L-1(图2)。依据上述实验结果,我们进行了不同浓度的齐墩果酸对不同浓度的咪达唑仑羟化反应抑制效果的实验,所得到的数据用Dixon 和Lineweaver-Burk 作图处理(图3和图4)。由图可知,齐墩果酸对咪达唑仑代谢的抑制符合混合动力学行为,用Lineweaver-Burk作图所得斜率与齐墩果酸浓度二次作图求得齐墩果酸的抑制常数Ki为39.2 μmol·L-1(图5)。

图2 齐墩果酸对咪达唑仑羟化活性的抑制Fig 2 Inhibition effect of oleanolic acid on midazolam hydroxylation activity

图3 齐墩果酸对咪达唑仑羟化活性抑制效应的Dixon作图Fig 3 Dixon plot of inhibitory effects of oleanolic acid on midazolam hydroxylation activity
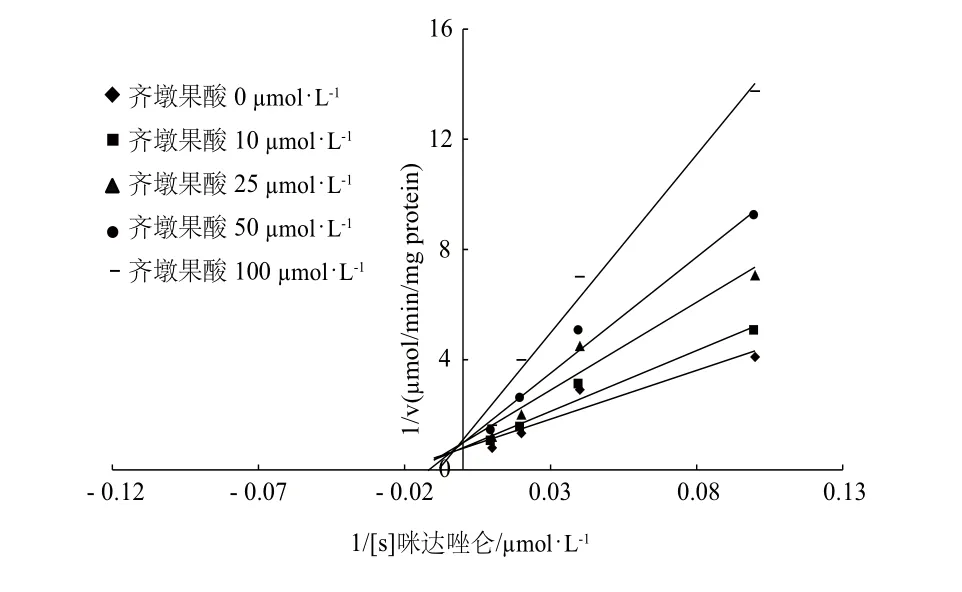
图4 齐墩果酸对咪达唑仑羟化活性抑制效应的Lineweaver-Burk 作图Fig 4 Lineweaver-Burk plots of inhibitory effects of oleanolic acid on midazolam hydroxylation acticity
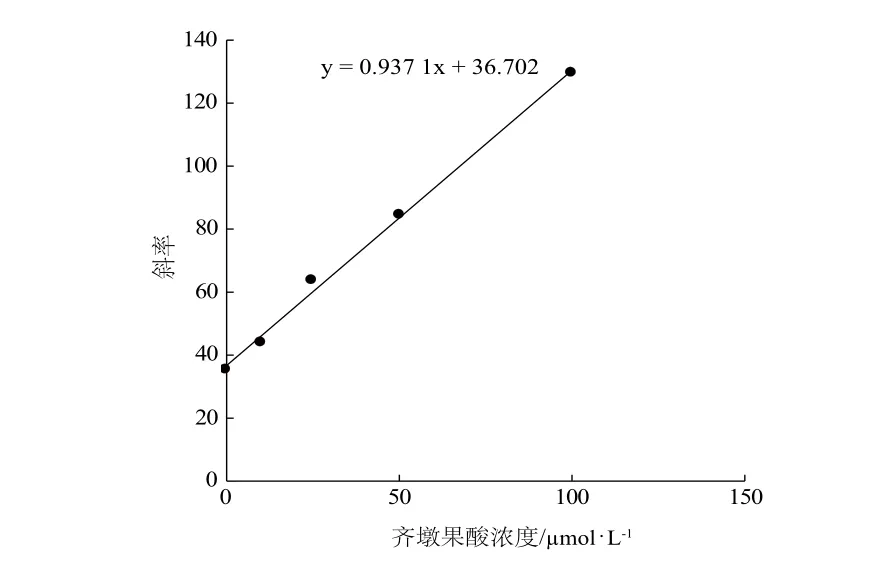
图5 Lineweaver-Burk作图得到的斜率与齐墩果酸浓度的二次作图Fig 5 Second plot of slopes from Lineweaver-Burk plot vs oleanolic acid concentrations
3 讨论
本文对比研究了齐墩果酸和熊果酸对8种主要CYP亚型的抑制效果。初步筛选结果表明熊果酸对CYP450酶的活性没有表现出明显的抑制,齐墩果酸对CYP1A2的活性有轻微的抑制作用,对CYP3A4活性有明显的抑制,在基于机理抑制的实验中,没有观察到NADPH-时间依赖性的抑制,排除了两者对CYP基于机理抑制的可能性。我们进一步研究齐墩果酸对CYP3A4酶的抑制常数,发现齐墩果酸可竞争性抑制CYP3A4探针药物咪达唑仑羟化反应的活性,并测得抑制常数Ki为39.2 μmol·L-1。由于CYP3A4酶是人体内一类非常重要的CYP代谢酶,临床半数以上的药物都要经它代谢转化[12],而且许多药物也是它的诱导或抑制剂,所以齐墩果酸对CYP3A4酶的抑制作用应引起我们的注意。
鉴于齐墩果酸和熊果酸是同分异构体,我们可以从结构上推测导致两者对CYP450酶抑制作用不同的原因。齐墩果酸和熊果酸的药理活性基团,比如羟基、双键和羧基的位置都一致[13],两者的区别仅在于E环的甲基异构,齐墩果酸的E环上两个甲基取代都在20位C上,而熊果酸的E环上19位和20位上各有一个甲基,结合实验结果我们可以推测E环甲基取代位置可能是影响对CYP抑制效果的主要因素,至于结构差异和抑制作用之间的关联程度需要进一步研究。
[1] Shapiro LE, Shear NH. Drug interactions/P450[J]. Curr Probl Dermatol, 2001, 13(3): 141-152.
[2] Wang X, Cheung CM, Lee WY,et al. Major tanshinones of Danshen (Salvia miltiorrhiza) exhibit different modes of inhibition on human CYP1A2, CYP2C9, CYP2E1 and CYP3A4 activities in vitro[J]. Phytomedicine, 2010, 17(11): 868-875.
[3] Xia CH, Sun JG, Wang GJ,et al. Herb-drug interactions: in vivo and in vitro effect of Shenmai injection, a herbal preparation, on the metabolic activities of hepatic cytochrome P450 3A1/2, 2C6,1A2, and 2E1 in rats[J]. Planta Med, 2010, 76(3): 245-250.
[4] 王奇,芦柏震. 齐墩果酸的研究进展[J]. 中国药房,2008,19(9):711-712.
[5] 王鹏,张忠义,吴忠. 熊果酸在药用植物中的分布及药理作用[J]. 中药材,2000,23(11):717-722.
[6] 王亚平,胡园,董瑞华,等. 齐墩果酸和熊果酸的人肝微粒体代谢研究[J]. 军事医学,2012, 36(5):368-371.
[7] Bjornsson TD, Callaghan JT, Einolf HJ,et al. The conduct of in vitro and in vivo drug-drug interaction studies: a PhRMA perspective[J]. J Clin Pharmacol, 2003, 43(5): 443-469.
[8] Huang SM, Temple R, Throckmorton DC,et al. Drug interaction studies: study design, data analysis, and implications for dosing and labeling[J]. Clin Pharmacol Ther, 2007, 81(2): 298-304.
[9] Harris JW, Rahman A, Kim BR,et al. Metabolism of taxol by human hepatic microsomes and liver slices: participation of cytochrome P450 3A4 and an unknown P450 enzyme[J]. Cancer Res, 1994, 54(15): 4026-4035.
[10] 国家药典委员会. 中华人民共和国药典(二部)[S]. 2010年版.北京: 中国医药科技出版社,2010:537-538.
[11] 张江伟. 药物代谢稳定性和药物相互作用的体外研究方法及其应用[C]. 北京:中国科学院研究生院,2008:43-68.
[12] Seripa D, Pilotto A, Panza F,et al. Pharmacogenetics of cytochrome P450 (CYP) in the elderly[J]. Ageing Res Rev, 2010,9(4): 457-474.
[13] 刘丹,孟艳秋,赵娟. 齐墩果酸和熊果酸结构修饰物的药理活性和构效关系研究进展[J]. 化学通报,2007,1:14-20.

