红法夫酵母甘露聚糖的提取
梁新乐,王俊虎
(浙江工商大学食品与生物工程学院,浙江杭州310012)
红法夫酵母甘露聚糖的提取
梁新乐1,王俊虎2
(浙江工商大学食品与生物工程学院,浙江杭州310012)
以红法夫酵母DMSO法提取虾青素后的剩余残渣为材料,经稀碱抽提以及费林试剂络合法提纯制取得到粉末状多糖,采用纸层析、红外光谱、高效液相、气相色谱分析最终分析确定该多糖为甘露聚糖,甘露聚糖得率4.65%,甘露糖与葡萄糖含量之比为4.3∶1;经理化测定其总糖占90.5%,甘露聚糖占78.6%,蛋白含量是4.42%。研究碱法制取红法夫酵母甘露聚糖的工艺条件,旨在为建立产业化可行的高效提取方法,拓宽红法夫酵母的应用领域提供参考。
红法夫酵母;甘露聚糖;提取
甘露聚糖是酵母胞壁外包被着的一层胶状糖蛋白,主链为D-甘露糖以α-(1,6)糖苷键形成的糖链[1-2],是一种极具市场潜力的绿色饲料添加剂和食品添加剂。酵母甘露聚糖可促进消化道内有益菌生长、维持消化道菌群动态平衡[3],有抗病毒、促进伤口愈合、抗肿瘤、抗氧化和抗辐射的等生理活性[4]。一些研究表明甘露聚糖有抗肿瘤作用,它和脂多糖协同诱导肿瘤坏死因子-α(TNF-α)。体外发现TNF-α对肿瘤具有直接溶解和抑制增殖的作用,在体内可引起肿瘤坏死,使肿瘤体积缩小甚至消退[5-6]。另外,甘露聚糖还是一种广谱的霉菌毒素吸附剂,它可以吸附饲料中的多种霉菌毒素,尤其对玉米赤霉烯酮、T-2毒素、伏马毒素,与之形成不可逆转的复合物,并随着粪便排出体外,从而避免霉菌毒素对动物体产生不良影响[7]。
红法夫酵母是生产虾青素的酵母,提取虾青素后还有大量的残渣未能综合利用。为此文章研究了从红
法夫酵母细胞壁中提取甘露聚糖的工艺条件以及各阶段提取物的理化性质,并对提取物进行了鉴定。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
甘露糖(BIO BASIC INC),葡萄糖(国药集团),木瓜蛋白酶(BIO SHARP)二苯胺(成都科龙),牛血清蛋白(TAKARA);展层剂(体积比):正丁醇∶冰醋酸∶水(4∶1∶5,体积比),充分振荡,静置后分层,弃去下层水层;显色剂:二苯胺2 g,苯胺2mL,85%磷酸10mL,浓盐酸1mL,丙酮100mL;单糖标准溶液:葡萄糖、甘露糖各0.100 0 g,溶于水,定容至25mL,葡萄糖和甘露糖浓度均为4.0 mg/mL;盐酸羟胺溶液:1-甲基咪唑溶液为溶剂,60g/L。
1.1.2 仪器与设备
U-2800紫外/可见分光光度计:HITACHI公司;GZX-9240 MBE数显鼓风干燥箱:上海博迅实业有限公司医疗设备厂;DKY-Ⅱ恒温调速回转式摇床:上海杜科自动化设备有限公司;FD-1冷冻干燥机:北京博医康实验仪器有限公司;MB45快速水分测定仪:美国奥豪斯仪器有限公司;H-2050R型高速冷冻离心机:湘仪仪器有限公司;RC6型高速冷冻离心机:SORVALL公司;NICOLET-380傅立叶红外光谱仪:美国热电公司;R-215旋转蒸发仪:瑞士Buchi公司;V-700可控速PTFE隔膜真空泵:瑞士Buchi公司;低温冷却液循环泵:上海豫康科技仪器设备有限公司。
1.2 方法
1.2.1 菌种与培养基
红法夫酵母(phaffia rhodozyma)4℃保藏于YM斜面,每三个月转接一次;YM培养基成分(质量浓度,g/L):葡萄糖10,蛋白胨5,酵母浸出粉5;发酵培养基成分(质量浓度,g/L):葡萄糖10,酵母浸出粉5,蛋白胨5,(NH4)2SO43,MgSO4·7H2O 2.75,KH2PO41.5,CaCl2·2H2O 0.2。培养基初始pH调为5.4,若为固体培养基需加入2.5%的琼脂粉。
1.2.2 培养条件
斜面上挑取一环菌种于YM液体培养基中,培养过夜后种子液以10%接种量接种到500mL三角瓶(含有YM培养基100mL)中,22℃,150 r/min条件下摇床振荡培养48 h~72 h。
1.2.3 分析方法
总糖含量的测定:苯酚-硫酸法[8];蛋白含量的测定:考马斯亮蓝法[9];粗蛋白含量的测定:凯式定氮法测定[10];甘露糖含量的测定:紫外分光光度法[11];水分含量的测定:快速水分测定仪测定;甘露聚糖纯度鉴定:纸层析;分子构型分析:红外光谱法;

回收率:称取一定量的葡萄糖加入相同体积的样品液中,在样品液水解条件下水解,最后测其含量,分别测三次求平均值,实验测其均值是0.85。
1.2.4 红法夫酵母残渣的获取
取发酵液于5 000 r/min下离心10 min,去离子水洗涤2次,收集菌体,用滤纸吸干管壁水滴,加入55℃预热的二甲亚砜(DMSO),振荡悬浮,加入丙酮,漩涡振荡20 s~30 s,4℃,7 000 r/min离心10 min,去离子水洗涤两次,收集残渣,如菌泥仍有色可重复抽提至白色为止[12]。
1.2.5 甘露聚糖提取工艺条件
洗净的酵母细胞(1 g湿菌体加入1mL 6%KOH)用6%KOH在80℃处理90 min后9 000 r/min,10 min离心,之后用6%KOH洗涤沉淀一次,合并上清液。按2∶1体积比加入费林试剂,0℃反应15 min,沉淀用0.5 mol/L NaCl清洗后溶解于4 mol/L的HCl(常温提3 h~4 h,1 g沉淀10mL HCl),用2倍体积乙醇4℃过夜得沉淀,9 000 r/min,10 min离心得粗甘露聚糖。取适量粗多糖在温度55℃,pH 9.0,碱性蛋白酶浓度1.3%的条件下酶解5 h。酶解结束后调pH为中性,透析48 h低温浓缩后冷冻干燥。费林试剂络合过程需重复3次。
1.2.6 纸层析
称取多糖样品10 mg,先用5mL 10 mol/L的硫酸水解5min钟后加水将硫酸浓度稀释至2 mol/L,封管后置于100℃水浴锅中水解6 h,使水解完全,水解产物用碳酸钡中和至pH 7.0,3 000 r/min离心10 min。取14 cm×15 cm滤纸,依次点样,点样量20μL,放入层析缸,当前沿离原点10 cm时停止,80℃恒温箱显色10 min[13]。
1.2.7 多糖分子量测定方法:高效凝胶过滤色谱法(HPGFC)
仪器:Waters 600高效液相色谱仪(配2410示差折光检测器和Empower工作站)。
色谱条件为色谱柱:UltrahydrogelTMLinear 300 mm×7.8mmid×2;流动相:0.1 mol/L硝酸钠;流速:0.9mL/min;柱温:45℃[14]。
样品制备:称取样品100 mg于25 ml容量瓶中,用流动相溶解,定容。
分子量校正曲线所用标准品(均购置于sigma公司):DextranT-2000(MW2000 000),DextranT-580(MW580 000),Dextran T-70(MW70 000),DextranT-10(MW10 000),Dextran T-5(MW2900),Maltaose(MW342)。
1.2.8 气相色谱分析单糖种类及含量
仪器:Agilent Technologies 7890A GC System。
色谱条件为色谱柱:TR-35MS;气化室250℃,检测器(FID)250℃,柱温160℃(保持10 min),以20℃/min速率升温至200℃(保持5 min),以30℃/min速率升温至230℃(保持5 min)。高纯N2作载气。柱流量1.20mL/min,分流比39∶1。
单糖标准物质的衍生:取单糖标准溶液1mL,冷冻干燥后。加入盐酸羟胺溶液1mL,充分溶解后,密封,90℃水浴反应20 min,取出后冷却至室温,加入0.5mL乙酸酐,混匀,室温反应10 min。加入5.0mL三氯甲烷萃取产物,加入蒸馏水多次水洗,至水相无色为止,最后加适量无水Na2SO4吸去残余水分[15]。
多糖水解液衍生:方法同上。
2 结果与分析
2.1 酵母粉和酵母残渣中各组分含量的比较
酵母粉是鲜酵母泥经冷冻干燥所得,酵母残渣经40℃恒温烘箱烘干所得,红法夫酵母提取虾青素前后的各成分变化见图1。

去除水分影响,酵母粉中总糖、粗蛋白、甘露糖的比例分别为42.15%、51.52%、10.53%,酵母残渣总糖、粗蛋白、甘露糖的比例分别为48.01%、41.83%、12.55%。提起虾青素后的细胞残渣蛋白质含量为原酵母粉的81.19%,多糖含量为原酵母粉的113.90%,甘露糖的含量是原酵母粉的125.12%。蛋白含量的降低以及总糖和甘露聚糖含量的升高都有利于以酵母残渣为原料进一步分离提取甘露聚糖。
2.2 甘露聚糖提取液理化特性研究
甘露聚糖提取液一般成分的含量见图2。
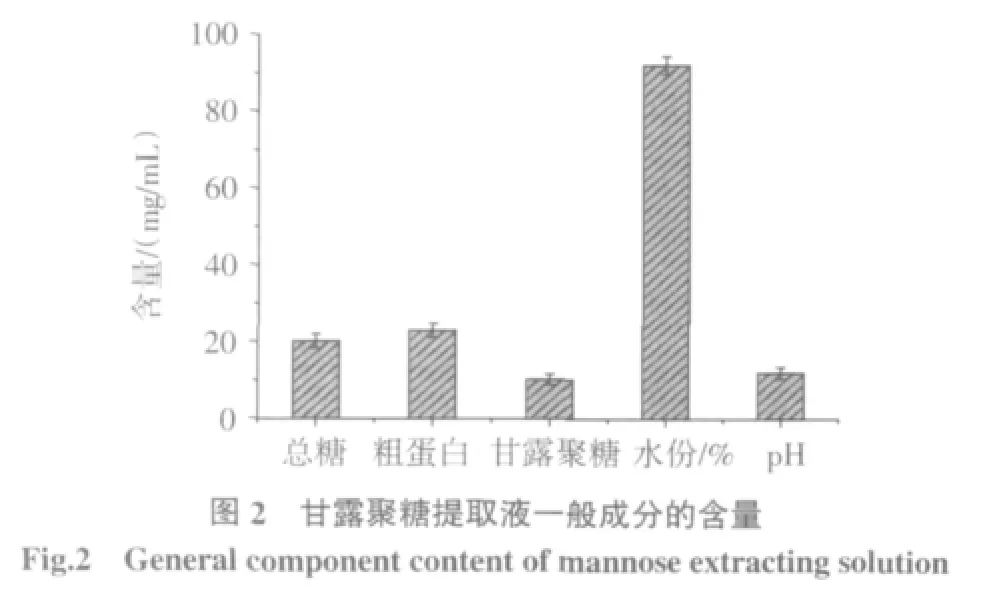
由图2可知,14.4 g干酵母残渣经碱提后可得到约100mL提取液,即含有1.012 g甘露聚糖,在此过程溶出率达70.08%,而沉淀中甘露聚糖占原料中甘露聚糖的16.23%,再次碱提甘露聚糖得率只有0.53%。较低的甘露聚糖浸提率主要是因为红法夫酵母细胞壁太厚。普通的酵母细胞壁是一个三层壁障致密结构,其外层为甘露聚糖形成的糖蛋白、中层为碱溶性β-葡聚糖,内层为坚硬的碱不溶性β-葡聚搪[16]。红法夫酵母的壁尤其坚硬,一般酵母经酸碱处理之后细胞壁都会被破坏,但是红法夫酵母长时间的高酸或高碱处理后部分细胞细胞壁仍然完整[17]。本文经络合法得粗多糖的得率为6.13%。
2.3 多糖样品纸层析鉴定
甘露聚糖初步定性一般采用薄层色谱和纸层析,多糖的单糖组成分析见图3。

从其中可看出纯化后的多糖样品水解产物与甘露糖单糖标准品对照,并没有出现二糖、三糖等寡糖的拖尾现象,这表明多糖样品本身已被彻底水解。
纯化后的多糖样品水解产物与甘露糖相对应位置上显示相同的斑点,由此可知稀碱抽提以及费林试剂络合法提纯酵母多糖的单糖组成主要为甘露糖[18]。
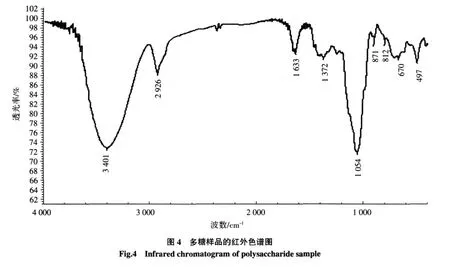
2.4 多糖样品的红外色谱
精制样品经KBr压片,在4 000 cm-1~400 cm-1区间进行红外光谱扫描。红外图谱中含有多个多糖类物质的特征吸收峰。图4是多糖样品的红外色谱图,如图在3 401 cm-1处是O-H伸缩振动引起的特征吸收,1 054 cm-1处为O-H变角振动峰,在2 926 cm-1和1 372 cm-1处有两组糖类C-H特征峰,分别代表了糖类C-H伸缩振动与变角振动,1 633 cm-1处有C-O非对称伸缩振动峰,870及810 cm-1处有不明显吸收峰,说明含甘露糖[19]。
2.5 多糖分子量分布
图5是甘露聚糖HPLC色谱图,从图5中可知甘露聚糖为单一对称峰,这说明经Fehling试剂纯化后的甘露聚糖为均一组分。

2.6 气相分析单糖种类
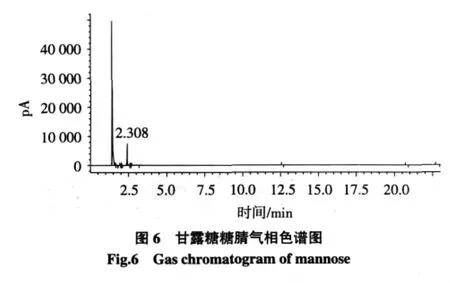
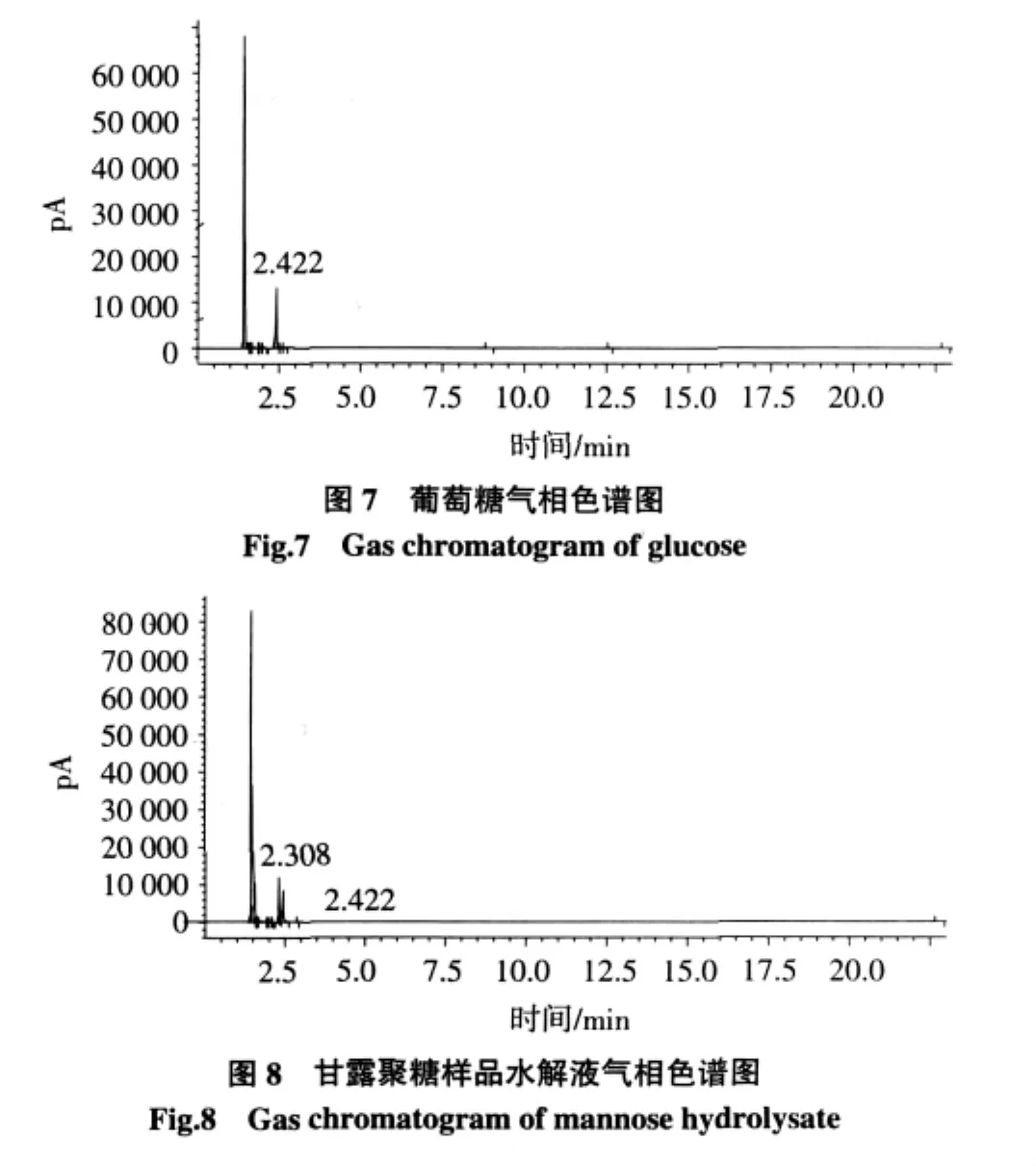
精制样品的糖腈乙酸酯气相色谱图中出现两个峰,对比标准单糖保留时间确定其为甘露糖和葡萄糖,根据二者的峰面积可知在甘露聚糖中甘露糖和葡萄糖的含量比是4.3∶1(如图6~8)。综合前面的分析可知样品为甘露聚糖。
经理化测定该方法甘露聚糖得率是4.65%,总糖占90.5%,甘露聚糖占78.6%,蛋白含量是4.42%,多糖产品为白色粉状固体,无毒,无异味,易溶于水,没有溶胀现象,溶液有黏性,pH为6.8。
3 结论
甘露聚糖的提取方法有多种:酶法、高温高压浸提法、碱浸提法、自溶法。酶法尽管比较温和,但对酶的纯度和专一性要求都比较高,并且酶法只能将甘露聚糖一部分水解下来[20]。高温高压柠檬酸盐缓冲液浸提方法和高压短时低酸法对设备的要求比较高,其环境温度≥120℃,并且所得产物中β-葡聚糖所占比例也相对较高[19]。经过DMSO法处理后红法夫酵母活性也不高,无法采用自溶法,综上考虑本文采用碱浸提法。
相对来说,碱浸提取法条件比较温和,操作条件易于控制,水解作用主要是位于细胞壁中间的蛋白质层[21]。此法使细胞中蛋白大部分转化为氨基酸,余下蛋白经碱性蛋白酶即可处理,所得甘露聚糖中基本上不含蛋白质。
文章研究了甘露聚糖的提取方法,采用纸层析,红外光谱,分子量,气相色谱分析最终确定提取多糖为甘露聚糖,其得率是4.65%,经气相色谱可知甘露聚糖中甘露糖与葡萄糖含量之比为4.3∶1;总糖占90.5%,甘露聚糖占78.6%,蛋白占4.42%。
[1]艾自明,任慧霞.酿酒酵母胞壁多糖研究概述[J].中南药学,2009,7(10):762-765
[2]Kogan G,Pavliak V,andula J,et al.Structure of the cell wall mannans of the pathogenic yeasts of Candida species—A complex insight[J].Carbohydrate polymers,1990,14(1):65-76
[3]孙建义,李卫芬.啤酒酵母甘露聚糖的提取及其对鸡肠道微生物区系的影响[J].浙江大学学报:农业与生命科学版,2001,27(4):447-450
[4]郭振楚.糖类化学[M].北京:化学工业出版社,2005:59-62
[5]Lene J,Martinus L,Stian L,et al.Combined cell wall polysaccharide,mycotoxin and bacterial lipopolysaccharide exposure and inflammatory cytokine responses[J].APMIS,2009,117(7):507-517
[6]Mihai G,Netea,Neil A R,et al.Immune sensing of Candida albicans requires cooperative recognition of mannans and glucans by lectin and Toll-like receptors[J].The journal of clinical investigation,2006,116(6):1642-1650
[7]杨乃欢,李彪.新型霉菌毒素吸附剂—酵母细胞壁提取物[J].中国牧业通讯,2009(21):23-24
[8]宫艳艳.酵母葡聚糖脂肪替代品的研究[D].无锡:江南大学,2009:10-11
[9]王学圭.植物生理生化实验原理和技术[M].2版.北京:高等教育出版社,2006:190-191
[10]李亦兵,缪丽雯.食品分析[M].北京:中国轻工业出版社,2002:235-237
[11]张运涛.啤酒废酵母甘露聚糖的研究[D].无锡:无锡轻工大学,1999:19-25
[12]郑宗宝.基于基因组重排技术的红法夫酵母虾青素高产株选育[D].天津:天津大学,2009:22-23
[13]王元秀,李峰.酵母多糖的提取、组分分析及对小鼠免疫功能的影响[J].食品与药品,2009,11(7):26-28
[14]王静,戴军,陈尚卫,等.提取酵母细胞壁中β-D-葡聚糖的新方法[J].食品与发酵工业,2011(1):189-193
[15]廖燕芝,杨代明,张继红,等.气相色谱法测定魔芋食品中葡甘聚糖及淀粉含量[J].食品与生物技术学报,2008,27(4):66-69
[16]汪立平,王锡昌,陈有容,等.啤酒废酵母甘露聚糖的制备[J].食品科学,2009,30(2):134-137
[17]Xiao A F,N Hui,Cai H N,et al.An improved process for cell disruption and astaxanthin extraction from Phaffia rhodozyma[J].World J Microbiol Biotechnol,2009(25):2029-2034
[18]杜丹,赵春燕.啤酒酵母残渣提取甘露聚糖的研究[J].啤酒科技,2006(6):19-21
[19]汪文俊,刘玉兰.红法夫酵母甘露聚糖的提取与鉴定[J].湖北农业科学,2008,47(5):584-586
[20]Valentin E,Herrero W E,Pastor J,et al. Solubilisation and analysis of mannoprotein molecules from the cell wall of Saccharomyces cerevisiae[J].Journal of general microbiology,1984,130 (6):1419-1428
[21]Ballou C.Structure and biosynthesis of the mannan component of the yeast cell envelope[J].Advances in microbial physiology,1976,14(11):93-158
Extraction Mannan from Phaffia Rhodozyma
LIANG Xin-le1,WANG Jun-hu2
(College of Food Science and Biotechnology Engineering,Zhejiang Gongshang University,Hangzhou 310012,Zhejiang,China)
A kind of mannan was extracted from phaffia rhodozyma dregs which came from discarded phaffia rhodozyma after astaxanthin extracted and was fractionated by dilute alkali and Fehling's solution,etc.It was identified by assay of paper chromatography,infrared spectrum infrared spectroscopy,high performance liquid chromatography and gas chromatogram.The result indicated that the extractability was 4.65%,and the ratio of mannose and glucose was 4.3∶1 with 90.5%total sugar,78.6%mannan,4.42%protein.This paper studied the condition of producing mannan by chemical method.This research provides the basis for expanding the application of phaffia rhodozyma.
phaffia rhodozyma;mannan;extract
梁新乐(1969—),男(汉),教授,博士,主要研究方向:工业微生物菌种的筛选与发酵工程、生物转化与酶催化、微生物生态学。
2011-11-17

