荧光小分子2-氨基-7-甲基-1,8-萘啶与存在碱基缺失损伤的dsDNA相互作用的研究*
高强 苑霞青 王玮 漆红兰
(陕西师范大学化学化工学院 陕西西安 710062)
为适应大学化学实验课程中综合创新型实验教学改革的需要,教师应不断设计出理论合理、表征方法(技术)先进、并能激发学生创造潜能的综合创新型实验[1-2]。因此,在现有化学实验教学体系基础上,探索通过实验教学提高学生创新能力的途径和方法,使学生接触更多学科前沿、更多技术手段的科研实践是必要的。
我们结合科研工作,开发了综合创新型教学实验——荧光小分子2-氨基-7-甲基-1,8-萘啶(AMND)与存在碱基缺失损伤的dsDNA相互作用的研究[3]。设计的各部分实验内容既相互联系,又各自独立,使学生能从各分支学科的结合上学习解决综合性问题的方法,进一步提高科学思维能力和创新意识。
本实验要求学生学会计算给定序列单链DNA的摩尔吸光系数,并掌握配制准确浓度的单链DNA(ssDNA)溶液的方法,使用紫外-可见分光光度法研究小分子和dsDNA的相互作用,用荧光滴定法测量小分子与dsDNA的结合常数,学习用圆二色光谱表征小分子与dsDNA相互作用并对光谱变化提出合理的解释,考察影响小分子与dsDNA相互作用的因素。
1 实验目的
学习利用光谱学方法研究DNA与小分子相互作用的原理;掌握紫外-可见光谱仪,荧光光谱仪及圆二色光谱仪的原理和使用;熟悉小分子与DNA相互作用、分子识别、弱相互作用等概念。
2 实验原理
DNA存储着生物体的遗传信息,因此维护DNA分子的完整性对细胞至关重要。外界环境和生物体内部的因素都可能导致DNA分子的损伤或改变,此类损伤往往会对细胞乃至生物体造成严重影响。单个碱基缺失位点(AP位点)是DNA损伤的主要类型,因此AP位点的含量水平是评价细胞DNA损伤的一个非常有效的指标。本实验设计了一个荧光检测AP位点的方法,实验原理如图1所示。AP位点的出现导致双链中AP位点处的碱基成为未配对碱基且在未配对碱基对面形成疏水空腔,这一空腔为DNA靶向小分子通过氢键选择性结合到AP位点的未配对碱基提供了必要的疏水环境。2-氨基-7-甲基-1,8-萘啶(AMND)是一种具有抗菌和抗癌活性的DNA靶向杂环小分子,具有良好的荧光性质且能和胞嘧啶形成很好的氢键结合[4]。在AMND溶液中加入AP位点损伤的dsDNA,AMND就会进入dsDNA中的AP位点,通过氢键结合对面的胞嘧啶碱基。这一结合过程伴随着AMND荧光的明显猝灭。通过检测小分子荧光强度的变化,不仅可以检测dsDNA中AP位点的存在,还可以确定AP位点处的碱基类型。本实验现象明显,重复性好,所有试剂和药品都是商品化试剂且价格便宜,整个实验过程没有特别复杂的操作,因而比较适合作为本科生综合创新实验。
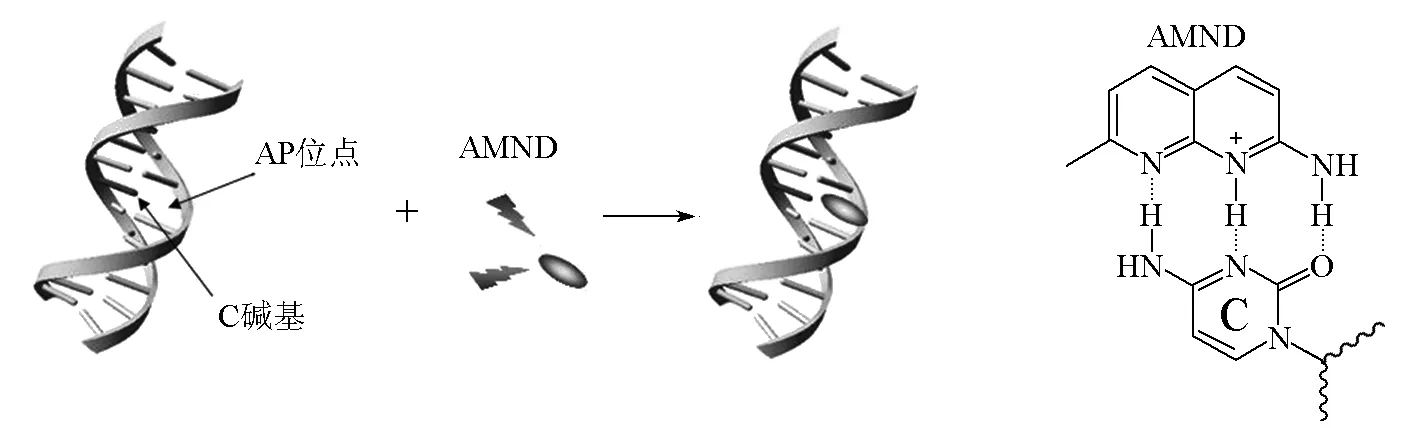
图1 实验原理及AMND与胞嘧啶形成的氢键结构
3 试剂与仪器
3.1 试剂

3.2 仪器
UV-2450PC紫外-可见分光光度计(日本岛津),Cary Eclipse荧光仪(美国瓦里安),圆二色光谱仪(Chirascan Instrument,Applied Photophysics Ltd,UK),PCR仪。
4 实验内容
4.1 DNA储备液的配置
将装有ssDNA的离心管在4000r/min的转速下离心10min,按照说明书加入适量的超纯水溶解,振荡离心后得到ssDNA储备溶液。吸取10μL该溶液至离心管中,稀释10~20倍后,测量其在260nm处的吸光度。根据文献计算ssDNA的摩尔吸光系数[5],依据朗伯-比尔定律计算稀释后的ssDNA溶液浓度,推算储备ssDNA溶液浓度。将ssDNA储备液保存在5℃冰箱中,实验前用缓冲溶液稀释。
4.2 AMND溶液的配制
配制2.0×10-3mol·L-1AMND储备溶液的方法如下:用分析天平准确称取AMND,用超纯水溶解定容至100mL。将储备液装入棕色试剂瓶保存在5℃冰箱中,实验前用缓冲溶液稀释。
4.3 dsDNA 的制备
为得到配对工整且存在AP位点的dsDNA,需将两个ssDNA溶液等量混合后放入PCR仪中进行温育。控温程序为:将溶液升温至75℃,停留10min,然后以-0.5℃/min的速度缓慢降温至5℃并停留10min,之后使其自然恢复到室温。
4.4 AMND的紫外和荧光光谱
配制合适浓度的AMND溶液,以空白缓冲溶液为参比溶液在200~400nm范围内进行光谱扫描,找到AMND的最大吸收波长。然后以AMND的最大吸收波长为激发波长,扫描AMND的荧光光谱。
4.5 紫外-可见分光光度法考察dsDNA与AMND的相互作用
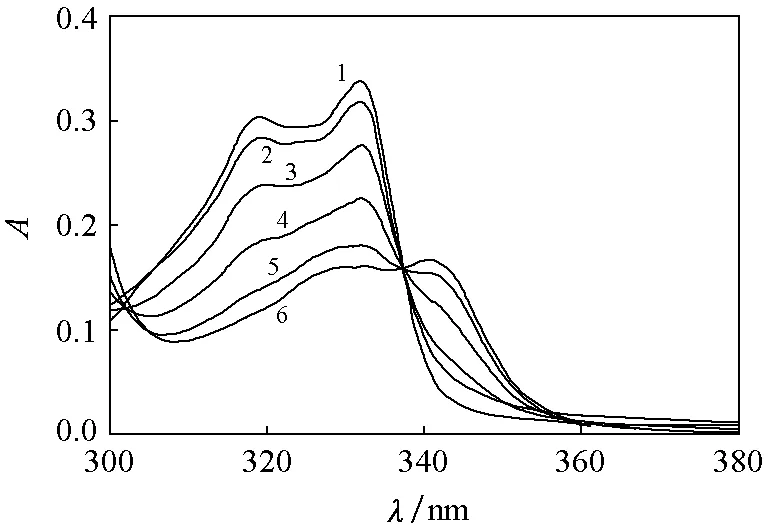
图2 AMND与dsDNA相互作用的紫外-可见光谱图dsDNA的浓度:1—0mol·L-1;2—5.0×10-6mol·L-1;3—1.0×10-5mol·L-1;4—2.5×10-5mol·L-1;5—5.0×10-5mol·L-1;6—1.0×10-4mol·L-1
4.6 荧光法测量AMND和dsDNA的结合常数

图3 AMND荧光强度随dsDNA浓度的变化曲线dsDNA的浓度:1—0mol·L-1;2—5.0×10-6mol·L-1;3—1.0×10-5mol·L-1;4—2.0×10-5mol·L-1;5—2.5×10-5mol·L-1;6—6.0×10-5mol·L-1
4.7 圆二色光谱(CD)测量
配制两份溶液,分别为dsDNA(4.0×10-5mol·L-1)溶液和AMND(1.0×10-4mol·L-1)-dsDNA(4.0×10-5mol·L-1)的混合溶液。依次将两个溶液放入圆二色光谱仪,在200~400nm波长范围内扫描。结果如图4所示,单独的dsDNA在280nm处出现正峰,250nm处出现负峰,符合dsDNA的B型双螺旋的特征。当加入AMND后,dsDNA的光谱发生了很大变化,280nm处的正峰降低,250nm处的负峰有所增强。这表明dsDNA在与AMND结合后其构象发生了变化。

图4 与AMND作用前后dsDNA 的圆二色光谱图
4.8 考察影响AMND与dsDNA相互作用的因素
改变溶液pH(pH 分别为6.5,7.0,7.4,8.0)及离子强度(NaCl浓度分别为0.1mol·L-1,0.2mol·L-1,0.5mol·L-1,1.0mol·L-1)等条件,重复上述实验,观察各因素对AMND与dsDNA相互作用的影响并解释可能的原因。
5 思考题
(1) 小分子为何能在水溶液中通过氢键相互作用结合到胞嘧啶(C)。
(2) AMND结合到胞嘧啶碱基时为什么会产生荧光猝灭。
(3) 如果AP位点处的碱基是其他碱基,AMND是否也可以与dsDNA结合并产生荧光猝灭。
本实验综合运用了多种操作方法,使用了多种仪器,可以提高学生对各种现代化仪器的认知能力和操作能力; 同时本实验又涉及到前沿研究的热点——DNA与小分子的相互作用,有利于激发学生的学习热情和培养学生的创新意识。
[1] 张建民,陈卫华,石秋芝.大学化学,2011,26(1):66
[2] 张雷,杨良准.大学化学,2010,25(4):55
[3] 胡亮亮,薄红艳,高强,等.中国科学:化学,2011,41(11):1732
[4] Sato Y,Nishizawa S,Yoshimoto K,etal.NucleicAcidsRes,2009,37:1411
[5] Puglisi J D,Tinoco I Jr.MethodEnzymol,1989,180:304
[6] Connors K A.Binding Constants.New York:John Wiley & Sons,1987

