肝豆状核变性的诊断与治疗进展*
李光明 范建高
肝豆状核变性,又称Wilson病,是一种以原发性铜代谢障碍为特征的常染色体隐性遗传病,位于13号染色体长臂的ATP7B基因突变是其发病的主要分子机制[1]。ATP7B基因主要在肝细胞表达,其编码的p型铜转运ATP酶位于肝细胞高尔基体外侧,功能是转运肝细胞内的铜,合成铜蓝蛋白并将铜排入胆汁。ATP7B基因突变可引发铜蓝蛋白合成障碍及胆道排铜障碍,导致过量的铜沉积在肝脏、大脑及角膜等全身各处,引发相应组织器官病变[1~3]。肝豆状核变性患病率约为1/30万,致病基因携带率为1/90~150,ATP7B基因突变类型超过500种,其中380种被证实在肝豆状核变性发病中起主要作用。肝豆状核变性可发生于任何年龄,主要见于5~35岁年龄段,40岁以上发病者约占3%[4]。
一、临床表现
临床表现变异很大,主要取决于铜沉积导致靶组织器官损伤的程度。特征性表现包括肝病症候群、神经精神症状、角膜 Kayser-Fleischer( K-F) 环和急性溶血症象[5]。肝病症候群以儿童常见,包括从轻微肝酶异常、慢性隐源性肝炎、肝硬化到暴发性肝衰竭的各种表现,也称肝病型肝豆状核变性。神经精神症状包括强直、痉挛、振颤、共济失调、构音困难、流涎和不随意运动,多见于20~30岁的青年人,也称神经型肝豆状核变性。Coombs阴性的溶血性贫血是除肝病和神经精神症状以外最常见的表现,有时可能是肝豆状核变性唯一的初发症状,明显的溶血通常与严重肝病甚至急性肝功能衰竭相关,肝细胞大量坏死导致蓄积于肝细胞的铜大量释放入血诱发急性严重溶血[6]。其他少见症状包括:巨人症、氨基酸尿、肾结石、肾钙化、心肌病、甲状旁腺功能减退、胰腺炎、不孕、反复流产等[1]。
二、诊断
肝豆状核变性早期诊断非常困难,除非对肝豆状核变性家庭成员进行基因筛查,否则很难发现无症状型患者[7]。肝豆状核变性的诊断主要基于特征性临床表现(K-F环、神经精神症状、Coombs阴性的溶血)、实验室检查(血清铜蓝蛋白、24h尿铜定量、肝铜含量)以及ATP7B基因突变检测。
(一)临床诊断 2001年第8届国际肝豆状核变性会议提出肝豆状核变性诊断积分系统,具有很好的准确性和实用性(表1)[8]。基于肝豆状核变性积分系统评估,4分及以上可以确诊;3分为可能性诊断;小于3分可排除肝豆状核变性[8,9]。基于特征性临床表现,肝豆状核变性可分为肝病型、神经型、混合型和无症状型等临床类型,前3种类型也称症状型[5]。
(二)肝豆状核变性相关急性肝衰竭[10]肝豆状核变性约占急性肝功能衰竭病因的5%,肝豆状核变性所致急性肝衰竭如不进行紧急肝移植,患者死亡率很高。如何早期确定肝豆状核变性是急性肝衰竭的病因是临床最大的挑战之一。快速且易于获得的实验室指标如ALP、总胆红素以及ALT/AST比值等可对肝豆状核变性所致急性肝衰竭做出快速而准确的评估。血清ALP/TBIL比值增高(<4以及AST/ALT比值>2.2),诊断肝豆状核变性相关急性肝衰竭的敏感性和特异性都为100%。
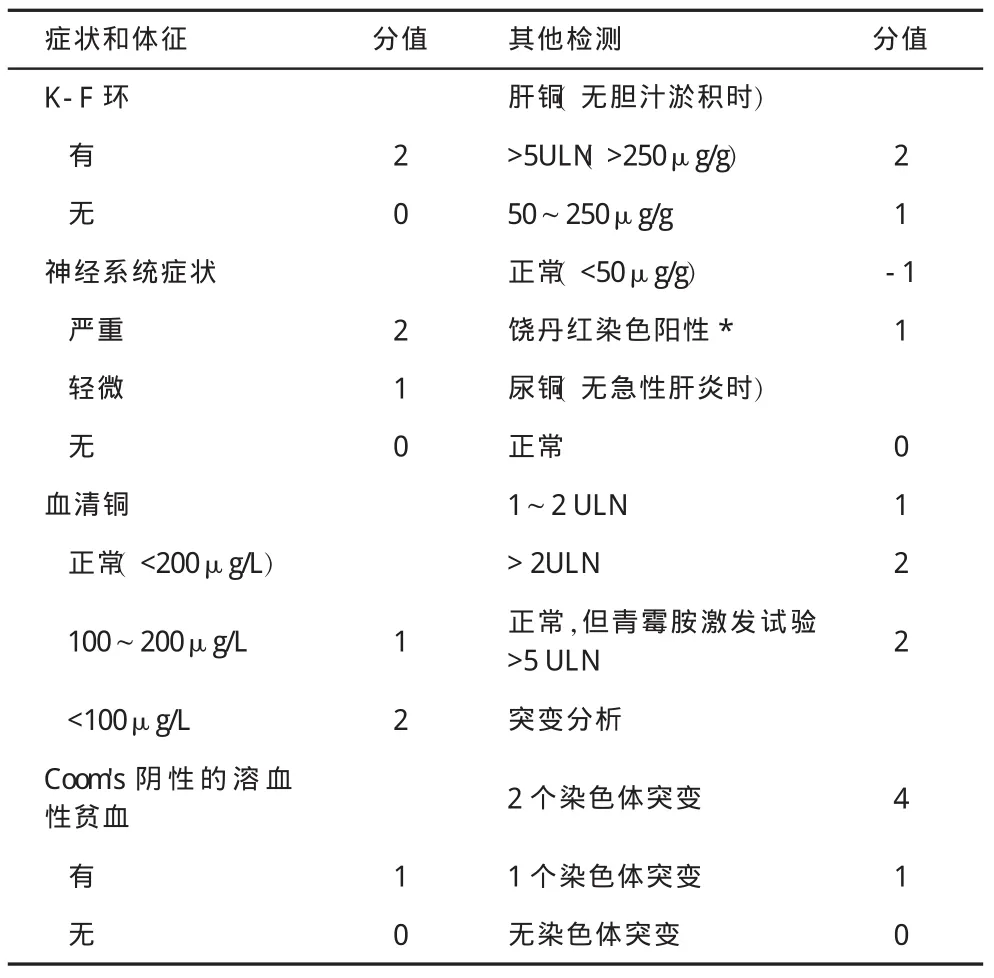
表1 Wilson病诊断评分系统
三、治疗
根据生化或遗传方法诊断的无症状型病例预后最佳,一旦出现失代偿期肝硬化和严重神经系统症状则即使治疗也难以完全缓解病情。
(一)治疗原则 肝豆状核变性一旦确诊则需坚持终身治疗,治疗措施主要包括:1.低铜饮食,避免食用含铜量高的食物(如肝脏、贝壳类、蟹虾、巧克力、蚕豆、坚果等),每日饮食铜的摄入在初始治疗和维持治疗时应分别小于1mg和1.5mg。应鼓励患者维持一种健康的生活方式,包括避免饮酒和肥胖;2.促进铜的排泄,减少铜的吸收[1,5];3.必要时进行肝脏移植。
(二)药物治疗 包括D-青霉胺、曲恩汀、锌制剂、二巯基丙磺酸钠等,至今对现有药物的疗效评估尚缺乏高质量循证医学证据。建议所有症状型患者接受一种螯合剂(D-青霉胺或曲恩汀)治疗;锌制剂仅作为神经型和无症状型肝豆状核变性的一线治疗[1]。目前主张单药治疗,尚不清楚联合用药是否疗效更好。为避免螯合剂中和锌制剂而影响疗效,联合用药者则需错时服药。监测24h尿铜排泄和血清非铜蓝蛋白结合铜,有助于评估治疗的依从性和用药剂量是否过度[1,9]。中止螯合剂治疗者有可能会迅速发生肝损伤和肝功能不全,并且可能出现一些新的神经系统异常,此时即使重新开始螯合剂治疗,通常肝损伤也难以逆转。
D-青霉胺[11~13]通过直接与铜螯合并诱导金属巯蛋白(一种富含半胱氨酸的内源性金属螯合剂)合成,促进尿铜排泄。适用于肝病型肝豆状核变性的治疗。D-青霉胺主要通过肾脏排泄,半衰期为1.7~7h。 治疗剂量:成人 750~1500mg.d-1,儿童 20~30mg.kg-1.d-1,分2~4次口服;维持剂量:成人与儿童均为15mg.kg-1.d-1。应空腹用药,最好在餐前1h或餐后2h或睡前口服,从小剂量开始并逐渐加量以改善患者的耐受性。起始剂量125~250mg.d-1,每4~7d增加250mg,直至最大剂量1000~1500mg.d-1。直接口服1500mg.d-1或更高剂量D-青霉胺可导致不可逆性神经损害。另外,D-青霉胺可干扰胶原交联并具有免疫抑制作用。因此,手术、创伤或分娩期间应适当减量。肝功能异常和临床症状常在D-青霉胺治疗2~6月后开始改善,随着治疗时间的延长,肝病进一步康复。不能坚持治疗将导致肝病快速进展,并常于中断治疗1~2月内发生肝功能衰竭。用药后肝豆状核变性的神经精神症状改善很慢,有些甚至在D-青霉胺治疗3年后才能观察到神经精神症状的改善,甚至有10%~50%患者于D-青霉胺治疗起始阶段发生神经症状恶化。D-青霉胺副作用较多,约30%患者因不能耐受而需调用其他药物治疗。早期(1~3周)副作用包括发热、皮疹、淋巴结肿大、中性粒细胞和血小板减少、蛋白尿等。如果出现严重的骨髓毒性、肾毒性(表现为蛋白尿、血尿)、狼疮样综合征以及肺出血-肾炎综合征,则须立即停药并及时改用其他药物治疗。
曲恩汀也是一种铜螯合剂,主要通过促进尿铜排泄起作用。主要用于青霉胺不能耐受或用青霉胺复发的肝豆状核变性患者,也可作为一线治疗用于失代偿期肝病患者[5,13]。 治疗剂量:成人 900~1500mg.d-1,儿童 20 mg.kg-1.d-1,分 2~3 次口服;维持剂量:成人儿童均为15mg.kg-1.d-1。在餐前1h或餐后3h服用。在治疗的起始阶段也可出现神经症状恶化,但较D-青霉胺少见。
锌主要通过干扰铜的吸收及诱导肠粘膜上皮细胞合成金属巯蛋白而起作用。适用于神经型和无症状型肝豆状核变性的一线治疗。用于肝病型患者时需谨慎,因有锌制剂引起肝功能恶化甚至死亡的报道。常用的锌盐制剂包括硫酸锌、乙酸锌和葡萄糖酸锌。治疗剂量:成人为元素锌150mg.d-1;儿童(<50kg)为75mg.d-1,分三次口服,餐前30分钟服用。维持剂量:成人 75~150mg.d-1,儿童 50~75 mg.kg-1.d-1。有限的非对照研究显示,锌制剂治疗肝病型患者的效果远远不如螯合剂[14]。新西兰学者发现锌剂对神经型患者疗效很好,但对肝病型效果并不满意[15]。锌制剂副作用相对较小,主要为胃肠道反应,甚至引起血清脂肪酶和/或淀粉酶增高,但临床及影像学检查无胰腺炎证据。
二巯基丙磺酸钠为重金属中毒的解毒剂,主要用于对青霉胺过敏或难以耐受D-青霉胺治疗的症状型肝豆状核变性患者。用量用法:5mg.kg-1.d-1溶于5%葡萄糖溶液500ml静脉滴注,连续应用5天后停药2天,7天为1个疗程,连续应用6~10个疗程。不良反应主要为食欲减退及轻度恶心、呕吐,约5%患者可于治疗早期发生神经症状恶化。
(三)肝移植 适用于肝豆状核变性所致的急性肝衰竭或失代偿期肝硬化患者。Schilsky分析了美国和欧洲55例因肝豆状核变性而进行的肝移植,其中失代偿期肝硬化33例,急性肝衰竭22例。在接受原位肝移植后中位生存期2.5年,1年生存率79%,最长存活时间为20年。有限的观察发现,神经型患者在肝移植后,部分出现神经症状改善,部分发生神经系统病变恶化[1,16]。对于积极驱铜治疗无效的终末期肝病特别是暴发性肝衰竭患者需考虑进行肝脏移植。对于一些有严重肝病且不能耐受药物治疗者需要早期进行肝移植。严重的神经系统疾病在肝移植后可以改善,但这方面临床结果有争议。因此不推荐神经型肝豆状核变性患者进行肝移植。
(四)妊娠期患者的治疗 成功的治疗后肝豆状核变性妇女可以妊娠,生育纯合子孩子的可能性为0.5%,妊娠前应对配偶进行单倍体分析。尽管对D-青霉胺致畸性有疑虑,但中断治疗的风险远大于持续治疗。有研究报道D-青霉胺持续治疗的122例次妊娠,分娩正常婴儿119例。印度学者报道,D-青霉胺治疗的妊娠妇女有较高的流产率。D-青霉胺致畸的最大危险是在妊娠起始3个月内。因此,推荐妊娠前3个月适当减少D-青霉胺剂量,力争在整个妊娠期维持低剂量治疗。推荐妊娠最后3个月将螯合剂剂量减少至300~600mg.d-1,以避免因铜过低影响胎儿供应以及不利于妊娠结束后的伤口愈合。螯合剂治疗期间不推荐哺乳[8,17,18]。
[1]European Association for Study of Liver.EASL clinical practice guidelines:Wilson's disease.J Hepatol,2012,56( 3):671-685.
[2]Schilsky ML.Wilson’s disease:new insights into pathogenesis,diagnosis,and future therapy.Curr Gastroenterol Rep,2005,7( 1):26-31.
[3]Tao TY,Gitlin JD.Hepatic copper metabolism:insights from genetic disease.Hepatology,2003,37( 6):1241-1247.
[4]Weiss KH,Stremmel W.Evolving perspectives in Wilson’s disease:diagnosis,treatment and monitoring.Curr Gastroenterol Rep,2012,14( 1):1-7.
[5]Rosencrantz R,Schilsky M.Wilson’s disease:Pathogenesis and clinical considerations in diagnosis and treatment.Semin Liver Dis,2011,31( 3):245-259.
[6]Morgan SM,Zantek ND.Therapeutic plasma exchange for fulminant hepatic failure secondary to Wilson's disease.J Clin Apher,2012,[Epub ahead of print].
[7]Bennett J,Hahn SH.Clinical molecular diagnosis of Wilson’s disease.Semin Liver Dis,2011,31( 3):233-238.
[8]Huster D. Wilson’s disease. Best Pract Res Clin Gastroenterol,2010,24( 5):531-539.
[9]Roberts EA,Schilsky ML.Diagnosis and treatment of Wilson’s disease:an update.Hepatology,2008,47( 6):2089-2111.
[10]Korman JD,Volenberg I,Balko J,et al.Screening for Wilson’s disease in acute liver failure:a comparison of currently available diagnostic tests.Hepatology,2008,48( 4):1167-1174.
[11]Medici V,Trevisan CP,D'Inca R,et al.Diagnosis and management of Wilson's disease:results of a single center experience.J Clin Gastroenterol,2006,40( 10):936-941.
[12]Lewis BK,Chern PL,Stone MS.Penicillamine-induced elastosis of the mucosal lip.J Am Acad Dermatol,2009,60( 4):700-703.
[13]Fox AN,Schilsky M.Once daily trientine for maintenance therapy of Wilson’s disease.Am J Gastroenterol,2008,103( 2):494-495.
[14]Weiss KH,Gotthardt DN,KlemmD,et al.Zinc monotherapy is not as effective as chelating agents in treatment of Wilson’s disease.Gastroenterology,2011,140( 4):1189-1198.
[15]Linn FH,Houwen RH,van Hattum J,et al.Long-term exclusive zinc monotherapy in symptomatic Wilson’s disease:experience in 17 patients.Hepatology,2009,50( 5):1442-1452.
[16]Arnon R,Annunziato R,Schilsky M,et al.Liver transplantation for children with Wilson’s disease:comparison of outcomes between children and adults.Clin Transplant,2011,25( 1):E52-60.
[17]Sinha S,Taly AB,Prashanth LK,et al.Successful pregnancies and abortions in symptomatic and asyptomatic Wilson's disease.J Neurol Sci,2004,217( 1):37-40.
[18]范建高.非感染性肝病诊疗新进展.北京:人民军医出版社,2011:54-69.