肝衰竭患者外周血单个核细胞hTERT mRNA水平及其与临床预后的关系*
方 焕 朱传武 陈 明
人端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)催化亚单位可用于评估肿瘤患者病情复发与预后,但用其评估肝衰竭患者的治疗疗效和预后尚未见报道。目前已有研究证实肝癌患者外周血单个核细胞(PBMCs)端粒酶活性可以准确反映癌组织端粒酶的表达情况,检测PBMCs端粒酶活性可以作为一种灵敏、微创的早期诊断肝癌的方法[1]。本研究试图通过观察60例肝衰竭患者入院时以及治疗后28天PBMCs hTERT mRNA的动态变化,以探讨hTERT mRNA在肝衰竭预后判断中的价值。
资料与方法
一、病例来源 选择2010年11月至2011年8月我科收治的肝衰竭患者60例,男46例,女14例,年龄20~73岁,平均年龄47.0±13.4岁。其中亚急性肝衰竭2例,慢加急性或亚急性肝衰竭33例,慢性肝衰竭25例。肝衰竭的诊断依据2006年中华医学会感染病学分会肝衰竭与人工肝学组和中华医学会肝病学分会重型肝炎与人工肝学组制定的《肝衰竭诊疗指南》[2]。排除合并有原发性肝癌、消化道肿瘤等恶性肿瘤患者。另选20例健康体检者,男10例,女10例,年龄25~45岁,平均年龄31.4±7.1岁。
二、PBMCs的分离 采集空腹静脉血5ml,用淋巴细胞分离液分离PBMCs,收集细胞并储存于-80℃冰箱待检。
三、hTERT mRNA水平检测 提取细胞总RNA,实时荧光定量PCR分两步进行,第一步即cDNA的合成:以 Oligo( dT)为引物,取 5μl总 RNA为模板,按照PrimeScript逆转录试剂盒说明书合成cDNA;第二步即实时PCR反应,取4μl cDNA为模板,加hTERT和β-actin引物(表1),在荧光定量PCR仪上进行扩增。在荧光曲线上读出CT值,以 β-actin为内参照, 用 2-△△CT法计算 hTERT mRNA相对表达量。△CT=样品CT均值-内参照CT均值,△△CT=△CT-(随机阴性对照样品CT均值-该样品内参照CT均值)。

表1 引物序列及扩增长度
四、统计学处理 采用SPSS 13.0统计软件对数据进行分析,对计量资料先行1-K-S正态性检验。对符合正态分布的资料用表示,组内均数的比较采用重复测量因素的方差分析,两组间的比较采用独立样本的t检验。计数资料采用x2检验。数据相关性比较采用双变量相关分析(Bivariate)。绘制受试者工作特征(receiver operator characteristic,ROC)曲线,以评价相关因素对预后的诊断价值,以P<0.05为差异有统计学.意义。
结果
一、PBMCs hTERT水平的动态变化 本组肝衰竭患者生存39例,死亡21例。以健康人PBMC hTERT mRNA水平为基数,以2-△△CT法计算患者入院时以及治疗后28天内PBMC hTERT mRNA水平的变化。结果肝衰竭生存患者在入院时hTERT mRNA水平较健康人升高2.87倍,在治疗7天和14天升高4.27倍和9.23倍,治疗21天和28天后升高23.35倍和30.50倍,即呈持续上升趋势;死亡患者入院时hTERT mRNA水平较正常人升高3.01倍,在治疗7天和14天后升高2.08倍和1.21倍,且在治疗21天和28天后分别下降至正常人的0.28倍和0.06倍,即呈逐步下降趋势(图1)。

二、PBMC hTERT mRNA水平对预后判断的价值 见表2、3和图2。
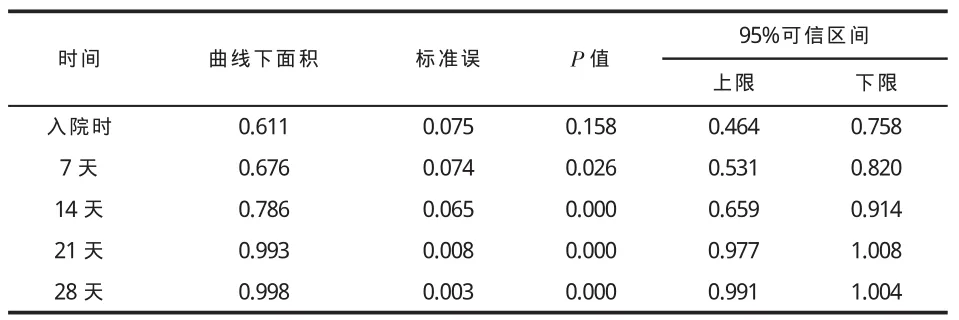
表2 PBMC hTERT mRNA水平对预后判断的ROC曲线下面积

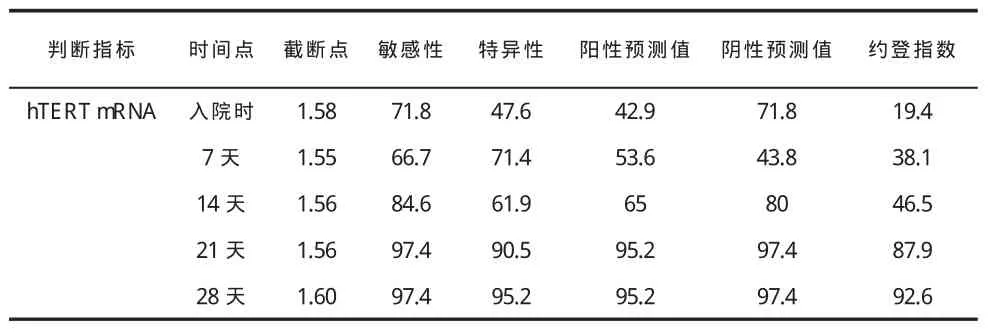
表3 PBMC hTERT mRNA水平对预后判断的价值(%)
讨论
端粒是真核线性染色体的末端结构,由端粒DNA和端粒结合,由一端高度保守的重复序列( TTAGGG)组成,方向为 5,~3,,长度约5~15kb。 端粒长度的维持需要端粒酶的激活。自身携带模板是端粒酶区别于一般纯蛋白逆转录酶的主要特征。被激活的端粒酶能以端粒3,端为引物,以其RNA组分为模板,合成端粒末端的重复序列,维持端粒长度,使细胞获得无限增殖的能力。人类端粒酶有2个亚单位组成:功能性RNA成分(human telomerase RNA,hTR)和hTERT。在这2个亚单位中,其催化亚单位对端粒酶的活性起着最为关键的作用。hTERT是一个单拷贝基因,定位于5P15.33,大约40kb[3]。有研究报道,人类hTERT基因与端粒酶活性具有密切的相关性。将hTERT基因转染到端粒酶阴性的正常细胞可使其端粒酶活化,不表达端粒酶活性的细胞也不表达hTERT基因[4]。在胚胎的早期发育阶段,体细胞具有端粒酶活性,但随着胎儿的发育,所有体细胞端粒酶活性是下调的,出生后正常体细胞绝大多数均不表达[5],而生殖细胞和肿瘤细胞通常表达较高水平的端粒酶活性,说明端粒酶的表达与细胞的分化和发育有密切的关系[6]。
在肝衰竭患者,当肝细胞开始再生时,肝细胞端粒酶的活性是否表现出类似于肿瘤细胞的特性,目前尚不清楚。Miura等[7]研究发现,急性肝衰竭患者血清hTERT mRNA水平显著低于急性肝炎,这与急性肝衰竭的高死亡率是一致的,反映了肝细胞再生不良。Tsuruga等[8]报道,在动物研究中,用hTERT转染的肝细胞脾内注射可以显著提高对乙酰氨基酚诱导的急性肝衰竭小鼠的存活率,表明转染的肝细胞可以作为肝细胞移植的细胞源。这些研究均提示,不论是肿瘤细胞还是肝细胞,在增殖和分化的过程中端粒酶的活性是增加的,在肝组织或外周血中检测hTERT mRNA可以反映肝细胞的增生状态。
Widmann等[9]研究发现,在小鼠肝再生过程中肝脏非实质细胞(Kupffer细胞和内皮细胞)大量增殖,且观察到增殖高峰分别出现在肝脏部分切除后的48h和96h。随后Naughton等[10~13]发现增殖的Kupffer细胞和内皮细胞能够产生大量的细胞因子,如CSF、IL-1、IL-6和TNF-α等,这些细胞因子具有潜在激活外周血粒细胞和淋巴细胞的能力。因此,在肝细胞再生过程中,PBMC大量增殖活化并高表达端粒酶活性。通过检测PBMC hTERT mRNA水平可以间接反映肝细胞再生的状况。由于肝衰竭患者病情重,直接检测肝细胞中hTERT mRNA在实际操作中难以进行,且由于血清中存在RNA酶,使血清hTERT mRNA的检出率较低。本课题间接检测肝衰竭患者PBMC中hTERT mRNA水平,以反映肝细胞的再生状况。
在肝衰竭时,肝细胞大量破坏,肝细胞坏死后能否有及时大量的肝细胞再生决定了肝衰竭的临床预后,残余肝细胞再生不充分是死亡的主要原因之一。本研究在对不同转归肝衰竭患者治疗前后外周血单个核细胞hTERT mRNA水平比较后发现,生存组患者治疗后hTERT mRNA水平高于治疗前水平,而死亡组患者治疗后hTERT mRNA水平呈现下降趋势,表明治疗后hTERT mRNA水平升高提示肝细胞再生良好,患者预后较好;反之,则患者预后不良。
1995年美国国家临床实验室标准化委员会正式批准了应用ROC曲线图评价实验室检验项目对临床预测准确性的指导原则。本研究利用ROC曲线下面积评价hTERT mRNA水平对评估肝衰竭预后的价值,结果显示,患者PBMC hTERT mRNA在预测肝衰竭预后方面有较好的诊断价值,这些还需要进一步观察证实。
[1]黄宇琨,范学工,邱氟.肝癌患者外周血单个核细胞端粒酶活性检测. 中国普通外科杂志,2004,13( 3) :185-188.
[2]Biggins SW,Kim WR,Terrauh NA,et al.Evidence-based incorporation of serum sodium concentration into MELD.Gastroenterology,2006,130( 6):1652-1660.
[3]Meyerson M,Counter CM,Eaton EN,et al.HEST2,the putative human telomerase catalytic subunit gene is upregulated in tumor cells and during immortalization.Cell,1997,90( 4):785.
[4]Kyo S,Kanaya T,Takakura M,et al.Expression of human telomerase subunits in ovarian malignant borderline and benign tumors.Int J Cancer,1999,80( 6):804.
[5]Harley CB.Telomerase therapeutics for degenerative diseases.Curr Mol Med,2005,5:205-211.
[6]Mizukoshi E,Nakamoto Y,Marukawa Y,et al.Cytotoxic T c ell responses to human telomerase reverse transcriptase in patients with hepatocellular carcinoma.Hepatology,2006,43:1284-1294.
[7]Miura N,Kabashima H,Shimizu M,et al.Clinical impact of serum transforming growth factor-alpha mRNA as a predictive biomarker for the prognosis of fulminant hepatitis.Hepatol Int,2008,2:213-221.
[8]Tsuruga Y,Kiyono T,Matsushita M,et al.Establishment of immortalized human hepatocytes by introduction of HPV16 E6/E7 and hTERT as cell sources for liver cell-based therapy.Cell Transplant,2008,17:1083-1094.
[9]Widmann JJ,Fahimi HD. Proliferation of mononuclear phagocytes( Kupffer cells) and endothelial cells in regenerating rat liver.A light and electron microscopic cytochemical study.Am J Pathol,1975,80:349-366.
[10]Naughton BA,Gamba-Vitalo C,Naughton GK,et al.Granulopoiesis and colony stimulating factor production in regenerating liver.Exp Hematol,1982,10:451-458.
[11]Dinarello CA.Interleukin-1.Rev Infect Dis,1984,6:51-59.
[12]Goss JA,Manjino MJ,Callery MP,et al.Prostaglandin E2 downregulates Kupffer cell production of IL1 and IL6 during hepatic regeneration.Am J Physiol,1993,264:G601-608.
[13]Decker T,Lohmann-Mathes ML,Gifford GE.Cell associated tumor necrosis factor TNB as a killing mechanism of activated cytotoxic macrophages.J Immunol,1987,138:957-962.