小羊肚菌人工栽培初报*
孟俊龙,杨 杰,常明昌**,冯翠萍,程红艳
(1.山西农业大学食品科学与工程学院,太谷 030801;2.山西省农业科学院食用菌研究所,太原030031;3.山西农业大学资源与环境学院,山西 太谷,030801)
羊肚菌 [Morchella esculenta(L.)Pers.]是一种著名食(药)用真菌,其子实体富含蛋白质、多糖、核酸、多种微量元素以及维生素,有增强免疫功能、抗疲劳、抗衰老、抗肿瘤、抗诱变、降血脂等多种功效,深受人们喜爱且在国际市场十分走俏[1-4]。然而由于野生羊肚菌的生长对气候、土壤等环境条件的要求高,所以,全国羊肚菌产量低,远不能满足人们的需要[5]。多年来,羊肚菌的人工驯化栽培一直是菌物界的研究热点之一,虽然国内外均有成功栽培羊肚菌的报道,但迄今为止尚形成成熟的商品化栽培[6],并且大田栽培出菇不稳定和室内栽培不出菇依然是羊肚菌人工栽培的瓶颈[7]。山西省野生羊肚菌资源丰富,我们分离了采自山西境内的一株羊肚菌,经专家鉴定为小羊肚菌(Morchella deliciosa Fr.),并对其进行组织分离和初步的栽培条件研究,以期为羊肚菌的人工栽培和开发利用提供参考。
1 材料与方法
1.1 供试菌株
由采自山西省左云县境内山区野生羊肚菌分离获得,该样品经鉴定为小羊肚菌 (Morchella deliciosa Fr.)。
1.2 培养基
1.2.1 子实体分离培养基
分离培养基 (g·L-1):马铃薯200、葡萄糖20、琼脂20、腐殖土 (来自野生羊肚菌周围)25、蛋白胨2。
1.2.2 母种培养基
M1(g·L-1):马 铃 薯 200、 葡 萄 糖 20、 琼 脂 20,KH2PO43、 MgSO40.1,蛋白胨1.8。
M2(g·L-1): 马 铃 薯 200、 葡 萄 糖 20、 琼 脂 20,KH2PO43、MgSO40.5、杨树根际土25、蛋白胨2。
M3(g·L-1): 木屑浸出液 (木屑 250g, 加入 1 000 mL中,浸泡12 h,过滤)300、葡萄糖20、琼脂25、KH2PO41、MgSO41、 蛋白胨 5。
1.2.3 原种培养基
Y1:棉籽壳85%、麸皮12%、石膏1%、磷肥1%、石灰1%,含水量65%。
Y2:棉籽壳80%、麸皮8%、杨树叶 (采自脱落的杨树叶子,60℃烘干至恒重,粉碎)6%、普通耕地土3%、石膏1%、磷肥1%、石灰1%,含水量65%。
Y3:大米98%,杨树根际土2%,含水量55%,并按常规处理原料[8]。
1.3 方法
1.3.1 子实体分离和培养
将采集下的羊肚菌子实体放入超净工作台,清除干净根部泥土,放入75%的酒精中,摇晃消毒30 s,然后用无菌水漂洗3次,再用无菌纱布或无菌吸水纸除去多余水分,用手术刀在菌柄与菌盖连接部位切成0.5 cm×0.5 cm的小块,接入装有分离培养基的试管中。在25℃恒温培养7d,并用显微镜观察菌丝形态特征。菌丝生长旺盛、有明显菌核形成的试管即为小羊肚菌分离试管种。
1.3.2 母种培养
将羊肚菌分离试管种分别转接于M1、M2、M3三种供试母种培养基中,在25℃恒温培养15 d,每12 h观察一次,记录菌丝长速、长势、菌核形成时间等情况。每个处理5个重复。
1.3.3 原种栽培
采用500 mL的栽培瓶,每瓶装干料300 g,在121℃灭菌2.5 h,然后将上面筛选出的最优羊肚菌母种接入不同配方处理下的原种培养基中,在23℃~25℃条件下进行暗培养。在出菇阶段给予相对湿度85%和强光照 (10 000 lx)刺激48 h[9],观察菌丝长速、长势、颜色变化,满瓶时间,菌核形成时间以及大小、数量。
2 结果与分析
2.1 分离培养基对羊肚菌分离效果的影响
羊肚菌在分离培养的第1 d开始萌发,气生菌丝旺盛,呈丝状,分布均匀,第7 d时菌丝可长满试管,且开始褐化,第9 d在试管壁上开始形成少量的黄色小菌核。与马铃薯培养基分离效果相比,萌发早,菌核形成时间短,效果好。
2.2 母种培养基对菌丝生长的影响
羊肚菌在3种供试培养基上均能生长,显微镜下观察到菌丝直径约为10 μm,菌丝横隔和内含物较多;菌丝生长初期,颜色浅白,气生菌丝旺盛,随培养时间的增加,菌丝生长变缓,菌丝颜色逐渐变黄,直至褐色;菌核先出现在试管壁上,随后蔓延到整个试管。

表1 不同母种培养基对菌丝生长和菌核的影响
由表1可知,M2在菌丝生长速度上略快于M1,显著快于M3,且菌核形成时间最短。菌核能否形成与菌核数量是关乎羊肚菌人工栽培是否成功的重要因子[10]。小羊肚菌在母种培养基M2上,能形成较多的,形状较大菌核,即M2是小羊肚菌人工栽培的最佳母种培养基。
2.3 原种培养基对菌丝生长和出菇的影响
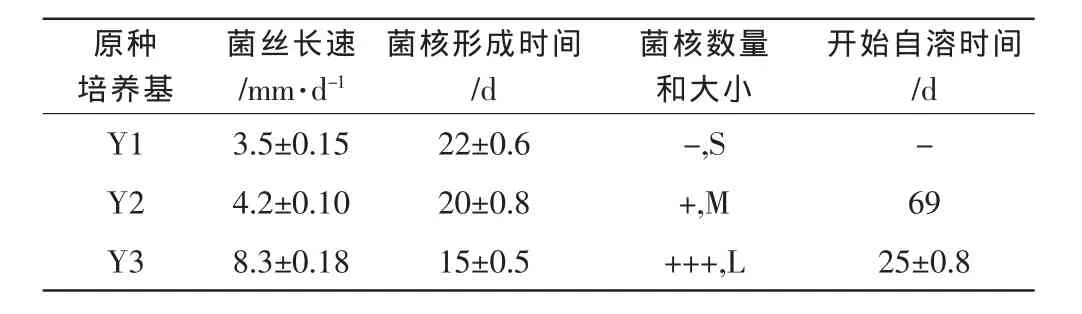
表2 原种培养基对菌丝和出菇的影响
如表2所示,小羊肚菌均能在供试原种培养基上完成菌丝生长,在Y3上菌丝生长最快,形成菌核时间最短,在Y2和Y1上菌丝生长速度显著慢于Y3,且菌核形成时间较长;Y1形成的菌核数量极少,没有出菇,Y2能形成很少且较小的菌核,也没有形成小羊肚菌子实体原基,Y3能形成多而大的菌核,并且形成了少量的菇蕾。我们在后来的验证实验中,用采收子实体进行组织分离,在Y3培养基上,给予上述出菇条件,再次出现结实,但出菇率和子实体生长依然较差。
3 结论与讨论
母种、原种培养基对菌丝生长速度、菌核形成时间、菌核数量和大小都有影响,M2、 Y3分别为最佳母种和原种培养基。说明小羊肚菌正常生长需要丰富的氮源和微量元素,但适宜的营养和合理的出菇处理是保证小羊肚菌栽培成功的前提条件。一般认为:覆土和散射光照射处理是羊肚菌栽培的必要条件[11-12],而本试验则在大米培养基上,给予相对湿度85%和强光照 (10 000 lx)刺激下,形成了子实体,虽然出菇率和子实体生长依然较差,但为小羊肚菌的人工栽培以及利用开发提供了途径。
[1]常明昌.食用菌栽培[M].北京:中国农业出版社,2009:16-17.
[2]常明昌.食用菌栽培学[M].北京:中国农业出版社,2003:26-27.
[3]杨新美.食用菌栽培学 [M].北京:中国农业出版社,1995:234-237.
[4]王波.羊肚菌人工栽培新技术 [M].上海:上海科学技术文献出版社,2005:16-25.
[5]陈建军,伍晓洪,刘振乾.羊肚菌生态位及其培养技术研究 [J].安徽农业科学,2009,37(2):638-639.
[6]朱林,程显好,田吉鹏.羊肚菌的研究进展 [J].安徽农业科学,2008,36 (10):4054-4057
[7]谢占玲,谢占青.羊肚菌研究综述[J].青海大学学报:自然科学版,2007,25(2):36-40.
[8]黄年来.中国食用菌百科[M].北京:中国农业出版社,1993:183.
[9]赵丹丹,李凌飞,赵永昌等.尖顶羊肚菌人工栽培[J].食用菌学报,2010,17 (1):32-35
[10]刘兴蓉,陈芳草,谭方河,等.羊肚菌产核条件研究[J].四川林业科技,2004,25(3):44-46.
[11]赵琪,徐中志,程远辉,等.尖顶羊肚菌仿生栽培技术[J].西南农业学报,2009,22 (6):1690-1693.
[12]张飞翔.羊肚菌人工栽培技术[J].农村实用科技,2006(8):17.

