没食子酸对金黄色葡萄球菌抑菌活性及机制研究
卢 晓,周 磊,谢鲲鹏,景宜人,云宝仪,汪业菊,谢明杰
(辽宁师范大学生命科学学院,辽宁省生物技术与分子药物研发重点实验室,大连 116081)
没食子酸又名五倍子酸、桔酸,化学名3,4,5一三羟基苯甲酸,为白色或淡黄色针状结晶或粉末,通常是以一水合物的形式存在,广泛存在于黄栌叶、漆树叶、茶条槭叶等植物的叶片中,是一种重要的有机原料,广泛用于化工、医药、食品、染料、轻工及电子等行业[1-3]。已有的研究表明,没食子酸具有一定的抗肿瘤,抗乙肝病毒的功效和较强的抗氧化、抗自由基作用[4-6]。此外,没食子酸也对厌氧菌微生物、金黄色葡萄球菌、表皮葡萄球菌、干燥棒状杆菌和藤黄微球菌、绿脓杆菌有抑制作用[7-8]。目前关于没食子酸的抑菌作用机制尚不清楚。因此本文以金黄色葡萄球菌为供试菌,通过对其细胞膜的通透性、蛋白质含量变化等方面来研究没食子酸的抑菌机制,旨在为开发高效低毒的抗菌药物和新型天然防腐剂提供理论依据。
1 材料与方法
1.1 材料
供试菌种为金黄色葡萄球菌 (Staphylococcus aureus ATCC26112),购于中国医学菌种保藏中心。牛肉膏蛋白胨培养基 (Nutrient broth medium,简称NB)。没食子酸标准品购于大连检验检疫局;
主要仪器设备为YY0027-90型电热恒温培养;DDS-307A(DDB-600)型电导率仪;电泳凝胶定量分析系统(TRANSILLUMZNATOR 2020D);SP-DJ系列垂直净化工作台;HZQ-F160全温度振荡培养箱;DGG-9123A型电热恒温鼓风干燥箱;UV-7504紫外可见分光光度计。
1.2 最低抑菌浓度的测验 [9]
本试验采用杯碟法。首先在培养皿内注入20 mL 2%的固体培养基作为底层,凝固后再在平板中倒入5 mL加有0.1 mL供试菌的1%的半固体培养基。待凝后在其上等距离分散地轻轻放上无菌牛津杯内径 (6±0.1)mm,外径(8±0.1) mm,高 (10±0.1) mm,在杯内分别注入 0.2 mL浓度为8 mg·mL-1的没食子酸,以无水乙醇作为对照,实验重复3次,取平均值。37℃下培养24 h后用卡尺测定抑菌圈直径,取其平均值。
1.3 没食子酸最低抑菌浓度 (MIC)的测定 [10]
将金黄色葡萄球菌培养至对数期 (浓度为106 cfu·mL-1~107 cfu·mL-1)后,向96孔板中加入100 μL菌悬液、10 μL不同浓度的没食子酸,然后放入37℃,100 r·min-1摇床中培养,待培养24 h后,每孔分别加入20 μL0.2%2,3,5-氯化三苯基四氮唑 (TTC),37℃,100 r·min-1避光培养4h后,观察其颜色变化,以无水乙醇为对照组。
1.4 金黄色葡萄球菌生长曲线的绘制 [11]
将金黄色葡萄球菌培养至对数生长期,按2%接种量加入到含0.2 mg·mL-1没食子酸的牛肉膏蛋白胨液体培养基中,放入37℃,120 r·min-1摇床培养,在0 h~52 h中每4 h取样一次,用可见光分光光度计在波长为580 nm下测定其OD值,加入等量无水乙醇为对照组,实验重复3次,取平均值。绘制没食子酸作用后金黄色葡萄球菌的生长曲线。
1.5 培养液电导率的测定 [12]
将培养至对数期的金黄色葡萄球菌,加入没食子酸(终浓度为0.05 mg·mL-1)后继续培养。分别取培养至1 h、 2 h、 3 h、4 h、 5 h、 6 h、7 h和 8 h的培养液 1 mL,4000 r·min-1离心 10 min,将上清液稀释 20倍后,用DDS-307A(DDB-600)型电导仪测定其电导率。以无水乙醇为对照,实验重复3次,取平均值。
1.6 培养液中DNA、RNA等大分子物质的测定
收集培养至对数期的金黄色葡萄球菌,用PBS缓冲液洗涤2次后制成一定浓度的菌悬液,然后加入没食子酸使其终浓度为 0.05 mg·mL-1。 待药物作用 0、2 h、4 h、6 h和8 h时取样液 4 mL,4 000 r·min-1离心10 min,用紫外分光光度计于260 nm下测定上清液中DNA、RNA等大分子物质的吸光值。以不加药组为对照,实验重复3次,取平均值。
1.7 金黄色葡萄球菌可溶性蛋白含量的测定
向培养至对数期的金黄色葡萄球菌的菌液中加入没食子酸,使培养液中没食子酸的终浓度为0.05 mg·mL-1,分别在16 h和20 h时取菌悬液,5 000 r·min-1离心10 min,收集菌体50 mg,用20 μL的无菌水将菌体混匀,按1∶4的体积比加入缓冲溶液,混匀,然后在沸水浴中煮沸5 min,5 000 r·min-1离心,取上清液进行SDS-PAGE电泳,以不加药组为对照组。
2 结果和分析
2.1 没食子酸对金黄色葡萄球菌的抑菌活性和最低抑菌浓度 (MIC)的测定结果
牛津杯法测定的实验结果显示,没食子酸对金黄色葡萄球菌有较高的抑制作用,其抑菌圈直径为13 mm。没食子酸对金黄色葡萄球菌最低抑菌浓度测定结果见表1。TTC是一种实验室常用的活菌染料,该染料进入细胞后,活细胞中的琥珀酸脱氢酶能把TTC还原成红色的甲瓒(Formazan),使培养液呈现红色,而死细胞则为无色。由表可知,经TTC染色后,培养基的颜色随没食子酸浓度的增加而变浅,即由红色变至无色。说明没食子酸能够抑制金黄色葡萄球菌的生长,且其抑制作用随药物浓度的增加呈正相关。当没食子酸的浓度大于0.01 mg·mL-1时,可完全抑制金黄色葡萄球菌的生长,没食子酸对金黄色葡萄球菌的 MIC 为 0.01 mg·mL-1。
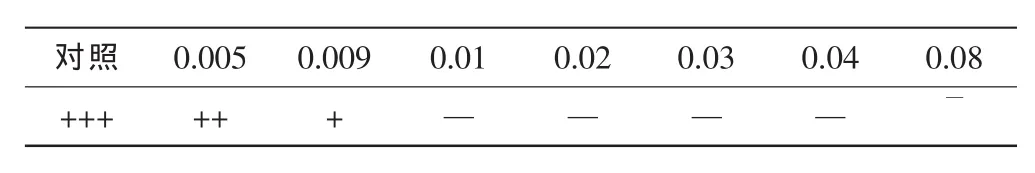
Table 1 The mensuration result of MIC of Gallic acid against Staphylococcus aureus
2.2 没食子酸对金黄色葡萄球菌生长曲线的影响
没食子酸对金黄色葡萄球菌生长曲线的影响结果见Fig.1。由图可知,没食子酸组中的金黄色葡萄球菌在对数生长期明显被抑制,4 h的抑制率最高为70.57%。48h时细菌浓度最高,但OD值为2.745,比对照组小4%,随即二者均进入衰亡期,从图中可以看出,在24 h之前,没食子酸严重的抑制了金黄色葡萄球菌的生长,在进入衰亡期后,如在从50 h~52 h的时间段里,受到没食子酸的影响,实验组比对照组的衰亡速度快了83.3%。
2.3 没食子酸作用金黄色葡萄球菌后培养液电导率的变化
没食子酸作用金黄色葡萄球菌后培养液电导率的变化的测定结果显示 (Fig.2),结果说明没食子酸对金黄色葡萄球菌细胞膜的通透性有影响。细胞膜通透性的改变会引起细胞内钾离子、钠离子等小分子物质的外漏,从而导致胞外电导率的变化。电导率的改变可以反映细胞膜渗透性的改变。本研究的测定结果显示如图,没食子酸作用金黄色葡萄球菌菌体初期,培养液的电导率随着时间的延长而增大。当药物作用5h时,没食子酸组的电导率与对照组相比增加了6.38% (P<0.05)。结果说明没食子酸对金黄色葡萄球菌细胞膜的通透性有影响。
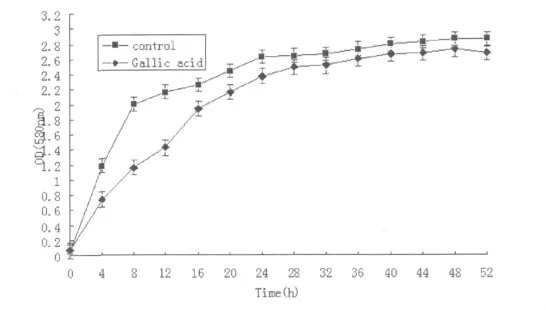
Fig.1 Effect of Gallic acid on the growth curve of Staphylococcus aureus
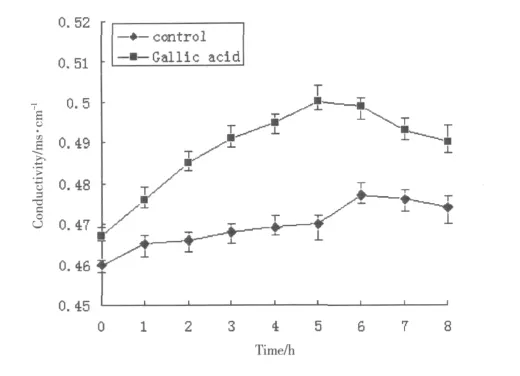
Fig.2 The change about conductivity from Staphylococcus aureus effected by Gallic acid
2.4 没食子酸作用金黄色葡萄球菌后培养液中大分子物质吸光值的变化
没食子酸作用金黄色葡萄球菌后培养液中大分子物质吸光值的变化结果见Fig.3。本实验对加药后大分子物质的外漏量进行了测定。因为DNA、RNA等这些大分子物质在260nm处有较强的吸收值,所以通过测定OD260nm的变化可推测药物对细胞膜完整性的影响。没食子酸作用菌体初期,大分子的吸光值随着作用时间的增加而逐渐增大,当培养至8h时,实验组大分子物质吸光值的变化率达到最大,比对照组增加74.4% (P<0.05)。通过测定OD260nm的变化可推测药物对细胞膜完整性的影响。表明菌体细胞内DNA和RNA等大分子物质发生渗漏,菌体的细胞膜受到破坏。
2.5 没食子酸对金黄色葡萄球菌可溶性蛋白的影响
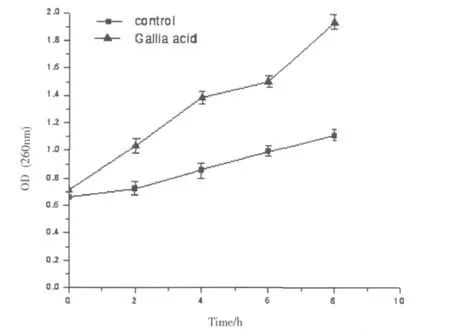
Fig.3 The change about OD of large molecules from Staphylococ cus aureus effected by Gallic acid
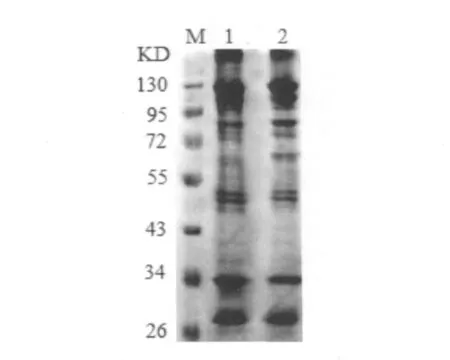
Fig.4 The soluble protein of Staphylococcus aureus by Gallic acid M:marker; 1:control group; 2:Gallic acid 20h group
没食子酸对金黄色葡萄球菌可溶性蛋白的影响见图4。利用Gel-Pro Analyzer蛋白分析软件对没食子酸作用金黄色葡萄球菌的SDS-PAGE蛋白谱带定量分析结果表明,没食子酸可明显的抑制金黄色葡萄球菌胞可溶性蛋白的表达,与对照组相比,没食子酸作用20h后的金黄色葡萄球菌总蛋白量没有明显变化 (Fig.4),其原因可能是没食子酸并没有影响了金黄色葡萄球菌核酸的合成和相关基因的表达。
3 讨论
本次实验利用牛津杯法对没食子酸的抑菌活性进行了测定,结果显示没食子酸在不同浓度下对金黄色葡萄球菌有明显的抑菌效果;通过利用2,3,5-氯化三苯基四氮唑(TTC)染色的方法测定没食子酸的最低抑菌浓度为8mg·mL-1,并且在一定浓度范围内,没食子酸的抑菌作用随着浓度的升高而增强。
已有的研究结果表明,药物的抑菌机制主要是通过破坏细胞壁及细胞膜的完整性、抑制蛋白、核酸的合成等途径来实现的。本实验结果显示,没食子酸在作用菌体初期使金黄色葡萄球菌培养液的电导率增加,且胞内DNA、RNA等大分子物质有明显外漏,说明没食子酸能引起金黄色葡萄球菌细胞膜渗透性的改变,且破坏细胞膜的完整性。究其原因,可能是没食子酸取物诱导菌体产生了某些降解细胞壁和细胞膜的酶所致,或者是药物与菌体细胞膜接合,改变了细胞膜的通透性,使胞质外渗。
利用Gel-Pro Analyzer蛋白分析软件对没食子酸作用金黄色葡萄球菌SDS-PAGE蛋白谱带定量分析结果表明,没食子酸可明显的抑制金黄色葡萄球菌胞可溶性蛋白的表达,与对照组相比,没食子酸作用20h后的金黄色葡萄球菌总蛋白量没有明显变化,其原因可能是没食子酸并没有影响了金黄色葡萄球菌核酸的合成和相关基因的表达,具体原因还有待进一步的探究。
综上所述,没食子酸对金黄色葡萄球菌有较强的抑菌活性,其抑菌机制是通过破坏细菌细胞膜的完整性以及抑制菌体蛋白质的合成来实现的。但其具体的抑菌机制尚有待于进一步研究。希望本文的研究内容为进一步研究没食子酸的抑菌机制和开发高效低毒的抗菌药物提供基础理论依据。
[1]常连举,张宗和垆,黄嘉玲,徐浩,仲崇茂.没食子酸的制备与应用综述.生物质化学工程, 2010, (7): 49-52.
[2]陈笳鸿.我国没食子酸单宁化学利用现状与展望 [J].林产化学与工业,2000,20(2):7l -82.
[3]王之德.重要精细化学品--没食子酸 [J].天然气化工,1995,20(1):38-42.
[4]KawadaM,OhnoY,Ri,etal.Anti-tumor effect of gallic acid on LL-2 lung cancer cells transplant mice.Anticancer-Drugs,2001,12(10):847.852
[5]郑民实,孔庚星,张鑫,等.没食子酸抗HbsAg的实验研究 [J].实用中医药志,1998,14(1):5-7
[6]SakagamiH,Salob K.Prcoxidant action of two antioxidants:ascorbic acid and gallic acid,Antlcancer Res,1997,17(1A):221-224
[7]王俊君,俞从正,马兴元,赵卫锋.没食子酸和焦性没食子酸对厌氧微生物的毒性研究.中国皮革,2009(2):23-25
[8]梁耀光,徐巧林,谢海辉,周艳阳,魏孝义.芒果核仁的化学成分及其抑菌活性.热带亚热带植物学,2010,18(4):445-448
[9]陈洪生,孔保华,刁静静.大蒜素提取条件的优化及其抑菌活力的研究.食品工技.2007,4:87-89.
[10]荆迎军.郝友进,渠晖,等.壳聚糖的抑菌活性分析及其抑菌机理的研究.中国抗生素杂志,2006,31(6):361-365.
[11]Lee HJ, Choi GJ, Cho KY.Correlation of lipid peroxidation in Botrytis cinerea caused by dicarboximide fungicides with their fungicidal activity.Journal of Agricultural Food Chemistry, 1998,46:737-741.
[12]Chen C Z,Cooper S L.Interactions between dendrimer biocides and bacterial membranes[J].Biomaterials,2002,23:3359-3368 郭勇.现代生化技术[M].广州:华南理工大学出版社,2001,153-155

