角质细胞生长因子促进大鼠胰腺导管上皮细胞体外增殖
吴 刚,张晓健,白 光
(辽宁医学院附属第一医院肝胆外科,辽宁锦州121000)
胰腺导管上皮细胞(pancreatic ductal epithelial cells,PDECs)可在适宜的条件下增殖分化为胰岛素分泌细胞,是胰岛移植治疗糖尿病(diabetes mellitus,DM)的理想种子细胞。但是,目前还没有一套良好的PDECs培养增殖的实验方案,实现PDECs体外大量增殖成为亟待解决的问题。角质细胞生长因子(keratinocyte growth factor,KGF)是一种能特异性促进上皮细胞增殖的生长因子[1-5],对多种器官具有保护作用,并且在损伤修复过程中大量表达,可通过促进有丝分裂、激活信号通路及调节酶活性等方面促进上皮细胞增殖和迁移作用。本实验以大鼠胰腺组织为材料,建立一种良好有效的PDECs培养增殖方法,并探讨不同浓度的KGF在体外对大鼠PDECs增殖的影响,寻找解决胰岛供体短缺的有效途径。
1 材料与方法
1.1 实验动物
清洁级SD大鼠20只,6~7周龄,雌雄不限,体质量250~300 g,辽宁医学院动物实验中心提供[SYXK(辽)2009-0004]。
1.2 主要试剂
KGF、DTZ、V型胶原酶和 CK19单克隆抗体(Sigma公司);Hank's液、0.25%胰蛋白酶、RPMI-1640培养基、DMEM/F12培养基(1∶1)和FBS(Gibco公司);DMSO、DAB酶底物显色试剂盒(北京鼎国昌盛生物技术有限公司)。
1.3 原代PDECs的分离、纯化和培养
所有大鼠术前禁食12 h,禁水4 h。采用逆行胆管灌注胶原酶法获得细胞。采用不连续密度梯度离心法、差速贴壁法纯化细胞。将部分细胞悬液移入非黏附培养瓶中培养,加入无血清的高糖DMEM/F12培养基(50 μg/L霍乱毒素、100 U/mL青霉素、100 U/mL链霉素、1 g/L ITS);另将部分细胞培养于放置有盖玻片的培养皿中,行细胞鉴定。
1.4 免疫细胞化学染色法鉴定细胞表面标志物
收集6孔板中的盖玻片(盖玻片上接种有第4代细胞,正处于对数生长期),PBS(pH=7.4)冲洗,4%多聚甲醛固定,经标准的渗透化处理(0.1%tritonx-100)室温10 min,50 μL正常动物非免疫血清封闭,一抗为50 μL的小鼠抗大鼠CK19单克隆抗体(1∶100),4℃过夜。二抗为50 μL羊抗小鼠抗体(1∶50),37℃孵育30 min。苏木素复染,脱水,中性树胶封固。
1.5 RT-PCR检测细胞表面标志
提取细胞总RNA,1%琼脂糖凝胶电泳检测,RT-PCR检测Nestin、CK19、Insulin和Glucagon的表达。引物设计序列(表1)。
1.6 PDECs向胰岛素分泌细胞的分化
将第2~3代细胞转入含有低糖培养基的细胞培养瓶中,培养4~6 d。取诱导分化物3 mL,加入

表1 引物设计序列Table 1 Sequence of primer
配制好的终浓度为140 mg/L的DTZ溶液5 μL,轻轻振荡混匀,室温下静止6~10 min,倒置显微镜下观察。分别消化诱导分化前后的细胞,1×105个/mL浓度接种于24孔板。待细胞贴壁生长后,吸净培养液,加入1 mL含2.8 mmol/L糖的D-Hank's液置于培养箱中培养2 h,收集上清液冻存待测基础胰岛素水平;而后加入含16.7 mmol/L糖的D-Hank's液培养1 h,收集上清液采用放射免疫法(RIA法)测定分化前后两种细胞不同糖浓度刺激下胰岛素释放含量。
1.7 不同浓度的KGF对PDECs增殖的影响
消化80% ~90%汇合生长的PDECs,制成细胞悬液,调整细胞浓度为4×105个/L,以100 μL/孔接种于96孔培养板,共3个板,5%CO237℃下培养。分为5组,1~4组加入KGF,使其终浓度分别为5、10、15和20 μg/L;第5组加入等量的 DMEM/F12 作为阴性对照组。每组4个复孔,另设一空白对照组(仅加培养液,不加细胞),比色时用于调零。绘制KGF促进胰腺导管上皮细胞生长增殖曲线。
1.8 统计学分析
全部数据均用SPSS 17.0软件进行统计学处理。数据采用均数±标准差(±s)表示,实验组与对照组之间比较采用t检验,组间采用方差分析进行两两比较。
2 结果
2.1 原代PDECs的分离、纯化和培养

图1 分离培养的胰腺导管上皮细胞Fig 1 PDECs morphology(×100)
胶原酶灌注胰腺后充盈良好,胰腺各部分膨胀均匀。倒置显微镜下观察可见原代细胞中大量圆形细胞悬浮,细胞形态不一,呈梭形、三角形、楔形等(图1A)。48 h后胰腺导管上皮细胞开始贴壁,呈多型性,并逐渐分裂生长为单层细胞,细胞逐渐融合为“鹅卵石样”结构排列,细胞形态趋向一致(图1B)。通过差速贴壁法及改用无血清培养基培养4 d内,细胞增长缓慢,从第5天开始增殖加速,进入对数生长期,细胞逐渐呈多角形,形态单一,并逐渐汇合成片。培养第10天开始呈上皮细胞样生长,11~13 d左右细胞达80%贴壁(图1C)。
2.2 免疫细胞化学染色检测细胞表面标志物
盖玻片上的单层上皮细胞胞质染色呈棕色,CK19染色阳性率达到(92.4±2.8)%(图2)。
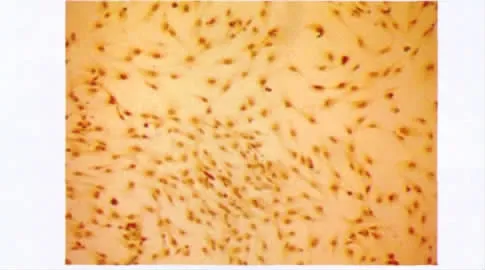
图2 免疫细胞化学染色显示胰腺导管上皮细胞表达CK19Fig 2 Expression of CK19 of PDECs by immunocytochemical stain(×100)
2.3 RT-PCR检测细胞表面标志物
PDECs的 Nestin和 CK19表达阳性,而 Insulin及Glucagon表达阴性(图3)。
2.4 PDECs向胰岛素分泌细胞的分化
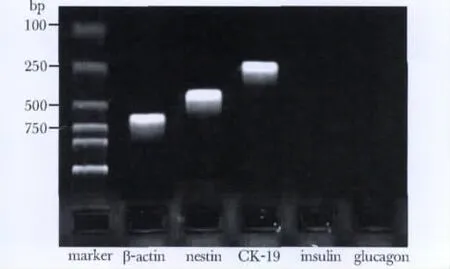
图3 RT-PCR检测细胞表面标志物的表达Fig 3 Expression of cell surface marker by RT-PCR
PDECs经低糖培养基诱导分化后,上皮样细胞周围出现大量圆形细胞,并逐渐聚集成细胞团,悬浮于培养液中。在倒置显微镜下观察细胞团呈现圆形或椭圆形,称为类胰岛样结构,经DTZ染色后细胞团呈红色或猩红色(图4)。

图4 胰腺导管上皮细胞经低糖培养基诱导分化为类胰岛样结构Fig 4 PDECs were induced to differentiate into islet-like cells(×100)
10、20和30mmol/L糖浓度下,分化后细胞胰岛素释放量显著高于分化前(P<0.01)(表2)。

表2 分化前后细胞对不同浓度糖溶液的胰岛素反应能力Table 2 Reaction of PDECs to insulin of different glucose concentrations before and after differention(x ± s,n=8)
2.5 不同浓度的KGF对PDECs增殖的影响
培养基中加入KGF后,MTT法测定不同浓度KGF对PDECs增殖的影响(表3)。
培养2 d时,20 μg/L组细胞数显著高于对照组;6~10 d时,10、15 和20 μg/L组细胞数显著高于对照组(P<0.01);第12天,20 μg/L组细胞数显著高于对照组(P<0.05)。倒置显微镜下观察20 μg/L组PDECs均存活,形态正常,细胞密度大,增殖活跃。
3 讨论
目前尚无特异的 PDECs标志物。CK19是PDECs生长发育过程中的重要因子,被认为是PDECs向干细胞转化的标志之一[6-8]。本实验通过免疫细胞化学染色法对第2代导管上皮细胞进行了鉴定,结果发现CK19染色阳性率在90%左右,说明分离的细胞可以表达胰腺干细胞的表面标志,而且RT-PCR结果也显示CK19 mRNA表达阳性。Nestin是否是PDECs的表面标志物还需进一步的研究。本实验仅在基因水平检测到第2代细胞有Nestin表达。
胰腺细胞包括内分泌、外分泌及导管上皮细胞;其中腺泡细胞占82%,胰岛细胞仅占1%。为了排除胰岛细胞的污染,本研究应用RT-PCR检测Insulin和Glucagon的表达,结果显示分离出的细胞为较纯的PDECs,可以作为后续实验的细胞来源。
为了检测分化出的细胞能否分泌胰岛素,本研究设计了不同糖浓度的培养基,用放免法测定分化前后胰岛素分泌水平。结果发现,分化前的PDECs基本无分泌胰岛素的能力,分化后的类胰岛样细胞团对不同糖浓度均有反应能力。从表3可以看出,0~20 μg/L的范围内,在同一时间下,随着KGF浓度的增大,A值逐渐增加,且各组间有差异,说明KGF的增殖作用在本实验所选择的剂量范围内呈浓度依赖性,各浓度组刺激2 d后细胞的增殖最为旺盛。
KGF是一个特异性的促上皮细胞增殖的高效生长因子,对多种器官具有保护作用,在损伤修复过程中大量表达,可通过促进有丝分裂、激活信号通路及调节酶活性等方面促进上皮细胞增殖和迁移作用[9-10]。利用不同浓度的KGF刺激大鼠胰腺导管上皮细胞的增殖,结果显示:培养0~2 d细胞处于潜伏增殖期,细胞增殖活性在各组变化较小;第6天细胞增殖加速,进入对数生长期,6~10 d细胞计数达高峰,KGF各浓度组细胞数显著高于对照组。第12天细胞增殖到达平台期,细胞生长逐渐趋向停滞,但20 μg/L组细胞数仍显著高于对照组,而其他各组细胞数与对照组比较无差异。所以在本实验的剂量范围内,20 μg/L为促进增殖的最佳浓度,该结果或许可为相似研究工作提供参考。

表3 MTT法测定不同浓度KGF对PDECs增殖的影响Table 3 Effects of KGF on cell proliferation shown by MTT(x ± s,n=5)
[1]Movassat J,Portha B.Early administration of keratinocyte growth factor improves{beta}-cell regeneration in rat with streptozotocin-induced diabetes [J].J Endocrinol,2007,195:333-340.
[2]Kim A,Lakshman N,Karamichos D,et al.Growth factor regulation of corneal keratocyte differentiation and migration in compressed collagen matrices[J].Invest Ophthalmol Vis Sci,2010,51:864 -875.
[3]Etheredge L,Kane BP,Hassell JR.The effect of growth factor signaling on keratocytes in vitro and its relationship to the phases of stromal wound repair[J].Invest Ophthalmol Vis Sci,2009,50:3128 -3136.
[4]Wagner M,Koschnick S,Beilke S,et al.Selective expansion of the beta-cell compartment in the pancreas of keratinocyte growth factor transgenic mice[J].Am J Physiol Gastrointest Liver Physiol,2008,294:1139 -1147.
[5] Uzan B,Figeac F,Portha B,et al.Mechanisms of KGF mediated signaling in pancreatic duct cell proliferation and differentiation[J].PLoS One,2009,4:4734.
[6]陈珂玲,周翔宇,李园,等.大鼠胰腺导管上皮细胞中白介素-1受体相关激酶-M的表达及意义[J].中国微循环,2009,13:272-276.
[7]赵艳艳,庞长河,李志臻,等.胰腺导管上皮细胞来源的胰岛样细胞移植治疗Ⅰ型糖尿病[J].中华实验外科杂志,2011,28:86-88.
[8]宋莹,赵岳,刘伯纯,等.Slc26a6敲除对小鼠胰腺导管上皮细胞Slc26a3和CFTR表达水平的影响[J].中国实验诊断学,2011,15:26-29.
[9]赵艳艳,余勤,李志臻,等.胰腺导管上皮细胞转分化为胰岛样细胞[J].中国组织工程研究与临床康复,2010,14:6064-6067.
[10]纪明明,王康,刘晓雪,等.靶向间皮角质细胞生长因子预防大鼠术后腹膜黏连的实验研究[J].中华普通外科杂志,2011,26:580-583.

