重组质粒pMG36e-nisI-gfp在乳酸菌中的应用
代伟丽,王艳萍,王菁蕊,白小佳
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
重组质粒pMG36e-nisI-gfp在乳酸菌中的应用
代伟丽,王艳萍,王菁蕊,白小佳
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
本研究将带有nisI和gfp(绿色荧光蛋白)基因的乳酸菌表达载体pMG36e-nisI-gfp转化至乳酸菌中,观察其在宿主内的稳定性.对重组菌进行了菌体形态、传代培养、质粒验证等研究,考察了该质粒的稳定性.结果显示:重组菌在不含抗生素的培养基中连续传代20代后,质粒丢失率低;菌体大小和形态基本不变;质粒经HindⅢ酶切后大小不变;GFP在第0、5、10、15和20代宿主菌中都可以表达,表达量没有明显差别,在SDS-PAGE中的带型一致;初步的动物实验验证了该质粒作为遗传标记的应用效果.说明该质粒在宿主菌中具有良好的稳定性.
绿色荧光蛋白;乳酸菌;质粒稳定性
乳酸菌(lactic acid bacteria,LAB)是一类能利用碳水化合物产生乳酸的革兰氏阳性杆菌或球菌,厌氧或兼性厌氧,是不能还原硝酸盐的一类细菌的总称[1].乳酸菌长期应用于食品发酵、生物医药工业,是被公认为安全的食品级微生物(generally regarded as safe,GRAS).乳酸菌与人类生活密切相关,常见于肉类、奶油及蔬菜发酵制品中,能通过胃并定植于肠道发挥益生作用,如免疫调节[2]、对致病菌的拮抗作用[3]、降低血清胆固醇含量及预防心血管疾病[4].但对其在体内的定植规律及在肠道微生物菌群中的作用研究较少.
本实验室前期从西藏Kefir粒中分离出来多株具有优良性状的乳酸菌[5-7],并经过形态学观察、生理生化及16S rDNA分子生物学鉴定.本文将实验室前期构建的一种乳酸菌表达载体pMG36e-nisI-gfp[8],以nisI基因为筛选标记,绿色荧光蛋白gfp基因为报告基因,对该质粒电转化至不同乳酸菌中进行初步研究,以确定该质粒的宿主范围、稳定性及作为遗传标记的应用效果,为研究乳酸菌在体内的定植规律奠定一定的基础.
1 材料与方法
1.1 菌株与培养基
菌株:植物乳杆菌MA2(Lactobacillus plantarumMA2)、乳酸乳球菌WH-C1(Lactococcus lactisWHC1)和嗜热链球菌34(Streptococcus thermophilus34)由本实验室分离及保藏;乳酸菌表达载体pMG36enisI-gfp由本实验室构建[8]并保存.
MRS培养基:蛋白胨10.0,g,牛肉膏10.0,g,酵母膏5.0,g,葡萄糖20.0,g,磷酸氢二钾 2.0,g,醋酸钠5.0,g,硫酸镁0.2,g,硫酸锰0.05,g,柠檬酸铵2.0,g,吐温80 1.0,g,加蒸馏水定容至1,000,mL,琼脂粉20,g,pH 6.2~6.4,121,℃灭菌20,min.
红霉素在MRS-Ery+-nisin+培养基中工作浓度为2.5,μg/mL,Nisin的工作浓度为20,IU/mL.
1.2 试剂与仪器
红霉素,Bio Basic公司;Nisin,Sigma公司;限制性内切酶HindⅢ,Fermentas公司.
SCIENTZ-ⅡD型细胞破碎仪,宁波新芝生物科技股份有限公司.
1.3 质粒pMG36e-nisI-gfp的宿主范围
将乳酸菌表达载体pMG36e-nisI-gfp分别转化至乳酸乳球菌WH-C1、植物乳杆菌MA2及嗜热链球菌34中,初步研究重组质粒pMG36e-nisI-gfp的宿主范围.
1.4 菌株传代方法
取对数期至稳定期的重组菌,37,℃培养12,h,以2%的接种量接入新鲜不含抗生素的液体MRS培养基中,每传1次记为1代.传代20代后,梯度稀释,分别涂布于含有和不含抗生素的MRS平板上,菌落计数,研究质粒pMG36e-nisI-gfp在重组菌中的稳定性.质粒稳定性以MRS-Ery+-nisin+固体培养基上的菌落数占MRS-Ery--nisin-固体培养基的菌落数的比率来评定.
1.5 质粒PCR鉴定
传代过程中,取第0、5、10、15、20代菌液,碱裂解法提取质粒.进行nisI基因(NisI-up:5′-AGATCT AGACAGGAGGGAAGAGGAAATGAG-3′和NisI-down:5′-CGTCTGCAGTTAGGATCCCTATTTCCTA C-3′)和gfp基因(GFP-up:5′-GCGAGCTCTGAGTA AAGGAGAAGAACT-3′和GFP-down:5′-GCTCT AGACGCGGTACCTTTGTATAG-3′)的PCR扩增,电泳鉴定PCR片段.
1.6 质粒酶切鉴定
传代过程中,取第0、5、10、15、20代菌液,碱裂解法提取质粒.取4,μL用限制性内切酶HindⅢ进行酶切,37,℃反应2,h,电泳鉴定酶切片段.
1.7 GFP在宿主菌中的表达
传代过程中,取第0、5、10、15、20代菌液,扩大培养,37,℃培养36,h,取20,mL于10,℃、5 000,r/min离心1,min,弃上清液;用7,mL磷酸盐缓冲液(pH 6.4)配成菌悬液[9],10,℃、5 000,r/min离心5,min;菌体用7,mL磷酸盐缓冲液重悬;在细胞破碎仪中超声波破碎,工作时间为7,min,工作/间歇为2,s/2,s,甲醇法抽提蛋白,SDS-PAGE电泳观察GFP的表达情况.
1.8 质粒pMG36e-nisI-gfp作为遗传标记的应用效果
活化重组菌,使菌液浓度达到大约109,mL–1;小鼠灌胃之前,过夜禁食、禁水,每只小鼠灌胃1,mL重组菌,空白对照组灌胃生理盐水;一定时间后,进行宰杀、解剖,取胃、空肠、回肠和盲肠组织,制作切片,在荧光显微镜下进行观察.
2 结 果
2.1 质粒pMG36e-nisI-gfp的宿主范围
质粒pMG36e-nisI-gfp在乳酸乳球菌WH-C1、植物乳杆菌MA2及嗜热链球菌34中都能转化成功,说明该乳酸菌表达载体pMG36e-nisI-gfp具有一定的宿主适用范围.
MRS-Ery+-nisin+固体培养基生长36,h的重组菌菌落为直径1~2,mm的圆形隆起,表面湿润光滑,白色,边缘整齐,为典型的乳酸菌菌落形态.第0、5、10、15、20代重组菌株的菌体及菌落形态变化不大,且与野生菌株相比没有明显差别.
2.2 质粒pMG36e-nisI-gfp的质粒稳定性
连续传代20代后,乳酸乳球菌WH-C1、植物乳杆菌MA2及嗜热链球菌34在MRS-Ery+-nisin+和MRS-Ery--nisin-固体培养基中菌落数的数量级相同;表1中,重组植物乳杆菌MA2的质粒丢失率仅为2.46%,说明乳酸菌表达载体pMG36e-nisI-gfp的质粒稳定性良好.
2.3 质粒pMG36e-nisI-gfp的PCR鉴定
碱裂解法提取第0、5、10、15、20代重组菌的质粒,分别扩增nisI和gfp基因.
几株重组菌的质粒验证图大致相同,下面以重组植物乳杆菌MA2为例进行介绍.图1中 780,bp左右的nisI片段和图2中750,bp左右的gfp片段,均与理论值相符;Image Lab软件及SPSS软件中的一维方差分析显示,电泳条带亮度之间差异不显著,证明了质粒pMG36e-nisI-gfp的稳定性.

表1 重组菌传代20代后的菌落数Tab. 1 The CFU of the recombinants of the 20th generation during the subculture mL-1
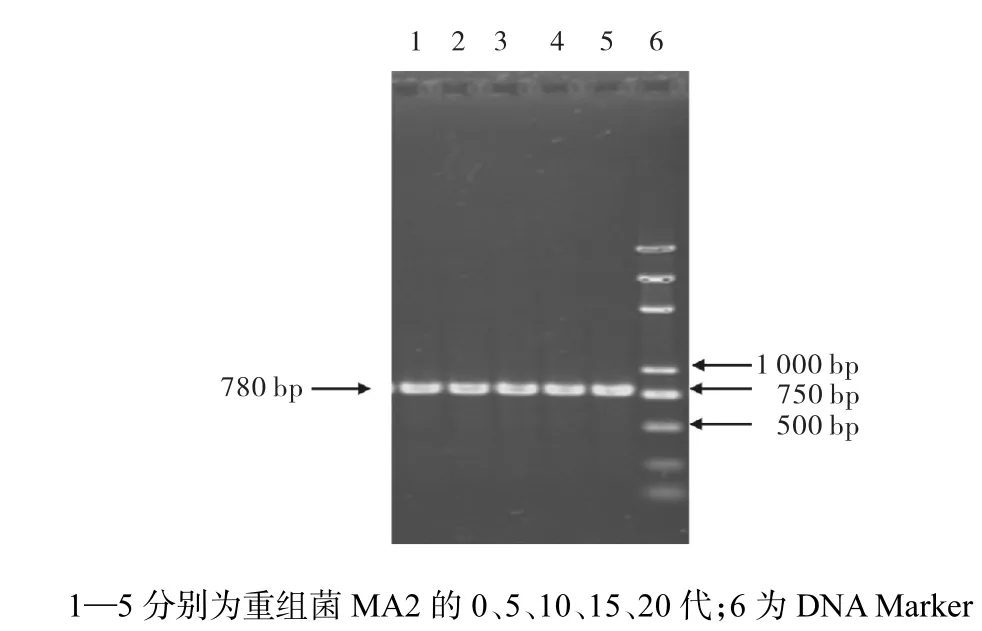
图1 重组菌MA2第0、5、10、15、20代质粒pMG36e-nisI-gfp的nisI基因PCR图Fig. 1 PCR of nisI gene of the primary and the 5th,10th,15th and 20th generations

图2 重组菌MA 2第0、5、10、15、20代质粒pMG36e-nisI-gfp的gfp基因PCR图Fig. 2 PCR of gfp gene of the primary and the 5th,10th,15th,and 20th generations of recombined Lb. plantarum MA2
2.4 质粒pMG36e-nisI-gfp的酶切鉴定
提取第0、5、10、15、20代重组菌的质粒,HindⅢ酶切后,图3中均可见约5,100,bp的片段,进一步说明了质粒pMG36e-nisI-gfp的稳定性.
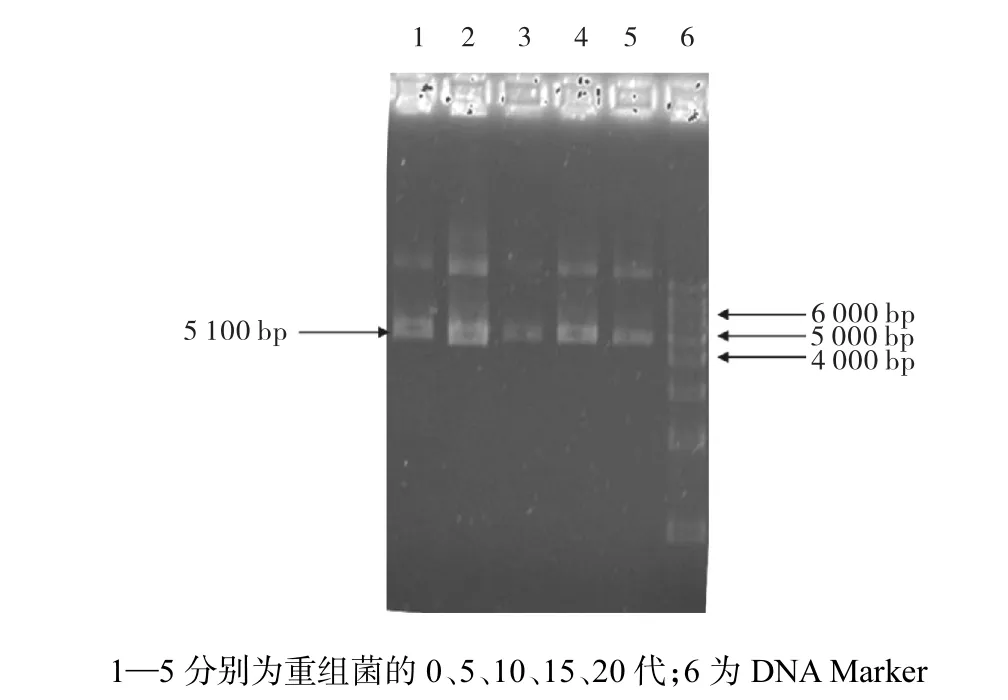
图3 重组菌MA2第0、5、10、15、20代质粒pMG36e-nisI-gfp的酶切鉴定Fig. 3 Restriction of plamids of the primary and the 5th,10th,15th,and 20th generations of recombined Lb. plantarum MA2
2.5 GFP在宿主菌中的表达
GFP的理论相对分子质量约为2.7×104.以取第0、5、10、15、20代菌液,超声波破碎后,用甲醇法抽提蛋白,进行SDS-PAGE电泳(图4).Image Lab软件及SPSS软件中的一维方差分析显示,电泳条带亮度之间差异不显著,验证了质粒pMG36e-nisI-gfp的稳定性.
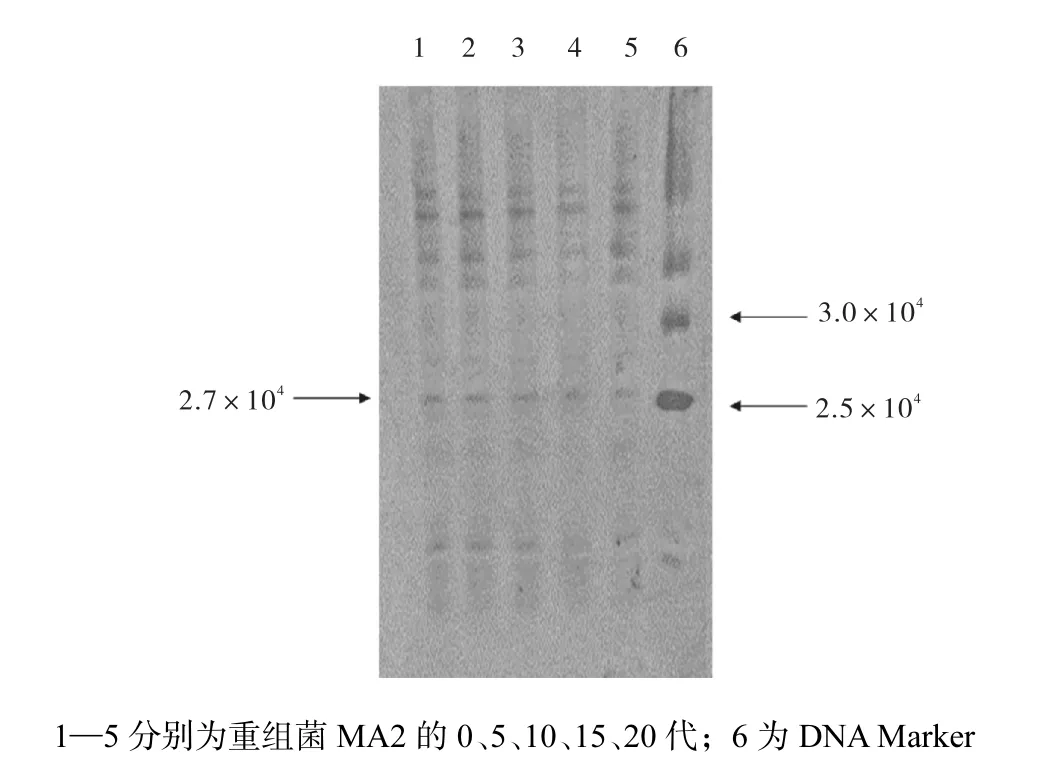
图4 重组菌MA2第0、5、10、15、20代质粒表达GFP的蛋白电泳Fig. 4 SDS-PAGE of the primary and 5th,10th,15th,and 20th generations of recombined Lb. plantarum MA22.6 质粒pMG36e-nisI-gfp作为遗传标记的应用效果
乳酸乳球菌是乳酸菌的模式菌株,将重组乳酸乳球菌WH-C1/pMG36e-nisI-gfp灌胃小鼠.灌胃后于不同时间宰杀,取胃肠道的不同部位,制片,在荧光显微镜下进行观察,结果如图5所示.灌胃重组菌小鼠的胃肠道中可以看到明显的荧光,而对照组则看不到荧光,证明质粒pMG36e-nisI-gfp可以作为一种遗传标记,以便于接下来研究乳酸菌在胃肠道中发挥益生作用的机理.

图5 重组乳酸乳球菌WH-C1在胃肠道中的荧光显微图Fig. 5 Pictures of the recombined L. lactis WH-C1 in the gastrointestinal tract
3 结 语
本实验将乳酸菌表达载体pMG36e-nisI-gfp成功转化乳酸乳球菌WH-C1、植物乳杆菌MA2及嗜热链球菌34中,说明该质粒有很好的宿主适用范围;传代培养20代后,质粒丢失率较低;传代后的重组菌与野生菌相比大小和形态基本不变;质粒经PCR、酶切验证后,大小不变,结构稳定;GFP在第0、5、10、15和20代宿主菌中都可以表达,表达量没有明显差别,表达产物在SDS-PAGE中的带型一致,都表明该质粒在宿主菌中具有良好的稳定性;初步的动物实验验证了该质粒在乳酸菌中作为遗传标记的应用效果.综上,乳酸菌表达载体pMG36e-nisI-gfp具有很好的稳定性,并且可以作为一种遗传标记,为以后研究乳酸菌在动物肠道中的分布和黏附定植规律奠定了基础,更有利于阐明乳酸菌制剂在动物肠道中发挥益生作用的机理.
[1]Kandler O,Weiss N. Bergey,s manual of systematic bacteriology[M]. Baltimore:Williams and Wilkins,1986:1209-1229.
[2]Hirose Y,Murosaki S,Yamamoto Y,et al. Daily in take of heat-killed Lactobacillus plantarum L-137 augments acquired immunity in healthy adults[J]. The Journal of Nutrition,2006,136(12):3069-3073.
[3]Anukam K C,Reid G. Lactobacillus plantarum and Lactobacillus fermentum with probiotic potentials isolated from the Vagina of healthy nigerian women[J]. Research Journal of Microbiology,2007,2(1):81-87.
[4]Nguyen T D,Kang J H,Lee M S. Characterization of Lactobacillus plantarum PH 04,a potential probiotic bacterium with cholesterol-lowering effects [J]. International Journal Food Microbiolgy,2007,113(3):358-361.
[5]Wang Yanping,Xu Nü,Xi Aodeng,et al. Effects of Lactobacillus plantarum MA2 isolated from Tibet kefir on lipid metabolism and intestinal microflora of rats fed on high-cholesterol diet [J]. Applied Microbial and Cell Physiology,2009,84(2):341-347.
[6]许女,王艳萍,习傲登,等. 一株Kefir源乳酸菌MA2的鉴定及对大鼠肠道菌群的影响[J]. 天津科技大学学报,2009,24(5):1-5.
[7]王艳萍,许女,白小佳. 植物乳杆菌MA2对大鼠血脂代谢的影响[J]. 中国酿造,2009(10):68-71.
[8]Wang Yanping,Wang Jingrui,Dai Weili. Use of GFP to trace the colonization of Lactococcus lactis WH-C1 in the gastrointestinal tract of mice [J]. Journal of Microbiological Methods,2011,86(3):390-392.
[9]赵瑞香,王大红,牛生洋,等. 超声波细胞破碎法检测嗜酸乳杆菌β-半乳糖苷酶活力的研究[J]. 食品科学,2006,27(1):47-50.
责任编辑:郎婧
Application of Recombined Plasmid pMG36e-nisI-gfp in Lactic Acid Bacteria
DAI Weili,WANG Yanping,WANG Jingrui,BAI Xiaojia
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
A constitutive expression vector for lactic acid bacteria,named pMG36e-nisI-gfp,was constructed first,usingnisIas the selection marker and GFP as the reporter protein. In this work,the expression vector was electroporated into some LABs and its plasmid stability was evaluated. The results showed that the loss rate of the plasmid strains harboring pMG36enisI-gfpwas still low even after 20,generations during the subculture in a liquid culture medium without antibiotics. The size and shape of the recombined strain did not change before and after subculture. The expression of GFP in the 0th,5th,10th,15th,and 20th,generations showed no significant difference. The effect of pMG36e-nisI-gfpas a reporter protein was proved in animal experiments. It was concluded that the plasmid pMG36e-nisI-gfphad good stability.
green fluorescent protein;lactic acid bacteria;plasmid stability
Q782
:A
:1672-6510(2012)03-0006-04
2011–12–12;
2012–03–16
“十二五”科技部高科技发展研究计划(863计划)(2011AA100904);高等学校博士学科点专项科研基金(20091208110001)
代伟丽(1984—),女,河北保定人,硕士研究生;通信作者:王艳萍,教授,ypwang@tust.edu.cn.

