抗黄瓜灰霉病的枯草芽孢杆菌筛选及其抑菌活性的初步研究
李丽梅,高丙利,柳 东,李兴林
(1. 工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457;2. 浙江东奇生物科技有限公司,湖州 313000)
抗黄瓜灰霉病的枯草芽孢杆菌筛选及其抑菌活性的初步研究
李丽梅1,2,高丙利2,柳 东1,2,李兴林1
(1. 工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457;2. 浙江东奇生物科技有限公司,湖州 313000)
结合涂布平板法和温室盆栽植株法,测定了41株枯草芽孢杆菌发酵液对灰霉病病原菌及黄瓜灰霉病的抑制效果,以此筛选出针对灰霉病的生防菌株.结果表明,抑菌效果最好的枯草芽孢杆菌为BS01和BS03.采用涂布平板法研究了菌株BS01和BS03抑菌活性,结果表明,抑菌效果均为50%时,BS03比BS01的菌体浓度低,得到抑菌效果最好的菌株BS03.采用温室盆栽植株法测试了菌株BS03的抑菌活性,结果表明,菌悬液比发酵滤液的抑菌效果好,并且在菌悬液处理黄瓜苗后的第3天抑菌活性最高.
灰霉病;生物防治;枯草芽孢杆菌
植物真菌病害每年给粮食和蔬菜的生产造成巨大的损失.目前,普遍采用化学农药防治植物病害.化学农药毒害非靶标生物、污染环境并使有害生物产生抗药性.而生物农药具有选择性高、易于降解、不易积累、用量少、污染小、对人畜毒性小、环境兼容性好、病虫害不易产生抗性等优点[1].因此,使用生物农药是克服化学防治造成环境污染、破坏生态平衡的有效途径之一[2].
枯草芽孢杆菌是目前生物农药中研究相对较多的一种细菌类微生物.该类菌在自然界中广泛存在,是植物体内常见的内生细菌,对人畜无明显毒害,具有显著的抗菌活性和极强的抗逆能力,有利于生防菌剂的生产、加工和储存,是一种理想的生防细菌.近年来,国内外学者在枯草芽孢杆菌防治植物病害方面进行了大量研究,并已开发出多种商品化菌剂应用于农业生产[3].
然而枯草芽孢杆菌的主要防治对象是水稻纹枯病、小麦纹枯病、番茄叶霉病、豆类根腐病、苹果霉心病、棉花立枯病、棉花枯萎病等.用于防治灰霉病的枯草芽孢杆菌还很少,且主要集中在番茄和草莓上的灰霉病防治上,因此用于防治黄瓜灰霉病的枯草芽孢杆菌的研究就更少.本研究的目的是筛选出能够抑制黄瓜上灰霉病菌的枯草芽孢杆菌菌株,为开发防治黄瓜灰霉病的微生物杀菌剂奠定基础.
1 材料与方法
1.1 材料
1.1.1 寄主植物
黄瓜为津优黄瓜一号,由湖州市种子市场上购买.
1.1.2 菌株
41株枯草芽孢杆菌(Bacillus subtili),由浙江东奇生物科技有限公司提供.病原指示菌为黄瓜灰霉病病原菌(Botrytis cinerea),由浙江化工院有限公司生物测试中心提供.
1.1.3 培养基
NA培养基(g/L):蛋白胨10,牛肉膏3,NaCl 5,琼脂15,pH 7.0
发酵培养基(g/L):蛋白胨10,牛肉膏3,NaCl 5,pH 7.0
PDA培养基(g/L):土豆 200,葡萄糖20,琼脂20,自然pH.
1.2 方法
1.2.1 枯草芽孢杆菌发酵液制备
从斜面取1环挑取枯草芽孢杆菌于发酵培养基中,在回转式摇床30,℃、220,r/min条件下培养1,d,制得种子液,并以2%接种量转接到装有90,mL液体发酵培养基的250,mL三角瓶中,在30,℃、220,r/min条件下发酵培养,获得发酵液(含有菌体)备用.
1.2.2 发酵滤液的制备
将发酵液4,000,r/min 离心30,min,上清液经过0.22,µL膜过滤,滤除菌体,获得无菌发酵上清液.
1.2.3 菌悬液的制备
将发酵液4,000,r/min 离心30,min,弃上清液,加入新鲜的NA培养基直至与原发酵液相同的体积.
1.2.4 灰霉菌菌块的制备
在无菌条件下,取20,mL经灭菌后冷却至45,℃左右的PDA培养基加入培养皿,制成PDA平板.放置24,h后,在平板中央接种灰霉菌菌丝,22,℃培养4,d.在已长好的灰霉菌平皿中,用直径0.5,cm打孔器在菌落边缘切取菌落圆块,备用.
1.2.5 枯草芽孢杆菌对灰霉菌的抑制作用
用无菌水稀释发酵液至菌体浓度为1×105,mL–1的稀释液,其中枯草芽孢杆菌计数法采用的是显微直接计数法.向放置1,d的PDA平板中加入100,μL的枯草芽孢杆菌发酵稀释液,用涂布器涂匀,每个处理3个重复.将切取的灰霉菌菌块接种在涂好的平板中央,有菌丝的一面接触平板.25,℃培养4,d后,用直尺“十字交叉法”测量灰霉菌菌落直径(单位为cm),结果取其平均值.

1.2.6 枯草芽孢杆菌对黄瓜灰霉病的防治效果
选择1片真叶期长势一致的盆栽黄瓜苗,药剂喷雾处理(以叶片滴下液滴为准)后自然晾干24,h,每个处理4个重复.用镊子将菌块接种在叶片中央,有菌丝的一面接贴于叶面.然后将黄瓜苗放在不同的湿盒中,25,℃下黑暗保湿24,h,再维持相对湿度90%左右、光暗周期(d/n)10,h/14,h下培养3,d.用直尺“十字交叉法”测病斑直径(单位为cm),结果取其平均值.
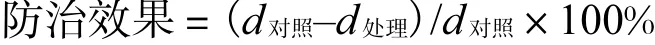
2 结果与分析
2.1 不同菌株枯草芽孢杆菌对灰霉菌的抑制效果比较
测试41株枯草芽孢杆菌发酵液(菌体浓度1× 105,mL–1)对灰霉菌的抑制作用.供试枯草芽孢杆菌发酵液对灰霉菌菌丝生长表现出不同程度的抑制作用.其中BS01、BS03、095802、095303、094510和142203菌株对灰霉菌菌丝生长的抑制作用达到了50%以上.BS01和BS03对灰霉菌菌丝生长的抑制效果与稀释100倍的50%扑海因悬浮剂相当,抑菌率分别为64%和61%.
为了进一步确定初筛结果的可靠性,利用平板法对BS01、BS03、095802、095303、094510和142203菌株的发酵液进行复筛.共设3次独立的重复实验,每次实验采用3个重复,取3个重复抑菌率的平均值作为1次实验的分析值,结果见表1.
将自磨刃强化处理的刀片对称安装在铡草机上,在3个月的秸秆(约40t)加工过程中,刀片没有经过人为磨刀。刀片始终保持良好的锐利度(如图7所示),出现了不同程度的自磨刃效果。3种刀片不同程度上出现了崩刃现象,在崩刃的地方也出现自磨刃效果。不同渗层的刀片质量变化也有所不同,具体磨损质量如表5所示。磨损质量对比分析:
由表1可知,在3次重复实验中,供试菌株的发酵液对灰霉菌菌丝生长均表现出较强的抑制作用,而且标准差在10%以内,重复性较好;在3次实验中,各枯草芽孢杆菌的发酵液对灰霉菌菌丝生长的抑菌率趋势基本一致,其中,BS01和BS03对灰霉菌菌丝生长的抑菌率为最高,分别为67.91%和65.45%.
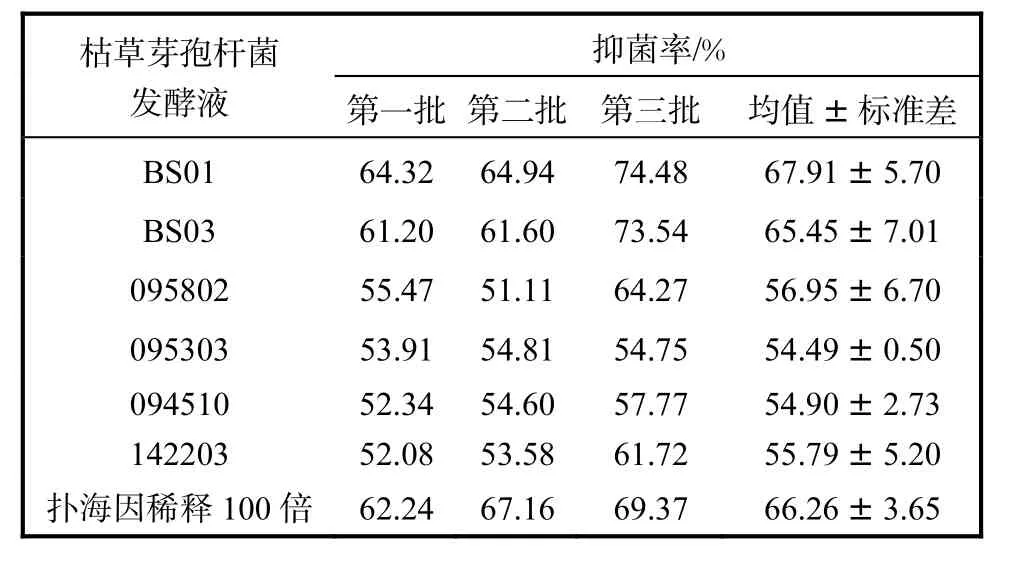
表1 枯草芽孢杆菌发酵液对灰霉菌的抑制作用Tab. 1 Inhibition of Bacillus on Botrytis cinerea growing
2.2 复筛后的6株枯草芽孢杆菌对盆栽黄瓜灰霉病的防治效果
为了验证平板法筛选出的菌株发酵液在植物活体上对病原菌的抑制效果,以盆栽黄瓜苗为寄主植物,检测BS01、BS03、095802、095303、094510和142203发酵液对黄瓜灰霉病的防治效果,结果见表2.

表2 枯草芽孢杆菌对黄瓜灰霉病菌的防治效果Tab. 2 Efficacies of Bacillus against gray mold on cucumber leaves
从表2中可以看出,枯草芽孢杆菌发酵液对温室盆栽黄瓜灰霉病的抑制作用低于平皿实验中对灰霉病菌的抑制效果.095802、095303和142203发酵液在植物活体实验中对灰霉病没有防治作用,094510有29.73%的抑制效果;BS01和BS03仍然保持对黄瓜灰霉病一定的抑制作用,抑菌率分别为47.62%和53.44%.
2.3 菌株BS01和BS03对灰霉菌菌丝的抑制作用
分别稀释BS01和BS03的发酵液至菌体浓度为108、107、106、105、104、103、102,mL–1,采用涂布平板法测试不同的菌体浓度的发酵液对黄瓜灰霉菌菌丝的抑制作用.
由图1可知随发酵液中菌体浓度的降低,发酵液对灰霉菌菌丝生长的抑制作用减弱,其中BS01发酵液对灰霉菌抑制作用的下降趋势比BS03明显.另外,当菌体浓度为103,mL–1时,菌株BS03和BS01抑菌率仍在50%左右.
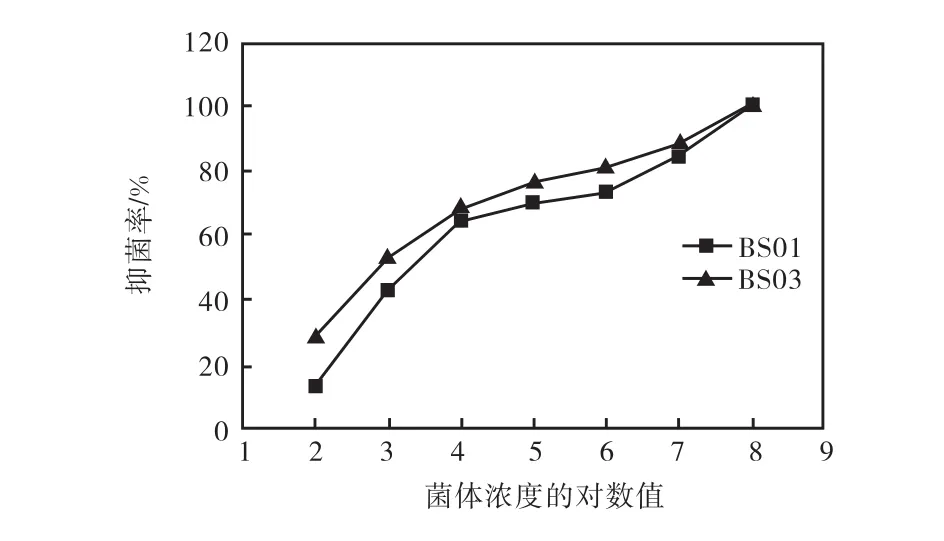
图1 菌株BS01和BS03对黄瓜灰霉菌菌丝的抑制作用Fig. 1 Efficacies of BS01 and BS03 on Botrytis cinerea growing

表3 菌株BS01和BS03对灰霉菌菌丝生长的影响(自由度f=6)Tab. 3 Effects of BS01 and BS03 on Botrytis cinerea growth
由表3可知,当抑菌率为50%时,BS03的菌体浓度低于BS01的菌体浓度,因此BS03抑菌效果比BS01的抑菌效果好.
2.4 菌株BS03发酵滤液、菌悬液的抑菌活性
发酵滤液易于加工剂型,新鲜的培养基在加工剂型中具有保护菌体的作用;因此,研究发酵滤液和菌悬液的抑菌活性具有一定的意义.
将发酵液、发酵滤液、菌悬液稀释1、2、5、10、20倍,以发酵液作对照,比较菌悬液和发酵滤液对灰霉病的防治效果,结果如图2所示.菌悬液、发酵滤液对灰霉病的防治效果随其浓度的降低而降低,说明发酵滤液和菌悬液在防治灰霉病中起到一定作用.其中,当发酵滤液稀释10倍和稀释20倍时,发酵滤液对灰霉病几乎没有防治作用;稀释20倍时的防治效果反而比稀释10倍时的防治效果更好,这可能是由于误差作用.菌悬液对灰霉病的防治效果高于发酵滤液,说明选择菌悬液防治黄瓜灰霉病优于发酵滤液.
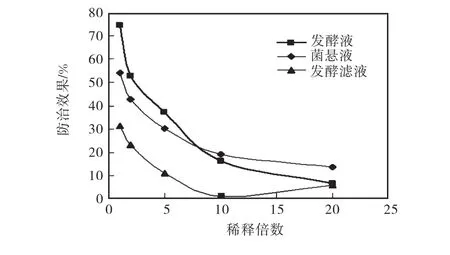
图2 发酵液、菌悬液、发酵滤液对黄瓜灰霉病菌的防治效果Fig. 2 Efficacies of fermentation liquid,bacterial suspendsion,supernatant against gray mold on cucumber
2.5 病原菌的接种时间对抑菌活性的影响
在测试发酵液、发酵滤液、菌悬液防治效果实验中,菌悬液表现出较高的防治效果,仅次于发酵液.考察菌悬液处理黄瓜苗后,在不同时间接种灰葡萄孢菌,其对灰霉病的防治效果如图3所示.

图3 病原菌接种时间对防治效果的影响Fig. 3 Control efficacy of different intervals after treatment
由图3可知,用菌悬液处理3,d后接种病原菌,对灰霉病的防治作用最高,表现良好的防病效果,其防效达63.92%.可能是由于菌体的定殖能力和菌体对营养物质的快速利用抑制了葡萄孢菌的生长,从而达到防治灰霉病的作用.
3 讨 论
芽孢杆菌是土壤和植物微生态区系的优势生物种群,具有很高的抗逆能力和抗菌防病作用.许多优良的天然菌株已成功地用于防治植物病害.Bacon等[4]分离的玉米内生枯草芽孢杆菌与病原串珠镰孢菌有相同的生态位,枯草芽孢杆菌能在玉米体内迅速定殖和繁殖,有效降低串珠镰孢菌及毒素的积累.Papavizas等[5]报道,枯草芽孢杆菌可以防治水稻等作物的多种土传真菌病.Hwang等[6]报道,枯草芽孢杆菌可以防治豌豆的根腐病.20世纪90年代后,国外许多枯草芽孢杆菌制剂上市.日本东京技术研究所的枯草芽孢杆菌RB14和NB22分别对Rhizoctonia solani、Fusarium orysporum和Pseudornonas solanacearum引起的番茄病害有良好的防效[7].至2001年,美国已有4株枯草芽孢杆菌生防菌株,QST713、GBO3、MBI600和FZB24均获得了美国环保署(EPA)商品化或有限商品化生产应用许可[8].我国一些科研人员也对具有生防作用的枯草芽孢杆菌进行了研究.王雅平等[9]采用室内平皿实验、盆栽和田间小区实验确定枯草芽孢杆菌A014菌株对小麦赤霉病的防效达50.6%,之后他们从丝瓜根际土壤分离到枯草芽孢杆菌TG26菌株[10].该菌株对小麦赤霉病和西瓜枯萎病有较强的抑制作用,对小麦赤霉病的盆栽防效达89.8%,对西瓜枯萎病的苗期防效达100%.田间小区实验表明,对小麦赤霉病、西瓜枯萎病的防效分别为73.1%和79.6%,并且有明显的增产效应.张学君等[11]用枯草芽孢杆菌B3菌株防治小麦纹枯病,田间防效为50%~80%,并确定了它在小麦根系及茎基部的定殖能力.
本研究采用涂布平板法和盆栽植株法测定了枯草芽孢杆菌发酵液对灰霉菌菌丝的抑制作用.比较两种方法的结果,筛选出防治黄瓜灰霉病效果较好的菌株BS03.
盆栽植株法对灰霉菌的防治效果低于涂布平板法的抑菌效果.产生这个结果的原因有三点:一是环境因素的影响.因为盆栽植株法测定是在活体植株的叶片上,外界环境影响菌株的生长繁殖以及菌株之间可能产生相互作用.二是枯草芽孢杆菌的作用机理为与病原菌竞争营养和空间,对病原菌产生拮抗作用或对植物的诱导作用等.因此,枯草芽孢杆菌在植物叶片上的定植、在叶片上接种病原菌的时间、枯草芽孢杆菌的发酵时间、发酵液的pH等对枯草芽孢杆菌的抑菌效果影响很大.而涂布平板法是病原菌和枯草芽孢杆菌之间的作用,相对来说影响因素少.三是供试样品仅为发酵液而不是制剂化产品,其在叶片上的黏附性及稳定性需要助剂来增强.
菌株BS03发酵液具有较强的抑菌作用,室内盆栽植株实验的防病效果在50%以上,对田间实验具有一定的意义.另外用新鲜的培养基重新悬浮菌体后表现出良好的抑菌效果,新鲜培养基既可以为菌体生长繁殖和代谢提供营养物质,还可以在制造剂型过程和贮存过程中保护菌株.说明BS03菌悬液可将作为微生物源杀菌剂进行深入研究.
[1]王文静. 我国生物农药的现状与发展建议[J]. 赤峰学院学报:自然科学版,2010,26(6):152-153.
[2]阮云飞,穆瑞霞,王吉庆,等. 放线菌F24发酵液对灰霉菌拮抗作用初探[J]. 河南农业科学,2008(11):84-87.
[3]赵达,傅俊范,裘季燕,等. 枯草芽孢杆菌在植病生防中的作用机制与应用[J]. 辽宁农业科学,2007(1):46-48.
[4]Bacon C W,Yates I E,Hinton D M,et al. Biological control ofFusarium moniliformein maize [J]. Environmental Health Perspectives,2001,109(S2):325-332.
[5]Papavizas G C,Lumsden R D. Biological control of soilborne fungal propagules[J]. Annual Review of Phytopathology,1980,18:389-413.
[6]Hwang S F,Chakravartyp P. Potential for the integrated control ofRhizoctoniaroot rot ofPisumsativumusingBacillussubtilisand a fungicide[J]. Journal of Plant Diseases and Protection,1992,99(6):626-636.
[7]Asaka O,Shoda M. Biocontrol ofRhizoctoniasolani damping-off of tomato withBacillus subtilisRB14[J]. Applied and Environmental Microbiology,1996,62(11):4081-4085.
[8]Office of Pesticide Program:biopesticide[DB/OL]. 2001,http://www. epa. gov/ pesticides/ biopesticides.
[9]王雅平,刘伊强,潘乃穟,等. 枯草芽孢杆菌A014菌株防治小麦赤霉病的初步研究[J]. 生物防治通报,1992,8(2):54-57.
[10]王雅平,刘伊强,潘乃穟,等. 枯草芽孢杆菌TG26防病增产效应的研究[J]. 生物防治通报,1993,9(2):63-68.
[11]张学君,赵军,王金生. 枯草芽孢杆菌B3菌株对小麦根系和茎基部的定殖作用研究[J]. 生物防治通报,1994,10(4):171-174.
责任编辑:郎婧
Screening Bacillus subtilis against Botrytis cinerea on Cucumber and Preliminary Studies of its Inhibition Activities
LI Limei1,2,GAO Bingli2,LIU Dong1,2,LI Xinglin1
(1. Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China;2. Zhejiang Dongqi Biotech Co. Ltd.,Huzhou 313000,China)
By the combination of in-vitro plate assay and in-vivo leaf assay,the biocontrol activity of 41 Bacillus subtilis strains in-vitro over mycelial growth of B. cinerea,as well as their controlling efficacies over gray mold on cucumber leaves in pots were evaluated,so as to screen the strains which could inhibit the mycelial growth of B. cinerea. The results indicated that B. subtilis BS01 and BS03 were identified to have the strongest ability to control the cucumber gray mold. While the cell concentration of both BS01 and BS03 had 50% of effect in plate assay,the cell concentration of BS03 was lower. But BS03 appeared to have better effect. The controling efficacy of BS03 in-vivo leaf assay revealed that the cell suspension displayed a higher control efficacy than supematant. The cell suspension was used on cucumber leaves. After two days,the pathogen was inoculated,and the inhibition activity was then the highest.
gray mold;biopesticides;Bacillus subtilis
Q939.96
:A
:1672-6510(2012)03-0010-05
2011–10–21;
2012–02–08
李丽梅(1985—),女,河北邢台人,硕士研究生;通信作者:李兴林,副教授,lxlszf@tust.edu.cn.

