废弃蓖麻基润滑油高效降解菌的分离与鉴定
刘亚琼,王昌禄,李风娟,叶 峰
(1. 食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457;2. 南开大学蓖麻工程研究中心,天津 300071)
随着人类环保意识的提高,人们已开始关注润滑油可能造成的环境污染.石油的开采、运输、加工、储藏等人为活动的进行,使得石油及石油产品成为土壤有机污染的重要因素.在油井附近,石油类污染物含量平均达到 15.8,g/kg,而农田中的含量仅为 2.2,mg/kg[1],全世界每年约有10亿吨石油及其产品通过各种途径进入地下水、地表水及土壤中[2–3].随着全球润滑油消耗量逐渐增加,对环境的污染日趋加剧,污染物严重影响人类及其他生物的生存健康[4–5].目前,大多数研究通过添加 N、P[6]等营养物质改善土著微生物的活性,但受环境影响,土著微生物生长缓慢,使环境修复受到一定限制.向环境中投加适应强、降解效能高的菌种或菌群是提高石油污染土壤生物修复效率的主要手段[7–9],开发可生物降解润滑油并对润滑油进行生物降解可行性评价已经成为润滑油行业发展的必然趋势[10].
蓖麻基润滑油是以蓖麻油为主要原料合成的一种新型润滑油,在使用过程中是否可生物降解以及对环境造成污染的程度是企业关注的热点.目前,国际上已建立了多种有机物生物降解性的测定方法[11–15],如通过检测 CO2的生成量来评价其生物降解能力的STURM 法[12];以 BOD5/CODCr为度量指标,检测生物降解过程中 O2消耗量的 MITI法[12];以生物降解前后油品含量的变化为其度量指标的 CEC-L-33-A-93法[13–14]以及其他实验方法[15].在借鉴这些常用生物降解方法的基础上,本文采用气相色谱法(GC),通过添加内标物,定量分析废弃蓖麻基润滑油的残余量,计算废弃蓖麻基润滑油的降解率,既而从蓖麻榨油车间排污口处分离到对废弃蓖麻基润滑油具有降解特性的菌株.
1 材料与方法
1.1 样品来源及培养基
从内蒙古某蓖麻榨油车间排污口采取土样和水样;废弃蓖麻基润滑油由南开大学蓖麻工程研究中心提供.
矿物降解培养基:KH2PO43.4,g,Na2HPO41.5,g,(NH4)2SO44.0,g,MgSO40.7,g,NaCl 1.6,g,酵母粉0.01,g,吐温 80 0.6,mL,蓖麻基润滑油 5.0,mL,自来水 1,L,pH 7.0~7.2,121,℃灭菌 20,min.
富集培养基:葡萄糖 3,g,NaCl 5,g,酵母膏 3,g,蛋白胨 3,g,K2HPO4·3H2O 2.7,g,自来水 1,L,pH 7.2,115,℃灭菌 15,min.
麦芽汁培养基:将麦芽粉与水以质量比为 1﹕4混合,在 65,℃水浴锅中保温 3~4,h,使其自行糖化,直至糖度为 12,Brix,糖化液用 4~6层纱布过滤,滤液如仍混浊,可用鸡蛋清澄清(用 1个鸡蛋清,加水20,mL,调匀至生泡沫,倒入糖化液中,搅拌煮沸,再过滤).
PDA培养基:称取去皮马铃薯200,g,切成小块,加入 1,L自来水煮沸 30,min,用双层纱布滤成清液.加水至 1,L,加入 20,g葡萄糖完全溶解,pH 自然.固体培养基加琼脂20,g.121,℃灭菌15,min.
1.2 降解菌的分离筛选
在无菌条件下,取少量样品,加入 50,mL无菌水搅拌,制成悬浮液,移取 0.1,mL悬浮液,放入以废弃蓖麻基润滑油为唯一碳源的筛选培养基平板上,用无菌涂布器连续涂布 4个平板,置于 30,℃恒温培养箱中培养 2~3,d,挑取生长较快且不同菌落形态的菌株,进一步分离纯化复筛.从中筛选出能以废弃蓖麻基润滑油为唯一碳源生长的菌株.
1.3 培养条件对菌株生长的影响
配制初始 pH 分别为 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0的 PDA 培养基,灭菌后用无菌水冲洗试管斜面,将冲洗的孢子混匀后按 3%的量加入到不同初始 pH的 PDA培养基中.培养 3,d后观察菌株生长状况,过滤后在 80,℃鼓风烘箱中烘干菌丝体至恒质量,称取菌丝体.同理,在不同培养温度:15、20、25、30、35、40,℃的培养环境中,180,r/min,培养48,h后,测定不同培养温度时生物量,确定最适生长温度.称取 0.5、1、2、4、6、8、10、12,g 废弃蓖麻基润滑油分别加入 100,mL的矿物培养基中,30,℃、培养12,d后观察各瓶生长情况.
1.4 菌落形态观察
在麦芽汁和 PDA平板培养基中观察菌株 M-4的菌落特征,并用电镜扫描观察其菌丝体孢子形态,初步确定菌株的分类.
1.5 18S,rDNA基因扩增及序列分析
采用CTAB法提取菌株M-4总DNA,利用真菌18,S rDNA扩增通用引物 F1(GTAGTCATATGC TTGTCTC)和R1(TCCGCAGGTTCACCTACGGA)进行PCR扩增.25,µL反应体系中含有:10×PCR缓冲液 2.5,µL,50,mmol/L 的 MgCl20.8,µL,10,mmol/L的 dNTP 0.5,µL,引物各 0.5,µL,5,U/µL 的 Taq DNA聚合酶 0.2,µL,模板 DNA 1,µL,加无菌双蒸水补至25,µL.PCR 反应条件为:94,℃变性 5,min,55,℃退火30,s,72,℃延伸 1,min,30个循环后 72,℃温育10,min,4,℃保存备用.扩增产物通过 1.5%琼脂糖凝胶电泳进行检测,在凝胶成像仪上观察并记录结果,得到条带清晰的片段后进行切胶,用Axygen 凝胶回收试剂盒对PCR产物进行回收纯化.
扩增后的 18S rDNA纯化后由英潍捷基(上海)贸易有限公司进行测序,测得的序列提交到GenBank并在国际生物技术信息网中心(NCBI)数据库(http://www.ncbi.nlm.nih.gov/)中进行序列同源性分析,使用Clustal X1.8软件与从GenBank数据库中获得的18S rDNA序列进行多序列比较,Mega 4.0软件中NJ法(邻接法)构建16S rDNA系统发育树,bootstrap检验,重复1,000次,确定该菌株的分类.
1.6 标准曲线的绘制
分别称取 10.0、30.0、50.0、70.0、90.0,mg 的废弃蓖麻基润滑油基础油及 50.0,mg联苯置于 10,mL容量瓶中,用联苯作内标物,乙酸乙酯作溶剂.萃取物用GC进行分析:采用火焰离子化检测器(FID),Rtx-5 的二氧化硅柱.分析条件:初始温度为 50,℃,保持5,min,然后以20,℃/min 升温至 280,℃,保持 40,min.进样器和检测器的温度都维持在 280,℃,进样 1,µL,用氮气作载气.以联苯与基础油的质量比为横坐标,面积比为纵坐标绘制标准曲线.
1.7 废弃蓖麻基润滑油基础油降解实验
将菌株 M-4活化后进行废弃蓖麻基润滑油基础油的生物降解,从种子培养基中吸取 1,mL种子液,接种到已灭菌的含废弃蓖麻基润滑油基础油的锥形瓶中,准确称取每瓶加入的废弃蓖麻基润滑油基础油,30,℃、180,r/min遮光振荡培养 7,d,取出培养液,10 000,r/min离心10,min,取上清液,加入1,mol/L的HCl约 1,mL和 NaCl 20,g,振荡,待 NaCl完全溶解后,采用超声波细胞破碎仪将培养基中的微生物细胞壁破碎,使内容物释放及进一步破乳.用乙酸乙酯作萃取剂萃取3次,每次用量30,mL,剧振2,min,静置分层,收集萃取液上层有机相,放入三角瓶中,在萃取后90,mL的萃取液中加入500,mg联苯,作为内标物.按照1.6的条件进行GC分析.

式中:m基剩为剩余基础油的质量;m联苯为联苯的质量;m基为基础油的质量;A联苯为联苯的峰面积;A基剩为剩余基础油的峰面积;w为降解率.
2 结果与分析
2.1 高效降解菌的筛选
从内蒙某蓖麻榨油厂排污口采取土样和水样,经富集培养及分离纯化,筛选出 25株菌株,经过润滑油降解实验诱导驯化后选取能在废弃蓖麻基润滑油为唯一碳源培养基上生长较好的菌株M-4.
2.2 菌落形态观察
菌株 M-4的菌落特征如图 1所示,菌丝体孢子形态见图2.
由图 1和图 2可以看出,在麦芽汁培养基上,30,℃培养 4,d,菌株 M-4的菌落直径达 20,mm,表面毛绒状,菌丝致密交错,分生孢子梗先白色然后四周开始变成褐色,而 PDA培养基的生长状态基本与麦芽汁培养基上生长状态一致.
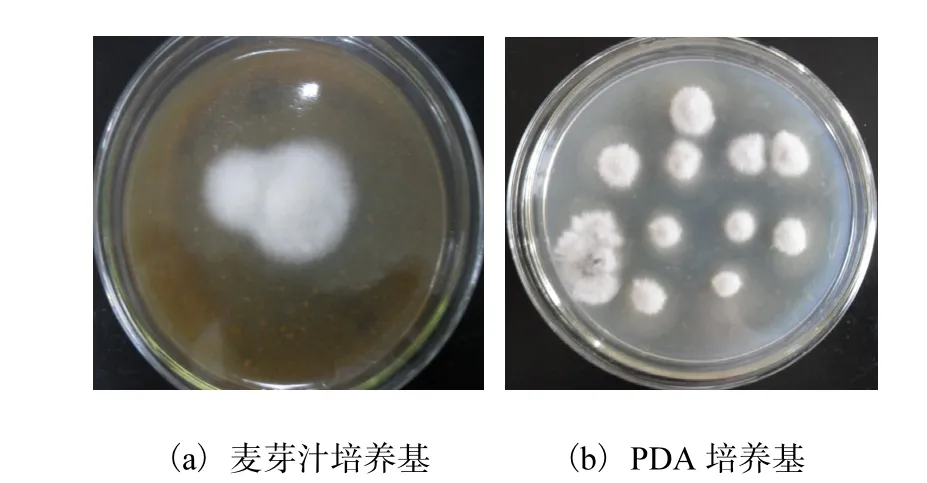
图1 菌株M-4菌落形态Fig. 1 Colonial morphology of M-4 strain

图2 菌株M-4电镜扫描图Fig. 2 Scanning map of M-4 strain under electron microscope
2.3 菌株M-4的18S rDNA序列分析
以菌株 M-4提取的 DNA为模板,扩增其 18S rDNA基因序列,得到长约1,500,bp的18S rDNA片段,如图 3所示.扩增片段经测序后,测得其长度为1,675,bp,其 GenBank 序列号为 HM165489.1.
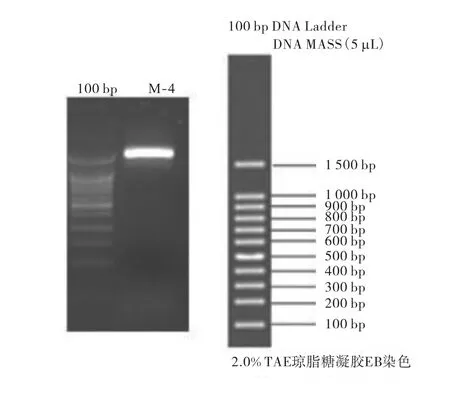
图3 菌株M-4的18S rDNA片段扩增电泳图谱Fig. 3 18S rDNA fragments amplified by electrophoresis of M-4 strain
2.4 系统进化树分析
将菌株M-4的基因序列提交至GenBank数据库并进行 Blast比对,其序列与链格孢属(Alternaria alternata)同源性达99%,选取11株同源性较高的菌株序列进行比对,构建系统发育树,如图4所示.由18S rDNA基因序列比对可知,菌株 M-4与 Alternaria alternata亲缘关系最接近,结合菌落形态观察,菌株M-4鉴定为链格孢属(Alternaria alternata).

图4 菌株M-4 18S rDNA基因序列构建的系统发育树Fig. 4 Phylogenetic tree constructed by18S rDNA gene sequence of M-4 strain
2.5 培养条件对菌株生长的影响
2.5.1 最适pH
在其他条件一致的情况下,培养基的初始 pH对菌株 M-4的生长有较大影响.在不同 pH下,菌株M-4生长状态、菌丝体形状、发酵产物颜色等都不同.观察发现,pH 2和pH 10的培养瓶都不生长;pH 3的生长较慢,呈小球状;pH 9的培养基呈浑浊状态,菌丝体呈小球状;其余 pH条件下的菌株生长液呈黑色黏稠状;pH 5、pH 7的颜色较深;pH 6的培养基中菌体呈团,培养液澄清.将培养3,d不同初始pH的菌株 M-4进行过滤烘干至恒质量后称取菌体,初始pH对菌株M-4生长的影响如图5所示.菌株M-4在酸、碱性条件下都能适应并生长,最适pH为5.0.
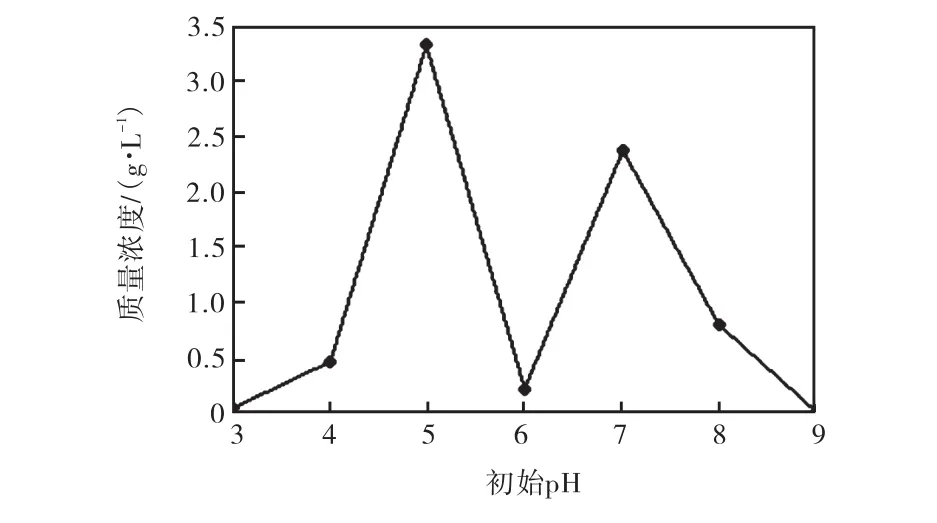
图5 初始pH对菌株M-4生长的影响Fig. 5 Effect of initial pH on the growth of M-4 strain
2.5.2 最适温度
随着温度的上升,细胞中的生化反应速率和生长速率加快;另一方面,机体的重要组成如蛋白质、核酸和催化反应的酶等对温度都很敏感,随着温度的增高可能受到不同程度的破坏.因此,选择合适的温度对菌株性能至关重要.温度还影响酶活力,在适宜温度下,产酶量增加,酶的活力提高,菌株降解能力增强[16].
培养温度对菌株 M-4生长的影响如图 6所示.从图 6可以看出,菌株 M-4在 30,℃时生物量最高.

图6 温度对菌株M-4生长的影响Fig. 6 Effect of temperature on the growth of M-4 strain
2.5.3 润滑油极限含量
润滑油降解过程中主要依靠微生物对底物的一系列复杂的生化反应过程来达到降解目的.图7为菌株 M-4在不同润滑油含量的培养基中降解 7,d后的生长情况.

图7 菌株 M-4在不同废弃蓖麻基润滑油含量的培养基中的生长情况Fig. 7 Growth condition of M-4 strain at different concentrations of waste castor-based lubricants
从图 7可以看出,菌株 M-4在含废弃蓖麻基润滑油12%的矿物培养基中生长良好,将废弃蓖麻基润滑油直接降解变成黏稠的泥状.表明该菌株在富含废弃蓖麻基润滑油的环境中生长旺盛,可为实际生态修复提供参考.
2.6 标准曲线的绘制
按1.6方法绘制废弃蓖麻基润滑油基础油标准曲线(图 8),求出线性回归方程 y=1.477,4x+0.185,2,相关系数 R2=0.999,4.以联苯与基础油的质量比为横坐标,面积比为纵坐标绘制标准曲线.
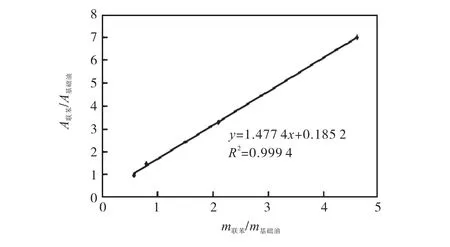
图8 蓖麻基润滑油基础油标准曲线Fig. 8 Standard curve of base oil of castor-based lubricants
2.7 废弃蓖麻基润滑油基础油降解后GC分析
根据废弃蓖麻基润滑油基础油标准曲线和内标物(联苯)计算废弃蓖麻基润滑油基础油残余量.
废弃蓖麻基润滑油基础油降解后萃取的有机相用 GC进行分析(图 9),样品中只检测到溶剂峰,联苯峰和废弃蓖麻基润滑油基础油峰,分别出现在保留时间为 3、12、21,min处.根据联苯的质量和峰面积计算残余废弃蓖麻基润滑油基础油和降解的废弃蓖麻基润滑油基础油质量,结果见表1.

图9 菌株M-4降解废弃蓖麻基润滑油基础油的GC图Fig. 9 GC map of the base oil of waste castor-based lubricants after degradation by M-4 strain

表1 菌株M-4对废弃蓖麻基润滑油基础油的降解情况Tab.1 Degradation rate of the base oil of waste castor-based lubricants
从表1可以看出,菌株M-4对废弃蓖麻基润滑油基础油降解率为71.3%.
3 结 论
利用废弃蓖麻基润滑油为唯一碳源的矿物培养基,采用平板梯度连续涂布法,从内蒙古蓖麻榨油车间排污口分离筛选到一株高效降解菌M-4,通过对该菌株生理生化特性、18S rDNA基因扩增及系统进化树分析,菌株M-4鉴定为链格孢属.
此外,对菌株M-4培养特性的研究表明,在不同初始pH和培养温度下,菌株M-4生长状况不同,影响较大.在其他条件一致时,废弃蓖麻基润滑油含量不同,菌株M-4的生长情况不同,在含废弃蓖麻基润滑油 12%的矿物培养基中,菌株仍能较好地生长,将废弃蓖麻基润滑油直接降解变成黏稠多孔的泥状,为生态环境的实地修复提供了参考.
在废弃蓖麻基润滑油基础油中加入 M-4菌液培养7,d后,降解率达到71.3%.采用GC方法,检测废弃蓖麻基润滑油基础油的降解产物,未出现其他中间代谢产物,表明废弃蓖麻基润滑油的基础油主要成分更容易被微生物降解.
[1] 韩言柱,王立成,许学工,等. 黄河三角洲土壤(潮土)石油类含量对小麦的影响和研究[J]. 环境科学与技术,2000(4):1-4.
[2] 袁婧,李聪,王秋玉. 石油污染土壤降解细菌的分离、鉴定及生长条件优化[J]. 中国农学通报 2011,27(6):266-271.
[3] Watanabe Kazuya,Watanabe Kanako,Kodama Y,et al.Molecular characterization of bacterial populations in petroleum-contaminated groundwater discharged from underground crude storage avities[J]. Applied and Environmental Microbiology,2000,66(11):4803-4809.
[4] Battersby N S. The biodegradability and microbial toxicity testing of lubricants[J]. Chemosphere,2000,41(7):1011−1027.
[5] 唐秀军,汪孟言. 润滑油生物降解能力评定方法[J].石油商技[J]. 1999,17(1):24-26.
[6] 徐金兰,黄廷林,唐智新,等. 高效石油降解菌的筛选及石油污染土壤生物修复特性的研究[J]. 环境科学学报,2007,27(4):622-628.
[7] Lee S H,Lee S,Kim D Y,et al. Degradation characteristics of waste lubricants under different nutrient conditions[J]. Journal of Hazardous Materials,2007,143(1/2):65–72.
[8] Nievas M L,Commendatore M G,Olivera N L,et al.Biodegradation of bilge waste from Patagonia with an indigenous microbial community [J]. Bioresource Technology,2006,97(18):2280–2290.
[9] Bai Yaohui,Sun Qinghua,Zhao Cui,et al. Simultaneous biodegradation of pyridine and quinoline by two mixed bacterial strains[J]. Applied Microbiology Biotechnology,2009,82(5):963–973.
[10] 吴新世,叶锋,张金涛,等. 新型润滑油生物降解性及其分析方法改进探讨[J]. 微生物学通报,2008,35(6):872–875.
[11] 王昆,方建华,陈波水,等. 润滑油生物降解性快速测定方法的研究[J]. 石油学报:石油加工,2004,20(6):74-78.
[12] Nagai H. Evaluation of the newly developed test methods for lubricant biodegradability[J]. Lubricant Oils,1999,42(1):45-51.
[13] Coordinating of European Council. CEC-L-33-A-93.Biodegradability of two stroke cycle outboard engine oils in water[S]. CEC Standard,1995.
[14] 陈波水,方建华. 环境友好润滑剂[M]. 北京:中国石化出版社,2006:207-209.
[15] 吕刚,解世文,居荫诚. 二冲程汽油机润滑油生物降解性及其评定方法的研究[J]. 润滑与密封,2006,173(1):51-56.
[16] 偲游 ,朱琳,张艳,等. 含油废水中一株高效油脂降解菌的筛选和鉴定[J]. 生态环境学报,2010,26(6):1378-1382.

