聚腺苷二磷酸核糖糖苷水解酶调节癫痫大鼠海马组织凋亡诱导因子及炎症因子的研究*
王胜军, 赵秀鹤, 刘学伍, 张同霞, 陈学兰, 迟兆富△
(山东大学齐鲁医院1神经内科,2药剂科,山东济南250012)
聚腺苷二磷酸核糖[poly(adenosine diphosphate ribose),PAR]广泛存在于细胞中,参与细胞DNA的修复及基因组稳定[1]。聚腺苷二磷酸核糖聚合酶[poly(adenosine diphosphate ribose)polymerase,PARP]和聚腺苷二磷酸核糖糖苷水解酶[poly(adenosine diphosphate ribose)glycohydrolase,PARG]是细胞内聚腺苷二磷酸核糖基化[poly(ADP-ribosyl)ation]的重要调节酶[1],细胞内PAR通常由PARP利用烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)合成,然后被PARG迅速降解为腺苷二磷酸核糖。在心力衰竭、脑缺血再灌注及神经元兴奋毒性损伤等过程中,都发现PARP过度激活,PAR合成增加,伴有NAD耗竭,细胞死亡信号激活,炎症因子表达等,最终发生细胞死亡[2-5]。
癫痫发作可引起海马神经元死亡及炎症反应,而癫痫发作的反复发生也很可能与之有关[6]。我们发现,癫痫大鼠海马组织中PARP被过度活化,并通过激活凋亡诱导因子(apoptosis-inducing factor,AIF)及炎症因子等造成神经元损伤[4-5]。近来研究提示,PARG参与调节PAR代谢,抑制PARG活性可减少NAD+消耗,减少炎症因子表达和细胞凋亡,具有一定的神经保护作用[7-8]。但到目前为止,PARG是否参与癫痫发作引起的神经元损伤仍未见报道,相关分子机制亦不清楚。本研究将应用海藻氨酸(kainic acid,KA)诱发的癫痫大鼠模型,探讨PARG与癫痫后海马神经元损伤及AIF、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)表达的关系。
材料和方法
1 材料
成年雄性Wistar大鼠,质量(250±50)g,由山东大学实验动物中心提供。KA、PARP抑制剂3-氨基苯甲酰胺(3-aminobenzamide,3-AB)和 PARG抑制剂单宁酸(gallotannin,GT)购自 Sigma,抗 PAR多克隆抗体购自Alexis Biochemichals,抗AIF单克隆抗体、抗TNF-α单克隆抗体、抗IL-1β多克隆抗体、抗β-actin单克隆抗体、抗组蛋白H1单克隆抗体和HRP标记Ⅱ抗购自Santa Cruz,细胞色素C氧化酶IV亚基(cytochrome C oxidase subunit IV,COX-IV)多克隆抗体购自Biovision。
2 动物模型的制作
腹腔注射苯巴比妥钠(50 mg/kg)麻醉实验大鼠,在立体定位仪上,用微量注射器将KA(0.5 μg溶于1 μL生理盐水中)缓慢注射入大鼠侧脑室(前囟后0.85 mm,侧旁 1.5 mm,深 4.3 mm),应用脑电图机描记颞叶(前囟后4 mm,左、右侧旁 2 mm)脑电,并观察大鼠行为变化。对照组采用等量生理盐水代替KA。药物干预组大鼠在注射KA 30 min前后都给予腹腔注射3-AB 40 mg/kg或单宁酸30 mg/kg。对照组亦采用等量生理盐水代替相应药物。
3 动物分组
实验(一):癫痫发作后PAR表达的研究,24只大鼠随机分为对照组、KA致痫6 h组(KA 6h)、KA致痫+3-氨基苯甲酰胺干预组(KA+3-AB)、KA致痫+单宁酸干预组(KA+GT);实验(二):单宁酸对癫痫后海马神经元保护的研究,18只大鼠随机分为对照组、KA致痫72 h组(KA 72h)、KA致痫+单宁酸干预组(KA+GT);实验(三):单宁酸调节AIF的研究,18只大鼠随机分为对照组、KA致痫24 h组(KA 24h)、KA致痫+单宁酸干预组(KA+GT);实验(四):单宁酸调节炎症因子表达的研究,18只大鼠随机分为对照组、KA致痫24 h组(KA 24h)、KA致痫+单宁酸干预组(KA+GT)。
4 大鼠海马组织Nissl染色及组织学分析
大鼠经10%水合氯醛腹腔麻醉,4%多聚甲醛灌注固定后取脑。组织浸蜡包埋,连续冠状切片,切片厚度为10 μm,保存备用。石蜡切片脱蜡至水,1%甲苯胺蓝室温下染色,乙醇分色,二甲苯透明,中性树胶封片。在 Olympus显微镜下,观察大鼠海马CA1和CA3区神经元的形态及其分布。海马神经元计数定义为海马CA1和CA3区每0.5 mm长度锥体细胞层中神经元数目。每张切片随机观察5个视野,取其平均值。
5 海马组织蛋白提取及Western blotting
各实验组大鼠快速断头取脑,快速分离海马,缓冲液洗涤,加入细胞裂解液,冰上孵育,离心后弃上清;沉淀中加入裂解缓冲液,冰浴充分研磨,静置离心;或于沉淀中加入细胞核裂解液或线粒体分离介质,冰上孵育后离心,上清为核蛋白提取液,沉淀物为线粒体蛋白。加入蛋白上样液,沸水煮,-20℃冰箱保存备用。聚丙烯酰胺凝胶电泳,分别配置不同浓度的分离胶和浓缩胶,加入电泳缓冲液,将40 μg蛋白质样品加入样品孔的底部,在恒压下电泳约60 min;将电泳凝胶、硝酸纤维素膜、滤纸置于转膜槽,于恒流中电转2 h;将硝酸纤维素膜放入浓度为5%脱脂牛奶中,室温振荡2 h;洗涤后,将硝酸纤维素膜放入合理稀释后的Ⅰ抗溶液中4℃过夜;洗涤后,将硝酸纤维素膜放入合理稀释后的Ⅱ抗溶液中室温振荡1 h;洗涤后,将化学发光液试剂均匀涂于硝酸纤维素膜,放入X光片夹中于暗室曝光;将X光片显影、定影;应用数字凝胶成像系统拍照,将目的蛋白条带的灰度值与内参照的灰度值做比较,计算相对灰度值。
6 统计学处理
结 果
1 实验大鼠行为学和脑电图变化
对照组大鼠术后无抽搐发作行为,KA致痫各组在注射KA 15 min内出现咀嚼、点头等面颈部肌肉的抽搐及单侧或双侧前肢、后肢阵挛样运动。对照组大鼠脑电图表现为基础波,KA致痫大鼠脑电图描记到阵发性或丛集性高幅多棘、多尖波。单宁酸干预组大鼠与KA致痫组大鼠行为学及脑电图未表现出明显差别,见图1。

Figure 1.Features of electroencephalogram in different experimental rats.A:slow waves in control group rats;B:rapid waves with high frequency charges in KA treatment rats;C:rapid waves with high frequency charges in gallotannin and KA treatment rats.图1 各组实验大鼠脑电图特征
2 PARG调节癫痫大鼠PAR表达
对照组大鼠海马组织核蛋白中PAR表达较低(0.04±0.01),KA致痫6 h组大鼠海马组织中的PAR表达显著增加(0.24±0.03)(P<0.05);PARP抑制剂3-AB干预组中PAR表达减少(0.13±0.02),PARG抑制剂单宁酸干预组中 PAR水平(0.36±0.04)显著增高(P <0.05),见图2。
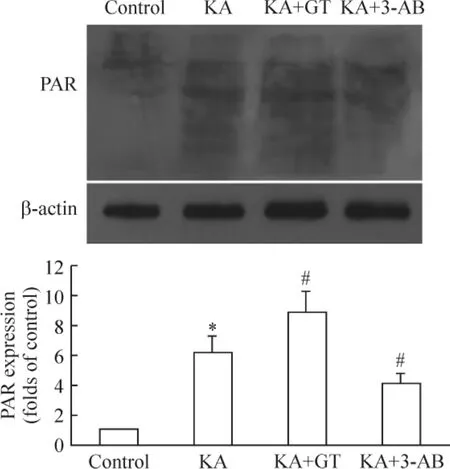
Figure 2.Effect of gallotannin(GT)on PAR expression in rat hippocampus after seizures.±s.n=6.*P<0.05 vs control;#P<0.05 vs KA.图2 单宁酸对癫痫发作大鼠海马PAR表达的影响
3 抑制PARG减轻癫痫大鼠海马神经元损伤
Nissl染色显示,海马CA1和CA3区锥体神经元存活数目KA致痫72 h组(46.13±5.12和63.34±8.11)较对照组(86.25±8.67和125.36±13.74)明显减少(P<0.05)。KA+GT干预组(67.75±7.58和95.84±10.92)存活神经元数目较KA致痫组显著增加(P<0.05),见图3。
4 抑制PARG减少癫痫大鼠海马线粒体AIF的核转位
对照组大鼠海马组织核蛋白中仅可检测到微弱的AIF表达(0.09±0.02),KA致痫24 h组大鼠海马组织核蛋白中的AIF的含量明显增加(0.69±0.11,P<0.05),单宁酸干预以后,核蛋白中AIF含量显著减少(0.35±0.08);与之对应,KA致痫24 h组大鼠海马组织线粒体蛋白中的AIF的含量(0.31±0.06)较对照组(1.12±0.14)减少(P<0.05),单宁酸干预以后,线粒体蛋白中 AIF含量(0.76±0.11)较KA致痫24 h组增加(P<0.05),见图4。

Figure 3.Gallotannin attenuated hippocampal cell death after seizures(Nissl staining,× 200).A,C,E:CA3 subfield;B,D,F:CA1 subfield.A,B:control;C,D:KA;E,F:KA+GT.图3 单宁酸减少癫痫大鼠海马神经元的死亡

Figure 4.Effect of GT on AIF translocation from mitochondria to nucleus in hippocampus after seizures.±s.n=6.*P<0.05 vs control;#P<0.05 vs KA.图4 单宁酸对癫痫大鼠海马线粒体AIF细胞核转位的作用
5 抑制PARG减少癫痫大鼠海马组织中IL-1β和TNF-α蛋白的表达
对照组大鼠海马组织中仅有较弱的IL-1β和TNF-α蛋白表达(0.12±0.02和0.17±0.02),KA致痫24 h组大鼠海马中的IL-1β和TNF-α蛋白的表达(0.95±0.11和0.93±0.13)明显增加(P<0.05);单宁酸干预后,IL-1β和TNF-α蛋白表达(0.45±0.07和0.39±0.07)明显降低(P<0.05),见图5。
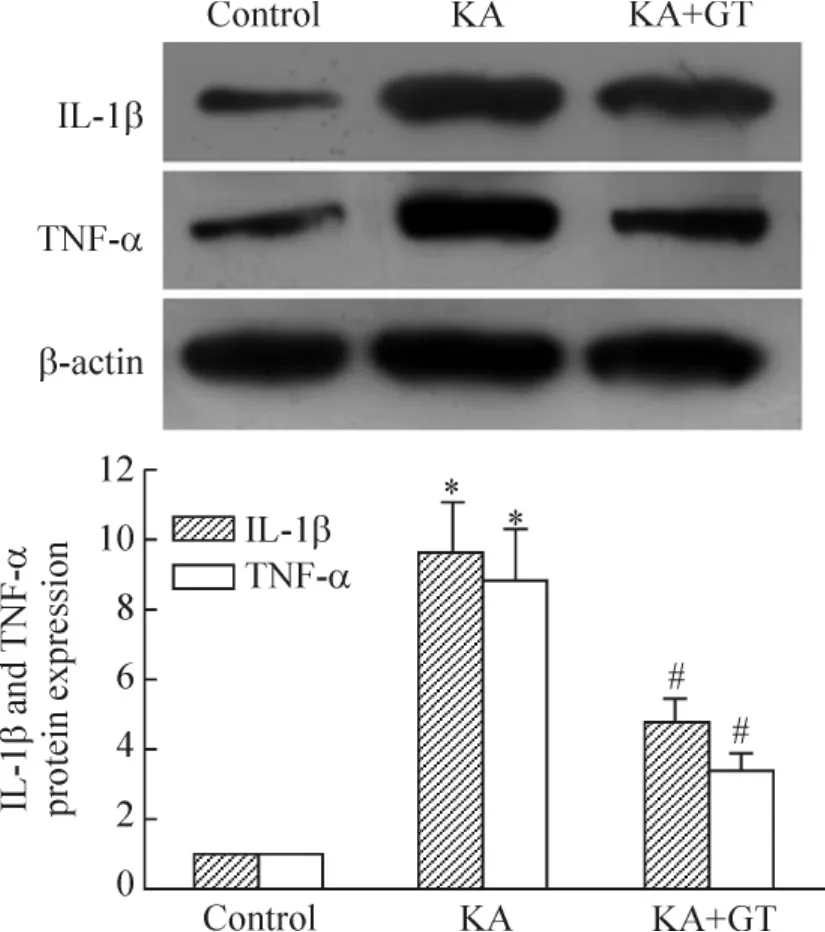
Figure 5.Effect of GT on IL-1β and TNF-α protein expression in hippocampus after seizures.±s.n=6.*P<0.05 vs control;#P<0.05 vs KA.图5 单宁酸对癫痫大鼠海马IL-1β与TNF-α表达的作用
讨 论
聚腺苷二磷酸核糖基化是细胞内一种重要的蛋白修饰方式,PARP催化合成不同分子量的PAR以共价键方式与靶蛋白结合,参与DNA修复、细胞凋亡、炎症反应等生理过程[1]。目前,PARP介导的细胞死亡也被称为parthanatos(PARP-1-mediated cell death),被认为是不同于坏死、凋亡、自嗜的细胞死亡形式,它与AIF从线粒体释放移位到细胞核有关[9]。我们先前的研究也证实了调节AIF信号通路是PARP抑制剂在癫痫致神经损伤过程中发挥保护作用的重要机制之一[5]。目前,PAR被认为是调节parthanatos的重要信号分子,在细胞核内合成的PAR可转移到细胞浆作用于线粒体从而诱发AIF的释放。最新研究发现,AIF蛋白本身不仅含有DNA结合位点,还含有PAR结合的特异性位点,若PAR结合位点丧失,AIF蛋白则不再被PARP调节[10]。
PARG在细胞中存在110 kD和60 kD 2种异构体,前者主要表达于细胞核,与PARG活性关系密切[11]。研究发现,抑制PARG活性具有一定的细胞保护作用,这很可能与减慢细胞PAR降解速度,减少细胞能量消耗有关[8]。此外,PARG还参与调节细胞内钙离子水平,而细胞内钙信号与AIF介导的细胞死亡密切相关[1]。最新的研究发现,PARG可调节瞬时受体电位通道2引起的细胞钙超载及AIF介导的细胞死亡[12]。抑制PARG能降低细胞内二磷酸腺苷核糖水平,阻断瞬时受体电位通道2介导的细胞钙信号及AIF核转位,最终减轻细胞的损伤[12]。不过也有研究发现,细胞敲除PARG基因后,DNA损伤加重,在紫外线损伤下发生 AIF介导的细胞死亡[13]。本研究提示,PARG抑制剂单宁酸可显著减轻癫痫发作造成的大鼠海马神经元损伤,而且单宁酸的神经保护作用部分与阻断AIF信号通路有关。
癫痫发作可引起脑组织出现明显的炎症反应,脑内注射针对IL-1β受体拮抗剂表现出明显的抗惊厥及神经元保护作用,炎症因子被认为与癫痫的发生频率、神经元存活及胶质细胞增生关系密切[6,14]。研究已证实,PARP 可调节 IL-1β、TNF-α等核转录因子κB依赖性的基因转录[2]。我们的研究也发现,抑制PARP活性可减少癫痫大鼠海马组织核转录因子κB相关的IL-1β和环氧化酶2的表达[4]。另外,研究也提示PARG参与调节炎症反应,在脊髓损伤中,抑制PARG可抑制白细胞浸润及多种炎症因子的表达[7]。PARG抑制剂单宁酸可调节激活蛋白1及分裂原活化蛋白激酶介导的炎症信号[15]。本研究也提示,单宁酸可调节癫痫大鼠海马组织IL-1β、TNF-α表达,这很可能也是其发挥神经保护作用的重要机制之一。
总之,本研究发现,PARG参与大鼠癫痫致神经元损伤过程,单宁酸可明显减轻癫痫后大鼠海马神经元损伤,参与调节AIF由线粒体向细胞核的转位及IL-1β、TNF-α的表达,提示PARG很可能是参与癫痫致神经元损伤的重要机制之一。
[1] Malanga M,Althaus FR.The role of poly(ADP-ribose)in the DNA damage signaling network[J].Biochem Cell Biol,2005,83(3):354-364.
[2] Kauppinen TM.Multiple roles for poly(ADP-ribose)polymerase-1 in neurological disease[J].Neurochem Int,2007,50(7-8):954-958.
[3] 朱铁年,赵瑞景,凌亦凌.多聚(ADP-核糖)聚合酶与细胞损伤[J].中国病理生理杂志,2002,18(1):104-107.
[4] 王胜军,迟兆富,王树华,等.PARP调节癫痫大鼠海马转录因子κB及相关炎症因子的表达[J].中国病理生理杂志,2010,26(1):86-90.
[5] Wang SJ,Wang SH,Song ZF,et al.Poly(ADP-ribose)polymerase inhibitor is neuroprotective in epileptic rat via apoptosis inducing factor and Akt signaling[J].Neuroreport,2007,18(12):1285-1289.
[6] Vezzani A,Moneta D,Richichi C,et al.Functional role of inflammatory cytokines and antiinflammatory molecules in seizures and epileptogenesis[J].Epilepsia,2002,43(Suppl 5):30-35.
[7] Cuzzocrea S,Genovese T,Mazzon E,et al.Poly(ADP-ribose)glycohydrolase activity mediates post-traumatic inflammatory reaction after experimental spinal cord trauma[J].J Pharmacol Exp Ther,2006,319(1):127-138.
[8] Lu XC,Massuda E,Lin Q,et al.Post-treatment with a novel PARG inhibitor reduces infarct in cerebral ischemia in the rat[J].Brain Res,2003,978(1-2):99-103.
[9] Wang Y,Dawson VL,Dawson TM.Poly(ADP-ribose)signals to mitochondrial AIF:a key event in parthanatos[J].Exp Neurol,2009,218(2):193-202.
[10] Wang Y,Kim NS,Haince JF,et al.Poly(ADP-ribose)(PAR)binding to apoptosis-inducing factor is critical for PAR polymerase-1-dependent cell death(parthanatos)[J].Sci Signal,2011,4(167):ra20.
[11] Cortes U,Tong WM,Coyle DL,et al.Depletion of the 110-kilodalton isoform of poly(ADP-ribose)glycohydrolase increases sensitivity to genotoxic and endotoxic stress in mice[J].Mol Cell Biol,2004,24(16):7163-7178.
[12] Blenn C,Wyrsch P,Bader J,et al.Poly(ADP-ribose)glycohydrolase is an upstream regulator of Ca2+fluxes in oxidative cell death[J].Cell Mol Life Sci,2011,68(8):1455-1466.
[13] Zhou Y,Feng X,Koh DW.Activation of cell death mediated by apoptosis-inducing factor due to the absence of poly(ADP-ribose)glycohydrolase[J].Biochemistry,2011,50(14):2850-2859.
[14] Turrin NP,Rivest S.Innate immune reaction in response to seizures:implications for the neuropathology associated with epilepsy[J].Neurobiol Dis,2004,16(2):321-334.
[15] Erdèlyi K,Kiss A,Bakondi E,et al.Gallotannin inhibits the expression of chemokines and inflammatory cytokines in A549 cells[J].Mol Pharmacol,2005,68(3):895-904.

