BMSC向神经细胞分化诱导后上清液对MCI大鼠治疗作用的实验研究
郭 樑,张 轶,李光来
阿尔茨海默病(Alzheimer’s disease,AD),是一种神经退行性疾病,是痴呆病中最常见的类型。目前尚无公认有效的治疗方法。轻度认知功能障碍(mild cognitive impairment,MCI)[1]是痴呆的临床前期,是介于正常衰老和痴呆之间的一种认知功能损害状态[2]。抑制甚至逆转MCI过程,成为预防并控制AD研究热点。已有研究通过体内外干预实验,发现一定浓度、时段骨髓间充质干细胞(BMSC)向神经细胞诱导后上清液可以显著激活脑损伤后自体神经前体细胞(NPCs)增殖和分化,说明BMSC上清液可部分启动内源性修复机制,从而在某种程度上促进脑损伤的功能康复。本文旨在探索不同代次BMSC向神经细胞分化诱导后上清液对认知功能障碍大鼠是否有治疗作用以及各代次之间是否有差别。
1 材料与方法
1.1 材料 Wistar大鼠(山西医科大学生理实验室)、DMEM/low(Hyclone)、胎牛血清(杭州四季)、PBS磷酸盐缓冲液、碱性成纤维细胞生长因子(bFGF,PeproTech)、4%多聚甲醛、鼠免疫组化试剂盒(美国ZYMED公司)、DAB、显色试剂盒(北京博奥森生物技术有限公司)、倒置显微镜、5%CO2培养箱、流式细胞仪等。
1.2 大鼠BMSC的分离、培养和鉴定 BMSC采用全骨髓贴壁培养法,将细胞置于5%CO2,37℃细胞培养箱内,待细胞生长融合至70%~85%时传代。取第3代的BMSC,按105/mL水平分5管分别加入F ITC标记的小鼠抗大鼠CD29、CD44和CD45抗体,同型F ITC标记的对照IgG以及空白对照,经流式细胞仪检测。
1.3 细胞爬片和诱导 分别取第3代、4代、5代BMSC,按105/mL浓度接种于铺有盖玻片的六孔板内,加入含1mmol/L βME和20%胎牛血清的L-DMEM培养基进行预诱导。24h后弃预诱导液。加入bFGF 20ng/mL和10%胎牛血清。免疫细胞化学鉴定:取诱导后24h细胞爬片,PBS洗3次,4%多聚甲醛固定30min;PBS冲洗3次,3%H2O237℃孵育15min消除内源性过氧化物酶活性;PBS冲洗3次,山羊血清室温封闭10min,弃血清后分别加入兔抗大鼠NSE、GFAP抗体,4℃过夜;PBS洗3次后加入生物素标记的二抗,室温下孵育30min;PBS冲洗3次,滴加辣根过氧化物酶标记的链霉卵白素工作液,37℃孵育30min;PBS洗涤,DAB显色。阴性对照用PBS代替一抗。
1.4 实验动物的选择与处理 3个月龄大鼠10只为正常组,根据Phiel等[3]报道的Morris水迷宫测试方法进行测试,Morris水迷宫行隐蔽平台获得实验确立认知功能障碍大鼠标准:平均潜伏期较正常组延长20%以上者定义为认知功能障碍大鼠。
15个月~22个月龄大鼠Morris水迷宫行隐蔽平台获得实验筛选认知功能障碍大鼠40只(相对于人为制造认知功能障碍大鼠模型,从自然衰老大鼠中挑选认知功能障碍大鼠,或许更加符合自然规律,使实验更有意义),随机分为生理盐水对照组(对照组)及3代、4代、5代干细胞传代诱导后12h上清液治疗组并做好标记,组间大鼠认知功能障碍程度确保无统计学意义。进行行为学检测:Morris水迷宫隐蔽平台获得实验,实验方法参照刘涛等[4]进行的定位巡航实验方法进行,历时5d,前4d学习训练,采纳第5天实验数据进行记录统计。参照包新民等所著《大鼠脑立体定位图谱》,选择双侧海马CA1区为注射靶区,在严格无菌条件下,于前囟向后3.0mm,中线旁开2.2mm处,用牙科钻钻开颅骨,微量进样器自脑表面垂直进针2.8mm,将生理盐水、3代、4代、5代干细胞传代诱导后12h上清液0.5 μL/min各组缓慢注入3μL,留针10min以保证溶液充分弥散,然后缓慢撤针。皮肤切开处用青霉素涂撒,缝合切口。注射上清后4周4组大鼠再次进行行为学检测。
1.5 免疫组织化学染色测定周期蛋白依赖性激酶5(CDK5)表达程度 迷宫实验结束后各组大鼠经10%水合氯醛腹腔麻醉(3mL/kg),经左心室(同时剪开右心房)相继灌注生理盐水200 mL,40g/L多聚甲醛(4℃)400mL。快速取脑,固定24h,脑组织常规石蜡包埋,矢状连续切片,片厚4μm。周期素依赖性激酶5抗体为一抗行免疫组化染色。
2 结 果
2.1 大鼠BMSC的光镜形态与细胞鉴定 培养2周左右细胞汇合至70%~80%时传代,24h后BMSC即可贴壁生长,4d~5d可基本汇合。传至3代后,细胞呈旋涡状排列的均一梭形。流式细胞仪检测CD29、CD4 4和CD3 4的表达率为9 9.7%、99.8%和2.3%,说明所分离培养的细胞符合MSC表型特征。
2.2 诱导后细胞形态变化与免疫化学鉴定 预诱导24h,可见少量细胞逐渐向胞核方向收缩,加入bFGF后上述变化更加明显,可见突起形成。从上下左右中5个方位分别选取2个非重叠视野(10×40),计数每个视野下NSE与GFAP阳性细胞所占比例:各组细胞均有部分细胞NSE阳性,表现为胞浆呈黄棕色,阳性率为(42.50±6.40)%,GFAP染色后各诱导组出现极少量阳性细胞。
2.3 水迷宫实验 4组注射前后定位巡航实验潜伏期差值差异有统计学意义(F=56.481,P<0.001),进一步行LSD-t检验,除3代组与5代组之间的差异无统计学意义外,其他任何两组间的差异均有统计学意义(P<0.05或P<0.01),3代与5代上清液较4代效果明显。详见表1。
表1 4组注射前后定位巡航实验潜伏期差值比较(±s)

表1 4组注射前后定位巡航实验潜伏期差值比较(±s)
组别 差值对照组 0.779 7±1.813 4 3代组 71.159 1±1.055 91)4代组 53.063 7±1.659 41)2)5代组 76.726 2±1.151 21)3)与对照组比较,1)P<0.01;与3代组比较,2)P<0.05;与4代组比较,3)P<0.05
2.4 各组脑组织边缘系统CDK5表达情况 于海马齿状回从上下左右中5个方位分别选取2个非重叠视野(10×40),计算每个视野下阳性细胞(表现为胞浆呈黄棕色)所占比例,行Kruskal-Wallis检验显示,4组CDK5表达情况总体分布不同或不全相同(χ2=32.046,P<0.001),进一步应用 Wilcoxon秩和检验分别对4组行组间两两比较,除3代组与5代组间差异无统计学意义外,余各组间差异均有统计学意义,3代(平均秩和=5.50)与5代(平均秩和=5.50)上清液组较4代(平均秩和=6.00)CDK5表达阳性率低。详见表2。
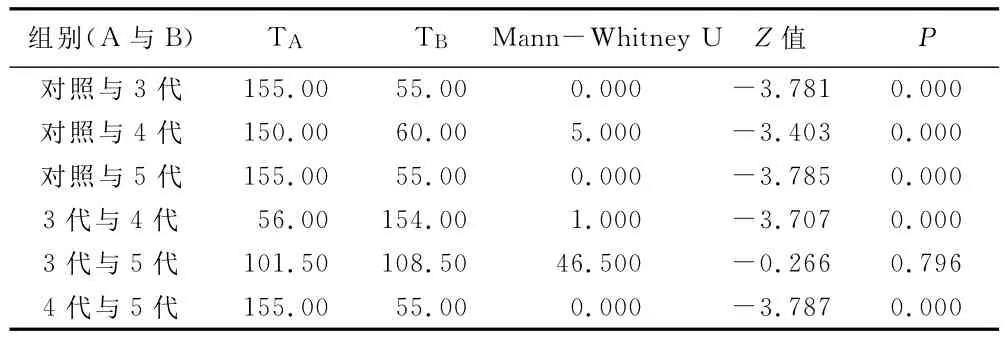
表2 4组大鼠注射上清液前后边缘系统CDK5表达两两比较
3 讨 论
阿尔茨海默病主要特征是在脑中出现非正常的蛋白质沉积,该蛋白质沉积大致可以分为两种:细胞外被称为“老年斑”的淀粉样多肽沉积;细胞内的神经纤维缠结(neurofibrillary tangles,NFT),NFT主要由双螺旋纤维(paried helical filaments,PHF)聚集而成,而研究表明病理的双螺旋纤维主要是由过度磷酸化的Tau蛋白组成[5]。Dubois等[6]认为有记忆缺失等症状的MCI是AD发展的极早期阶段,而研究表明在AD的临床前期脑内已经出现神经元纤维缠结发生[7],而磷酸化tau蛋白水平与CDK5表达呈正相关且老年痴呆大鼠皮层、海马CDK5表达明显升高[8]。通过本次试验发现,三组注射上清液的大鼠脑组织海马齿状回CDK5表达阳性率较生理盐水对照组为低,且3代与5代上清液相对明显,这应该可以在某种程度上说明,上清液的注入通过某种途径改善了紊乱的tau蛋白磷酸化调控机制。
已有研究证实不同时间诱导后上清液在骨髓间充质细胞向神经元样细胞分化中具有明显的诱导分化为神经细胞的作用[9],亦有研究通过体内干预实验,发现一定浓度BMSCs培养上清液可以显著激活脑梗死后自体NPCs增殖和分化,说明BMSCs上清液可部分启动内源性修复机制,从而在某种程度上促进脑缺血的功能康复[10],通过本次实验,证明这种效应在认知功能障碍老年性脑损伤的修复中同样起到一定作用:将3代、4代、5代BMSC向神经元样细胞诱导后12h上清液注射入大鼠海马区后1个月,大鼠行Morris水迷宫隐蔽平台获得实验潜伏期明显缩短,这表明,诱导后上清液的治疗作用对抗了手术损伤与术后自然衰老1个月对其产生的负面影响,同时对其认知功能的恢复起到了积极地促进作用,并在一定程度上避免了干细胞移植与药物治疗存在的伦理、成肿瘤风险与不良反应等暂时无法克服的问题。但是,BMSC向神经元样细胞诱导后12h上清液改善大鼠认知功能障碍的具体机制是什么;为什么不同代次上清液对大鼠认知功能障碍改善效果会有差异,特别是为什么本次实验中处于3代、5代之间的4代组效果略欠;上清液中有哪些成分,具体是何物质对认知功能障碍的改善起作用;上清液对MCI的治疗有何不良反应等,尚需行进一步探讨研究。
[1]Petersen RC,Smith GE,Waring SC,etal.Mild cognitive impairment clinical characterization and outcome[J].Arch Neurol,1999,56(6):303.
[2]McKelvey R,Bergman H,Stern J.Lack of prognostic significance of SPECT abnormalities in elderly subjects with a mild memory loss[J].Can J Neurol Sci,1999,26:23-28.
[3]Phiel CJ,Wilson CA,Lee VM,etal.GSK-3alpha reguiates production of Alzheimer’s disease amyloid beta peptides[J].Nature,2003,423(6938):435-439.
[4]刘涛,李义松,冯丽谦,等.老年性痴呆大鼠模型的研制[J].中华中医药学刊,2009,25(12):2515-2517.
[5]Grundkeiqbal I,Iqbal K,Quinlan MT,etal.Microtubule-associated protein tau.A component of Alzheimer paired helical filaments[J].J Biol Chem,1986,261:6084-6089.
[6]Bruno D,Martin LA.Amnestic MCI or prodromal Alzheimer’s disease[J].The Lancet Neurology,2010(4):1474.
[7]McGeer PL,Schulzer M,McGeer GE.Arthritis and anti-inflammatory agents as possible protective factors for Alzheimer’s disease:A review of 17epidemiologic studies[J].Neurology,1996,47(2):425-432.
[8]陆文惠,屈秋民,曹红梅.锂对慢性铝暴露大鼠脑内CDK5和PP2A表达的影响[J].西安交通大学学报(医学版),2010(4):463-466.
[9]王飞,冯鹏,李光来.不同时间诱导后上清液在骨髓间充质细胞向神经元样细胞分化中的作用[J].中西医结合心脑血管病杂志,2008,6(3):306.
[10]冯鹏,李光来,王飞.骨髓间充质干细胞上清液治疗大鼠脑缺血的作用机制[J].中西医结合心脑血管病杂志,2008,6(3):292.

