黄连解毒汤对脓毒症大鼠的心脏保护作用1)
黄 鑫,郭力恒,马世玉,张敏州,王 磊
脓毒症是临床上常见的急危重症并发症,其发展所致的重度脓毒症、脓毒症休克、器官功能障碍综合征(MODS)等死亡率很高,是目前ICU中的主要死亡原因。虽然近年来对脓毒症及MODS的认识和治疗研究有了很大进展,但MODS的病死率仍没有明显改善,发病机制仍不清楚,很多研究人员致力于寻找降低器官功能衰竭发生率和严重程度,阻止脓毒症向脓毒性休克和MODS发生的治疗措施。研究发现,脓毒血症、伴有脏器功能衰竭的重度脓毒血症或脓毒性休克病人常常出现不同程度的心功能障碍或心力衰竭,而心功能障碍又是脓毒血症病情加重及影响预后的重要因素[1,2]。本研究尝试从心脏角度探讨清热解毒方剂黄连解毒汤对脓毒症后心肌的保护作用,为寻找中医药防治脓毒症心功能障碍提供参考依据。
1 材料与方法
1.1 药物与试剂 清热解毒方剂黄连解毒汤组方:黄连10g,黄芩10g,黄柏10g,栀子10g,大黄10g。中药经水提取,浓缩为含生药0.75g/mL作为高剂量,用蒸馏水稀释,调整浓度为含生药0.25g/mL作为低剂量。按人鼠剂量比1∶6.3灌胃,即100g大鼠灌胃量为1.5mL,密封包装,放入冰箱备用。
1.2 实验动物 SPF级雄性SD大鼠50只,体重为(220±10)g,广东省医学实验动物中心提供。实验动物合格证号:粤监证字0083834;动物实验环境设施合格证号:粤监证字0056182。
1.3 仪器 BIOPAC sYSTEMS(MP150型)16道生理系统记录仪(美国),正置荧光显微镜(奥林巴斯BX53),Anke TDL-5-A低温离心机、LIBROR AEU-210型电子分析天平、DT-1TB电子体温计(上海医用仪表厂)等。
1.4 盲肠结扎穿孔法制备脓毒症大鼠模型 参照文献[3]中设计的大鼠盲肠结扎穿孔(CLP)方法复制脓毒症模型。大鼠术前禁食12h、自由饮水,称体重后10%水合氯醛(0.35mL/100g)进行腹腔注射麻醉,在无菌操作条件下取中下腹部正中切口2 cm,将盲肠提出,用4号丝线在盲肠中段结扎,用18G针头在结扎部位与盲肠末端的中段对穿两孔,使肠内容物流出,然后将盲肠还纳腹腔后逐层关腹。术毕动物皮下注射平衡液50mL/kg行液体复苏,喂食同术前。
1.5 实验分组与给药 50只大鼠随机分为假手术组、模型组和黄连解毒汤组。假手术组除不结扎和穿刺盲肠,余同模型组;模型组采用盲肠结扎并穿刺法造模,术前1h给予注射生理盐水(10mL/kg)灌胃;黄连解毒汤组术前1h灌胃黄连解毒汤1.5mL/100g。
1.6 检测指标 每天观察记录大鼠的生存状态(精神状态、饮食、体重等),观察记录大鼠生存时间。内眦静脉丛采血法分别在术前、术后收集血液,离心(3 000r/min,4℃,7min)后,免疫化学发光法检测血清肌酸激酶(CK)及其同工酶(CK-MB)水平,ELISA检测血液中肿瘤坏死因子(TNF-α)水平。采血后留取左室心肌标本,用10%甲醛固定,进行病理切片并行HE染色后在光学显微镜下观察心肌组织病理改变。
2 结 果
2.1 大鼠生存周期的观察 大鼠在CLP造模后出现寒战、竖毛、嗜睡、活动减少、饮食减少等脓毒症的表现,证明造模成功。72h内假手术组大鼠无死亡;模型组24h死亡数量显著增加,72h后仅余2只存活;黄连解毒汤组24h死亡7只,72h后仍有8只存活。与模型组比较,72h内黄连解毒汤组生存周期延长(P<0.05)。详见表1。
表1 各组生存周期比较(±s)
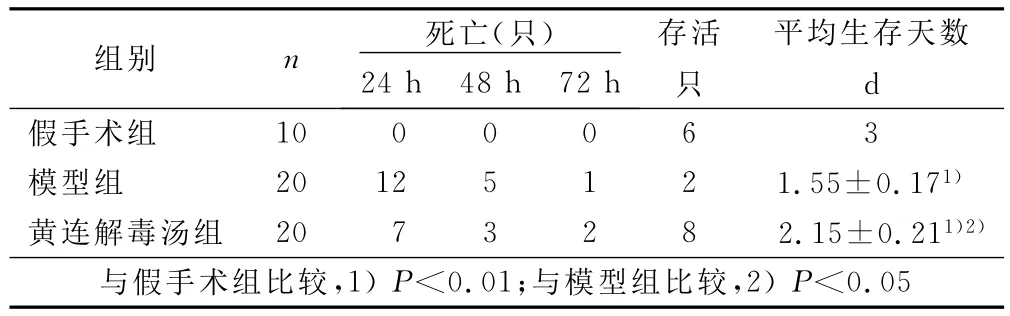
表1 各组生存周期比较(±s)
组别 n 死亡(只)24h48h72h存活只平均生存天数d假手术组10 0 0 0 6 3模型组 20 12 5 1 2 1.55±0.171)黄连解毒汤组 20 7 3 2 8 2.15±0.211)2)与假手术组比较,1)P<0.01;与模型组比较,2)P<0.05
2.2 各组大鼠呼吸、心率和体温的变化 在造模后,分别检测各组大鼠的呼吸、心率和体温。结果显示,模型组和黄连解毒汤组大鼠体温升高,呼吸频率、心率增快,与假手术组比较差异有统计学意义(P<0.01)。与模型组相比,黄连解毒汤组大鼠体温下降,呼吸频率、心率减慢,差异有统计学意义(P<0.01)。详见表2。
表2 各组大鼠心率、呼吸、体温比较(±s)
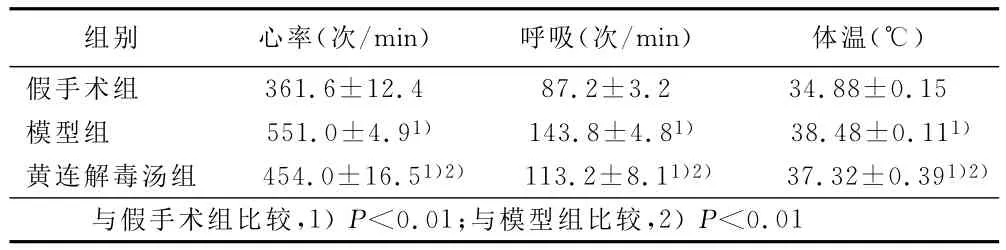
表2 各组大鼠心率、呼吸、体温比较(±s)
组别 心率(次/min) 呼吸(次/min) 体温(℃)假手术组361.6±12.4 87.2±3.2 34.88±0.15模型组 551.0±4.91) 143.8±4.81) 38.48±0.111)黄连解毒汤组 454.0±16.51)2) 113.2±8.11)2) 37.32±0.391)2)与假手术组比较,1)P<0.01;与模型组比较,2)P<0.01
2.3 各组大鼠血清CK、CK-MB水平检测 模型组和黄连解毒汤组大鼠的CK和CK-MB水平均有所上升,与假手术组比较差异有统计学意义(P<0.01)。与模型组相比,黄连解毒汤组大鼠CK和CK-MB水平有所下降,差异有统计学意义(P<0.05)。详见表3。
2.4 各组大鼠血清TNF-α水平检测 模型组和黄连解毒汤组大鼠的TNF-α水平有所增加,与假手术组比较,差异有统计学意义(P<0.01),与模型组相比,黄连解毒汤组大鼠TNF-α水平有所下降(P<0.05)。详见表3。
表3 各组大鼠血清心肌酶和TNF-α水平比较(±s)
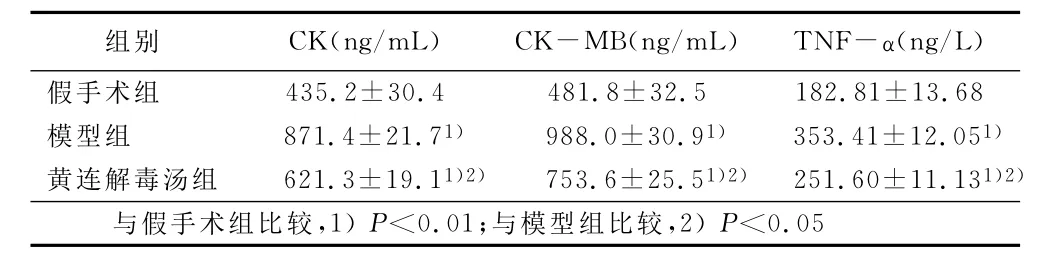
表3 各组大鼠血清心肌酶和TNF-α水平比较(±s)
组别 CK(ng/mL) CK-MB(ng/mL) TNF-α(ng/L)假手术组435.2±30.4 481.8±32.5 182.81±13.68模型组 871.4±21.71) 988.0±30.91) 353.41±12.051)黄连解毒汤组 621.3±19.11)2) 753.6±25.51)2) 251.60±11.131)2)与假手术组比较,1)P<0.01;与模型组比较,2)P<0.05
2.5 大鼠心肌组织形态学变化 假手术组心脏标本心肌细胞无变性坏死,心肌横纹清晰,未见炎症细胞浸润;模型组心脏标本可见灶性心肌纤维断裂,心肌细胞有颗粒样变性、空泡变性和凝固性坏死,冠状动脉内明显充血;黄连解毒汤组虽可见上述病理改变,但程度有所减轻。
3 讨 论
脓毒症被定义为感染诱发的全身炎症反应[4],是临床常见的急危重疾病之一。美国每年有75万的脓毒症患者,约有21.5万人死亡[5]。我国10家外科ICU一年严重脓毒症的发病率为8.68%,住院期间总死亡率为48.7%,平均每个病人住院费用约11 000美元[6]。近年来,尽管早期积极抗感染、液体复苏和器官支持等治疗方法的应用,但脓毒症总体死亡率并没有明显下降。中医药治疗感染性疾病有丰富的临床经验,在这个伟大的宝库中寻找新的脓毒症的防治方法被寄予厚望。
从症状表现和演变过程来看,脓毒症与《伤寒论》和《温病》中所论述的温热病有诸多相似之处,故脓毒症属于中医学“热病”范畴。黄连解毒汤是清热解毒方中的经典方剂,该方由黄连、黄芩、黄柏、栀子组成,具有泻火解毒之功效,是历代清热解毒的代表方,主治实热火毒、三焦热盛之证。翁书和等[7]用以黄连解毒汤加减方治疗MODS大鼠模型,结果显示黄连解毒汤对MODS大鼠的脏器有明显保护作用,并且可以明显延长MODS大鼠的存活时间,其机制可能与抑制或清除有害炎症介质及肠道细菌和毒素有关。
盲肠结扎穿孔(CLP)法制备脓毒症动物模型与临床上患者脓毒症的发病极为相似,是制作脓毒症、感染性休克及 MODS模型的常用方法之一。本试验中发现,模型组大鼠在造模后出现寒战、竖毛、嗜睡、活动减少、饮食减少,并且出现体温升高、呼吸频率、心率增快等脓毒症的表现,其72h后只有2只大鼠存活。将死亡大鼠进行解剖,发现腹腔有较多黄色或血色腹水,并伴有恶臭;肠管壁充血、肿胀,符合腹腔感染所致脓毒症模型。而假手术组则未见相应表现,72h后未出现死亡。黄连解毒汤组则上述症状有所减轻,72h后仍有8只大鼠存活,生存时间明显延长,差异有统计学意义(P<0.05)。提示黄连解毒汤能够减轻大鼠脓毒症表现,并延长大鼠的生存时间,与文献[7,8]报道一致。
脓毒症的死亡率与心功能密切相关,脓毒症患者一旦出现心功能障碍,死亡率将由20%上升到40%~70%,已有研究证实脓毒症可引起心肌收缩功能抑制[9]。Labugger等[10]研究发现脓毒症时心脏不仅存在功能性改变,也存在结构性损伤。心肌酶及其同工酶是反应心肌损伤的敏感指标。本实验中发现模型组血清CK和CK-MB较假手术组显著升高(P<0.01),提示脓毒症早期即发生心肌损伤。病理检查发现模型组心肌表面有点状出血,光镜下可见广泛心肌出血,毛细血管充血,炎症细胞浸润,心肌纤维断裂,证实脓毒症确实存在心肌损害。而黄连解毒汤组大鼠心肌组织病理改变有所减轻,且血清中CK和CK-MB水平较模型组有所下降(P<0.01),提示黄连解毒汤对脓毒症大鼠心脏具有保护作用。
TNF-α是脓毒症时最早释放,起关键始动作用的细胞因子,可激活细胞因子级联反应,诱发IL-1、IL-6、前列环素、一氧化氮(NO)和白三烯等合成,从而导致炎症反应失控,是炎症反应中激活细胞因子级联反应的主要介质。其浓度高低与疾病的严重程度和后果一致,TNF-α的浓度越高,脓毒症越严重,死亡率越高。本实验结果显示,脓毒症大鼠血清TNF-α水平明显增高,而黄连解毒汤可降低脓毒症大鼠的TNF-α浓度,减轻心肌细胞的炎症反应,证明黄连解毒汤对脓毒症的治疗机制可能是通过抑制炎症反应从而改善脓毒症大鼠的心功能。
黄连解毒汤有延长脓毒症大鼠的生存时间、减轻炎症因子对的心脏损伤、保护大鼠心脏功能的作用。本研究为临床应用中医药防治脓毒症提供了一条新的思路,但黄连解毒汤治疗脓毒症的心功能障碍的具体机制仍有待进一步研究。
[1]Parker MM,Natanson C,Suffredini AF,et al.Septic shock in human:Advances in the understanding of pathogenesis,cardiovascular dysfunction,and therapy[J].Ann Intern Med,1990,113:227-242.
[2]Tabbutt S.Heart failure in pediatric septic shock:Utilizing inotropic support[J].Crit Care Med,2001,29(10):231-236.
[3]Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.
[4]Dellinger RP.Surviving Sepsis Campaign:International guidelines for management of severe sepsis and septic shock[J].Intensive Care Med,2008,37:17-60.
[5]Angus DC,Linde-Zwirble WT,Lidicker J,et al.Epidemiology of severe sepsis in the United States:Analysis of incidence,outcome,and associated costs of care[J].Crit Care Med,2001,29:1303-1310.
[6]Cheng B,Xie G,Yao S,et al.Epidemiology of severe sepsis in criti-cally ill surgical patients in ten university hospitals in China[J].Crit Care Med,2007,35(11):2538-2546.
[7]翁书和,梁俊雄,丁爱民.通腑益气法对多器官功能障碍大鼠全身炎症反应的调控[J].广州中医药大学学报,2004,21(2):148-150.
[8]江汉奇.黄连解毒汤治疗全身炎症反应综合征的临床观察[J].光明中医,2009,24(3):480.
[9]Dhninaut JF,Cariou A ,Laurent I.Myocardial dysfunction in sepsis[J].Sepsis,2001,4(2):89-97.
[10]Labugger R,Organ L,Collier C,et al.Extensive troponin I and T modification detected in serum from patients with acute myocar dial infarction[J].Circulation,2000,102(11):1221-1226.

