用于微生物油脂发酵的木薯淀粉水解工艺的优化*
张志斌,颜日明,曾庆桂,汪涯,朱笃,
1(江西师范大学生命科学学院江西省亚热带植物资源保护与利用重点实验室,江西南昌,330022)
2(宜春学院江西省天然药物活性成分研究重点实验室,江西宜春,336000)
用于微生物油脂发酵的木薯淀粉水解工艺的优化*
张志斌1,颜日明1,曾庆桂1,汪涯2,朱笃1,2
1(江西师范大学生命科学学院江西省亚热带植物资源保护与利用重点实验室,江西南昌,330022)
2(宜春学院江西省天然药物活性成分研究重点实验室,江西宜春,336000)
为了提高木薯淀粉的发酵产脂能力,采用正交实验和均匀设计法对木薯淀粉酶法水解工艺进行了优化,结果表明α-淀粉酶量、糖化酶量和液化温度对木薯淀粉水解有显著影响。当淀粉酶量为756 U/g,糖化酶量为602 U/g,液化温度为92°C,其水解DE值达到97.3%。以该水解液进行皮状丝胞酵母B3(T.cutaneum B3)油脂发酵时,其生物量和油脂产量分别为16.38 g/L和7.22 g/L,比葡萄糖作为碳源的生物量和油脂产量高46.25% 和41.12%,利用木薯淀粉水解液作为新型发酵碳源生产微生物油脂是一种理想的途径。
微生物油脂,木薯淀粉水解液,正交实验设计,均匀设计,DE值
木薯为多年生植物,广泛栽培于热带和亚热带地区,是世界三大薯类之一。木薯的块根中含30%的淀粉,而木薯干含有70%的淀粉,有“淀粉之王”的美誉,并广泛应用于食品、饮料、糖果、药品及化妆品行业[1]。近些年来非粮作物在生物降解材料、生物质燃料生产方面也呈现新的应用前景[2-3]。有关利用木薯淀粉发酵生产燃料乙醇和微藻油脂有较多报道[4-6],而利用木薯淀粉发酵生产微生物油脂报道较少[7]。木薯淀粉可通过水解反应生成含有醛基和羰基的淀粉糖,如葡萄糖、麦芽糖和低聚糖等,这些淀粉糖可作为一种廉价的碳源应用于微生物发酵生产中。
目前,木薯淀粉制糖工业生产中,淀粉的水解度较低,维持在40%~45%范围之内,导致生产能耗高,成本高[8]。减少高温耗能,降低水解成本是木薯淀粉生产行业工业化亟待解决的问题。淀粉水解液工业方法已有很多,如酸法、酸酶法、全酶法等。而有关木薯淀粉水解的研究主要集中在单酶酶解方面。为了提高液化、糖化效率,袁建微等采用机械活化结合酶法进行木薯淀粉糖化,最终使得木薯淀粉的水解度提高到64.41%[9];魏爱丽等研究了中温α-淀粉酶水解木薯淀粉的工艺条件研究,确定了中温α-淀粉酶水解木薯淀粉的最佳工艺条件,葡萄糖糖得率是46.94%[10]。而双酶协同水解木薯淀粉工艺也有研究报道,但其水解率仅为50%[11]。本课题选用α-淀粉酶和糖化酶协同酶解木薯淀粉,通过均匀设计优化两种酶的酶解条件来提高水解率,并观察木薯淀粉水解液替代葡萄糖培养皮状丝胞酵母B3(T.cutaneum B3)对其生物量和油脂积累的影响,为寻找廉价替代碳源、降低微生物油脂发酵生产成本提供依据。
1 材料与方法
1.1 实验材料
木薯淀粉(100目过筛),由江西宜丰木薯加工厂提供;α-淀粉酶(50000 u/g),购自连云港华瑞化工有限责任公司,糖化酶(100000 U/g),购自无锡市雪梅酶制剂科技有限公司。
T.cutaneum B3由本实验室筛选并经诱变选育而得。
1.2 培养基
固体培养基:葡萄糖40 g/L,酵母提取物1.0 g/L,NH4NO30.5 g/L,KH2PO40.75 g/L,CaCl2·2H2O 0.4 g/L,MgSO4·7H2O 0.4 g/L,琼脂 20 g/L,pH 6.0。
种子培养基:葡萄糖40 g/L,酵母提取物1.0 g/L,NH4NO30.5 g/L,KH2PO40.75 g/L,CaCl2·2H2O 0.4 g/L,MgSO4·7H2O 0.4 g/L,初始 pH 6.0。
摇瓶发酵培养基:碳源,不同浓度葡萄糖或木薯淀粉水解液(其浓度以其含还原糖浓度计),酵母提取物 1.0 g/L,NH4NO30.5 g/L,KH2PO40.75 g/L,CaCl2·2H2O 0.4 g/L,MgSO4·7H2O 0.4 g/L,初始pH 6.0。
1.3 实验方法
1.3.1 种子液的制备
将活化的菌种从斜面培养基中挑取适量,接入含有50 mL种子液培养基的250 mL三角瓶中,在摇床上培养24 h,温度28℃,转速150 r/min。
1.3.2 发酵产脂培养
将种子液按5%的接种量转接于含有80 mL发酵液的250 mL三角瓶中,进行摇瓶振荡培养,温度28℃,转速150 r/min。
1.3.3 木薯淀粉水解工艺实验设计
木薯淀粉水解液制备主要包括液化和糖化两个独立过程,因此利用正交试验分别研究不同因素对这两个过程的影响,实验所选的水解淀粉浓度为20%。
1.3.3.1 木薯淀粉液化正交试验设计
采用L9(34)正交实验表来考察α-淀粉酶量、液化时间、液化温度等3个因素对木薯淀粉液化的影响,以相对黏度(ηr)为考核指标,ηr越小,说明液化越彻底,实验的因素水平见表1。

表1 木薯淀粉液化正交试验因素水平表
1.3.3.2 木薯淀粉糖化正交试验设计
采用L9(34)正交实验表来考察糖化酶量、糖化时间、糖化温度等3个因素对木薯淀粉糖化的影响,以还原糖含量(DE)为考核指标:
DE/%=(还原糖浓度/总糖浓度)×100
DE越大,说明糖化越完全。实验的因素水平见表2。
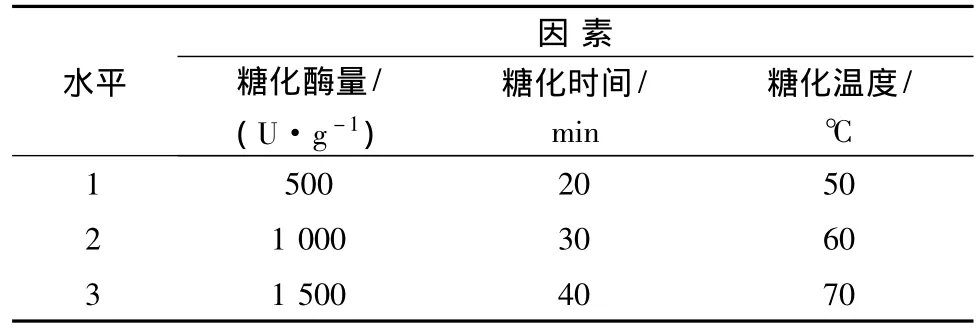
表2 木薯淀粉糖化正交试验因素水平表
1.3.3.3 均匀设计试验
根据木薯淀粉液化和糖化正交试验结果,以DE值为指标,选择淀粉酶量浓度X1、糖化酶量浓度X2、液化温度X33个因素进行进一步的均匀实验,每个因素取8个水平,采用U8*(85)均匀表[12]进行参数优化试验,试验结果采用SPSS 17.0软件进行统计分析。
1.3.4 淀粉水解液相对黏度测定
将乌氏黏度计垂直固定于(25±0.5)℃恒温水槽中,将不同液化条件下的淀粉水解液稀释20倍,测出其在乌氏黏度计中的流出时间(t),重复测量几次,直到3次读数偏差不超过0.2 s,取t的平均值。以1.0%木薯淀粉溶液为参照,按式(1)计算相对黏度[13]:

式(1)中,ηr表示相对黏度;t和t0分别表示木薯淀粉水解液和木薯淀粉溶液的流出时间(s)。
1.3.5 生物量的测定
通过4000 r/min离心10 min,收集沉淀并蒸馏水洗涤菌体1~2次,60℃烘至恒重,准确称重。
1.3.6 还原糖检测方法
采用 DNS 法(3,5-二硝基水杨酸法)[14]。
1.3.7 微生物油脂的提取
油脂提取及测定:采用索氏提取法。将烘干后的菌体研成粉末后装入索氏提取器,石油醚加热回流提取8 h,旋转蒸发去除石油醚,真空干燥至恒重即得油脂,称重[15]。
2 结果与分析
2.1 木薯淀粉液化工艺优化结果
木薯淀粉液化工艺优化的正交试验结果及方差分析分别见表3和表4。可以看到,α-淀粉酶量和液化温度对木薯淀粉的液化有显著影响。初步实验表明,在给定范围内,随着α-淀粉酶量的增加,淀粉液化程度也明显增加,表现为相对黏度的下降。液化温度偏高或偏低都对α-淀粉酶催化反应产生影响,在90℃时木薯淀粉液化比较好,而液化时间则以30 min较好(表3)。

表3 木薯淀粉液化工艺正交试验设计与结果

表4 木薯淀粉液化工艺正交试验结果方差分析
2.2 木薯淀粉糖化工艺优化结果
木薯淀粉糖化工艺优化的正交试验结果及方差分析分别见表5和表6。与液化过程不同,影响木薯淀粉糖化过程的主要因素只有糖化酶量(表6)。结果表明,在实验范围内,糖化酶量为1000 U/g时,木薯淀粉水解程度较高(表5)。而糖化温度和糖化时间对木薯淀粉的糖化没有显著影响,从经济角度考虑,糖化温度和糖化时间分别为60℃和30 min是较好的糖化工艺条件。

表5 木薯淀粉糖化工艺正交试验设计与结果

表6 木薯淀粉糖化工艺正交试验结果方差分析
2.3 木薯淀粉水解均匀设计优化结果
上述正交试验结果初步表明,α-淀粉酶量、糖化酶加量和液化温度对木薯淀粉的水解具有显著影响。为了更进一步细化木薯淀粉水解工艺,对淀粉酶加量、糖化酶加量和液化温度等3个关键做了进一步的均匀优化设计。试验设计方案和结果如表7所示。

表7 木薯淀粉水解均匀设计方案及实验结果
试验结果经SPSS软件数据处理,采用向后剔除法逐步回归分析,得出回归方程:Y=0.025 X1+0.096 X2+0.93 X3+1.01×10-5 X1X2-3.36×10-4X1X3-1.12×10-3X2X3-1.57,相关性系数 R2=0.982,模型回归方差分析显著性水平 Sig.=0.002<0.01,说明回归方程变量间关系是极显著的(表8)。对应的最优条件为:淀粉酶量为756 u/g,糖化酶量为602 u/g,液化温度为92°C。我们以此条件,对木薯淀粉水解工艺进行了重复验证试验,结果表明优化条件下的DE值达到97.3%。
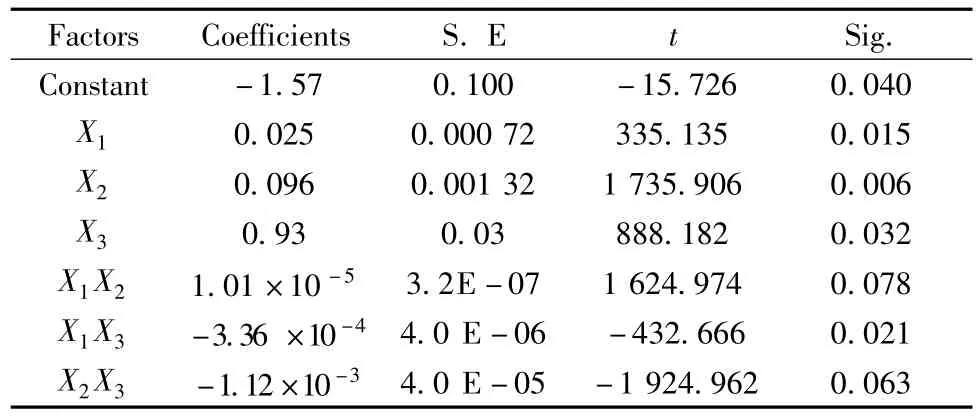
表8 均匀试验因素回归分析
2.4 木薯淀粉与葡萄糖的油脂发酵比较
为了进一步考察木薯淀粉水解液作为碳源进行T.cutaneum B3微生物油脂发酵的特性,分别以葡萄糖和木薯淀粉水解液为发酵碳源,在不同还原糖浓度(10~70 g/L)下,对T.cutaneum B3的菌体生长和油脂积累情况进行了比较。从图1可以看到,随着还原糖浓度的增加,菌体的生物量和油脂产量均呈逐步上升趋势。同时还可以看到,以T.cutaneum B3进行微生物油脂发酵,不管是菌体生长还是油脂产量,木薯淀粉水解液明显要优于葡萄糖。另外从T.cutaneum B3利用不同碳源的发酵过程也可以看出,在优化工艺条件下处理的木薯水解液,其菌体生物量和油脂总量均有很大提高,在以木薯淀粉水解液为碳源进行发酵时,144 h的生物量和油脂产量分别为16.38 g/L和7.22 g/L,比葡萄糖作为碳源的生物量和油脂产量分别提高了46.25% 和41.12%(图2)。因此,选用木薯淀粉水解液作为T.cutaneum B3进行微生物油脂发酵的碳源比葡萄糖作为碳源更具优势,也会具有更好的经济效益。

图1 葡萄糖及木薯淀粉水解液对T.cutaneum B3生物量和油脂产量的影响

图2 T.cutaneum B3利用不同碳源的发酵过程比较
3 结论
近年来,利用淀粉水解液发酵培养微生物生产成品的研究很多,赵宗保等利用菊粉水解液及菊芋块茎提取物水解液生物炼制微生物油脂,产量可达39.6 g/L,干菌体油脂含量为 56.5%[16]。Wei等[5]利用廉价木薯淀粉水解液作为有机碳源培养小球藻,与用葡萄糖作为有机碳源相比[6],其生物量和油脂含量分别提高了42.3% 和21.6%。本实验室以木薯淀粉水解液为碳源对T.cutaneum B3发酵生产微生物油脂进行了研究,发现木薯淀粉水解液对菌体生物量和油脂积累皆具有良好的效果[7]。这些研究结果证明价格低廉的淀粉在生物燃料领域具有的广泛应用前景,也为非粮糖质原料的再利用开辟了一条新途径。
本试验利用α-淀粉酶和糖化酶协同酶解木薯淀粉,得到了较好的水解效果。液化条件为淀粉量20%、淀粉酶量为756 u/g、液化时间30 min、液化温度为92℃;糖化条件为糖化酶量为602 u/g、糖化时间30 min、糖化温度60℃。在此条件下,水解液中的DE值达到97.3%。在此基础上探讨了木薯淀粉水解液作为碳源对T.cutaneum生物量和油脂积累的影响,结果发现,以木薯淀粉水解液作为碳源培养T.cutaneum B3,木薯淀粉水解液生物量和油脂产量分别为16.38 g/L和7.22 g/L,比葡萄糖作为碳源的生物量和油脂产量高46.25% 和41.12%。这些数据表明木薯淀粉水解液替代葡萄糖作为微生物发酵培养基有较好的工业发展前景,也对降低微生物油脂生产成本具有重要参考价值。
[1]方佳,濮文辉,张慧坚.国内外木薯产业发展近况[J].中国农学通报,2010,26(16):353-361.
[2]Jansson C,Westerbergh A,Zhang J M,et al.Cassava,a potential biofuel crop in(the)People s Republic of China[J].Appl Energy,2009,86(Suppl1):S95-S99.
[3] 赵宗保,胡翠敏.能源微生物油脂技术进展[J].生物工程学报,2011,27(3):427-435.
[4]黄日波,陈东,王青艳,等.木薯原料生产燃料乙醇[J].生物工程学报,2010,26(7):888-891.
[5]Wei A,Zhang X,Wei D,et al.Effects of cassava starch hydrolysate on cell growth and lipid accumulation of the heterotrophic microalgae Chlorella protothecoides[J].J Ind Microbiol Biotechnol,2009,36(11):1383-1389.
[6]李玉芹,袁正求,冯岳,等.双酶协同水解木薯淀粉水解液对小球藻生物量和油脂积累的影响[J].中国生物制品学杂志,2011,24(7):794-796.
[7]袁锦云,张志斌,朱笃,等.T.cutaneum B3利用木薯淀粉发酵生产微生物油脂[J].生物工程学报,2011,27(3):453-460.
[8]胡华宇,黄祖强,袁建微,等.机械活化木薯淀粉无液化直接糖化的研究[J].粮油加工,2008(4):97-100.
[9]袁建微,黄祖强,胡华宇,等.机械活化对木薯淀粉与真菌α-淀粉酶糖化效果的影响[J].粮油加工,2008(2):105-109.
[10]魏爱丽,张学武.木薯淀粉酶解工艺的优化[J].现代食品科技,2008,24(12):1250-1253.
[11]董华壮,扶雄,罗志刚,等.双酶协同酶解木薯淀粉的研究[J].现代食品科技,2009,25(2):182-184.
[12] 方开泰.正交与均匀试验设计[M].北京:科学出版社,2001.
[13]崔雷,杨成.玉米支链淀粉在单糖、寡糖水溶液中的粘度行为[J].化学研究与应用,2008,20(10):1279-1281.
[14] 北大生化系生化教研室.生物化学实验指导[M].北京:高等教育出版社,1986.
[15]李植峰,张玲,沈晓京,等.四种真菌油脂提取方法的比较研究[J].微生物学通报,2001,28(6):72 –75.
[16]Zhao X,Wu SG,Hu CM,et al.Lipid production from Jerusalem artichoke by Rhodosporidium toruloides Y4[J].J Ind Microbiol Biot,2010,37(6):581-585.
ABSTRACTIn order to improve the lipid production of cassava starch,the process of cassava starch hydrolysis(CSH)was optimized using orthogonal experimental design and Uniform design.The results showed that the content of α-amylase and glucoamylase and the liquefaction temperature significantly influenced cassava starch amylolysis.The dextrose equivalent value was up to 97.3%when content of α-amylase and glucose amylase and liquefaction temperature were 756 u/g,602 u/g and 92℃,respectively.While the CSH was used as a carbon source,the biomass and total lipid content of Trichosporon cutaneum were 16.38g/L and 7.22 g/L respectively,which increased by 46.25%and 41.12%as compared with those using glucose as a carbon source.Therefore,cassava starch hydrolysis,as a novel carbon source,is an ideal route to produce microbial lipid.
Key wordsmicrobial lipid,cassava starch hydrolysis,orthogonal experimental design,uniform design,dextrose equivalent value
Study on Hydrolysis Process of Cassava Starch Used for Microbial Lipid Fermentation
Zhang Zhi-bin1,Yan Ri-ming1,Zeng Qing-gui1,Wang Ya2,Zhu Du1,2
1(Key Laboratory of Protection and Utilization of Subtropic Plant Resources of Jiangxi Province,Jiangxi Normal University,Nanchang 330022,China)
2(Key Laboratory for Research on Active Ingredients in Natural Medicine of Jiangxi Province,Yichun University,Yichun 336000,China)
硕士,实验师(E-mail:zzbbio@163.com)。
*国家863计划(2012AA021205);江西省主要学科学术与技术带头人培养计划(060002);江西省高校产学研落地计划资助
2011-11-14,改回日期:2012-04-06

