蔗糖酯对酪蛋白乳浊液稳定性的影响*
刘道林,赵谋明,赵强忠
(华南理工大学轻工与食品学院,广东广州,510640)
蔗糖酯对酪蛋白乳浊液稳定性的影响*
刘道林,赵谋明,赵强忠
(华南理工大学轻工与食品学院,广东广州,510640)
研究蔗糖酯用量对酪蛋白乳浊液的粒度分布、液相蛋白浓度、界面蔗糖酯浓度、脂肪部分聚结率及乳析率等指标的影响,探讨蔗糖酯对酪蛋白乳浊液稳定性影响的机理。实验表明:随着蔗糖酯用量增加,液相蛋白浓度与界面蔗糖酯浓度逐渐增加,脂肪部分聚结率呈下降趋势,乳浊液的粒径和乳析率逐渐减小,乳浊液稳定性逐渐提高。当蔗糖酯用量超过0.60%时,脂肪部分聚结率缓慢下降,而乳析率缓慢上升最后达到动态平衡。综合考虑,当蔗糖酯用量为0.60%时,乳浊液的稳定性最佳。
蔗糖酯,乳浊液,稳定性,酪蛋白
食品乳浊液体系一般是由多元成分如蛋白质、多糖及乳化剂等组成的复合体系,其失稳现象一直是食品工业中常遇到的一大难题,为了解决这一问题,各生产企业在实际加工过程中常常通过加入乳化剂来改善乳浊液的稳定性。但乳化剂的选择和添加量的确定往往是凭经验或者感官进行的,缺乏理论指导。
蔗糖脂肪酸酯(sucrose fatty acid esters)简称蔗糖酯,是蔗糖和脂肪酸或脂肪酸衍生物通过酯化或酰化及酯交换反应得到的一类绿色非离子型表面活性剂[1]。它以蔗糖分子中的游离羟基为亲水基团,天然油脂中的脂肪酸链为憎水基团,具有非常好的生物降解性能和毒理学性质[2]。
本文针对目前食品蛋白乳浊液存在的失稳问题,研究蔗糖酯对酪蛋白乳浊液粒径分布、乳析率、液相蛋白浓度和脂肪部分聚结率的影响,探讨蔗糖酯对酪蛋白乳浊液稳定性影响的机理,并试图从理论上对蔗糖酯的作用效果进行解释。
1 材料与方法
1.1 材料与试剂
蔗糖酯S1170(食品级),三菱化工株式会社;酪蛋白(食品级),澳洲迈高;氢化油脂 BS-2000(食品级),南海油脂工业有限公司;金龙鱼玉米油,益海(广州)粮油工业有限公司;甲醇、乙腈、异丙醇(色谱级),北京迪马科技有限公司;四氢呋喃(色谱级),上海肯强仪器有限公司。
1.2 仪器与设备
FJ200-S高速分散均质机,上海江仪仪器有限公司;APV-1000高压均质机,丹麦APV公司;MD-130显微镜,奥林巴斯中国有限公司;Mastersizer 2000激光粒度分析仪,英国Malvern Instruments Ltd;W600液相色谱泵,沃特世(中国)有限公司;754分光光度计,上海光学仪器厂;LG10-2.4A离心机,北京医用离心机厂;JJ500电子分析天平,深圳市朗普电子科技公司。
1.3 实验方法
1.3.1 乳浊液的制备
乳浊液的基本配方如表1所示,制备方法如下:在65℃水浴条件下,将BS-2000融化,加入乳化剂、酪蛋白,制得油相;在搅拌状态下将65℃的去离子水缓慢加入到油相中,用高速分散均质机在9000 r/min的速率下剪切3 min,然后在20 MPa下用高压均质机均质一次,加入0.04%的叠氮钠溶液(抑制微生物生长),制得样品。
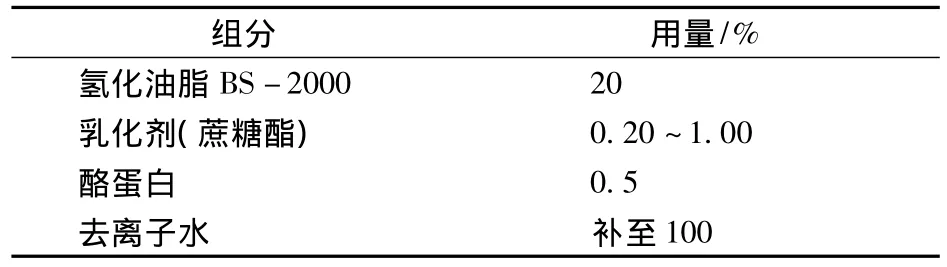
表1 乳浊液的基本配方
1.3.2 粒度分布的测定
粒度分布仪是测定乳浊液中粒子大小分布的仪器。样品按质量比1∶1000用去离子水稀释,设定操作参数如下[3]:
分析模式:通用;进样器名:Hydro 2000MU(A);颗粒折射率:1.520;颗粒吸收率:0.1;分散剂名:水;分散剂折射率:1.330;泵的转速:2200 r/min。

其中ni是指直径为di的脂肪球的数量。
1.3.3 液相蛋白浓度的测定
准确称取20 g乳浊液,于30℃,10000 g条件下离心30 min,乳化的油脂由于密度比水轻而上浮。离心结束时温度较高,迅速将离心管置于0℃左右的环境下,待上层的油脂层凝固后,用注射器将下层清液吸出,用微量凯氏定氮法测定液相中游离未吸附的蛋白质[10]。计算公式为:

1.3.4 界面蔗糖酯浓度的测定
根据Matsumiya的方法改良而成。称取样品若干,加1.5 mL水、2.5 mL甲醇、1.25 mL三氯甲烷,于室温下用旋涡振荡器振摇10 min,再加入2.5 mL三氯甲烷、2.5 mL质量浓度为1%的NaOH溶液,在950 g、4℃的条件下离心5 min,取底层三氯甲烷层,加入少量的Na2SO4除水,于4℃保藏12 h。然后重复上述离心过程1次,取底层三氯甲烷层,氮气浓缩吹干,取4 mL溶剂复溶,用高效液相色谱-蒸发光散射法(HPLC-ELSD)检测[13]。
1.3.5 乳析率的测定
取乳浊液样品10 mL于刻度离心管中,室温下在3000 g离心15 min,测定出乳析的体积,计算公式为:

1.3.6 脂肪部分聚结率的测定
精确称取油红O色素0.015 g,加入1000 g粟米油中,在室温(25℃)的条件下慢速搅拌约12 h使油红O充分溶解,制备的油红O油溶液需避光保存,其吸光度值可以保持恒定一周以上。准确称取乳浊液样品20 g和油红O溶液10 g于50 mL离心管中,混合均匀,在10000 g的离心力下离心30 min,移取上层澄清透明的红色油液倒入比色皿,在520 nm波长条件下测定吸光度值[10]。计算公式为:

2 结果与讨论
2.1 蔗糖酯用量对乳浊液界面蔗糖酯浓度的影响
图1为蔗糖酯用量对乳浊液界面蔗糖酯浓度的影响。

图1 蔗糖酯用量对乳浊液界面蔗糖酯浓度的影响
由图1可知,界面蔗糖酯浓度随蔗糖酯用量的增加呈上升趋势。当蔗糖酯用量处于0.20%~0.60%,界面蔗糖酯浓度迅速增加;蔗糖酯的用量超过0.60%时,界面蔗糖酯浓度增加速度变得很缓慢,此时,油-水界面膜由蔗糖酯主导。这是因为蔗糖酯用量较低时,均质后蔗糖酯迅速吸附到脂肪球表面,乳浊液油-水界面同时吸附着蔗糖酯和酪蛋白,此时酪蛋白主要吸附在界面上起乳化稳定作用,界面上的蔗糖酯含量较少。当蔗糖酯用量进一步增大时,由于蔗糖酯的表面活性比酪蛋白强,在均质形成脂肪球的过程中能够竞争解析油水界面上的酪蛋白,使得蔗糖酯在界面上的吸附量逐渐增加[4-7]。
2.2 蔗糖酯用量对乳浊液液相蛋白浓度的影响
不同用量的蔗糖酯对乳浊液液相蛋白浓度的影响如图2所示。
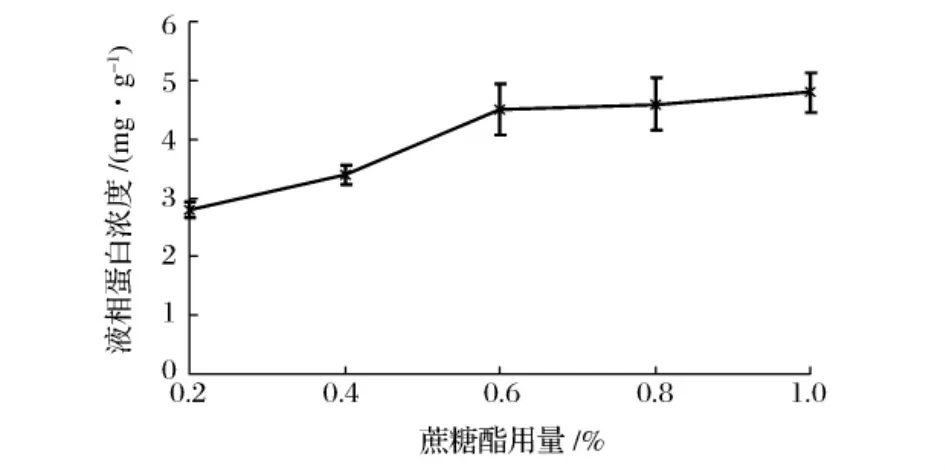
图2 蔗糖酯用量对乳浊液液相蛋白浓度的影响
由图2可知,随着蔗糖酯用量的增加,液相蛋白浓度逐渐增加。当蔗糖酯用量处于0.20%~0.60%时,液相蛋白浓度增加迅速,此时,油-水界面膜由酪蛋白主导;当蔗糖酯的用量超过0.60%时,液相蛋白浓度增加速度变得很缓慢。这主要原因是:随着蔗糖酯用量的增大,界面蔗糖酯浓度逐渐上升,相应的界面蛋白浓度随之减小,表现为液相蛋白浓度逐渐上升。
2.3 蔗糖酯用量对乳浊液粒度分布的影响
蔗糖酯用量对乳浊液粒度分布的影响如表2和图3所示。

表2 蔗糖酯用量对乳浊液粒径d3,2和d4,3的影响

图3 蔗糖酯用量对乳浊液粒度分布的影响
从表2明显可以看出,随着蔗糖酯用量的增加,乳浊液脂肪球粒径 d3,2和 d4,3逐渐减小,当蔗糖酯用量为 0.60% 时,脂肪球粒径 d3,2和 d4,3达到最小,此后随着蔗糖酯用量的增加,粒径 d3,2和 d4,3的值基本保持不变。从图3可以看出,当蔗糖酯的用量<0.60%时,乳浊液的粒度分布为标准的单峰,当蔗糖酯用量高于0.60%时,粒度分布开始变为由一个粒径较小的小峰和一个粒径较大的主峰组成不规则双峰,且随着用量的增加,粒径较大的主峰的峰值减小,同时粒径较小的小峰峰面积随之增加。当蔗糖酯用量为0.80%时,粒径较大的主峰的峰值达到最小,同时粒径较小的小峰峰面积达到最大。这主要原因是,当蔗糖酯用量较低时,乳浊液界面膜主要由蛋白质来主导,脂肪球表面同时吸附着酪蛋白和乳化剂,二者共同作用,降低了界面张力,使界面具有较低的自由能。随着蔗糖酯用量的增加,乳浊液的乳化效果也随之增加,均质后蔗糖酯迅速吸附到油水界面上的浓度也越高,降低界面自由能的能力越强,故乳浊液的稳定性越好,粒径也越小。当乳浊液中蔗糖酯用量进一步增大时,蔗糖酯和酪蛋白之间的竞争吸附增强,蔗糖酯逐渐将吸附于界面膜上的酪蛋白解析下来[4-7],当二者之间的作用达到平衡时,乳化效果最好,表现为蔗糖酯用量达到0.60%时,乳浊液粒径最小。当蔗糖酯用量大于0.60%时,乳浊液界面膜主要由蔗糖酯来主导,乳化后的脂肪球新增表面被蔗糖酯分子等具有面活性的成分全部“覆盖”并稳定以后,在增加的蔗糖酯成分就没有合适的界面去吸附;此时的乳化剂添加量,应该是最佳理论添加量,超过该添加量后多余的蔗糖酯分子就会形成胶束,添加效果就会降低[8-9]。粒径的变化趋势与乳浊液液相蛋白浓度及界面蔗糖酯浓度的变化趋势是相符的。
2.4 蔗糖酯用量对乳浊液脂肪部分聚结率的影响
蔗糖酯用量对乳浊液脂肪部分聚结率的影响如图4所示。
图4 蔗糖酯用量对乳浊液脂肪部分聚结率的影响
由图4可知,随着蔗糖酯用量的增加,脂肪部分聚结率逐渐减小。当蔗糖酯用量处于0.20%~0.60%时,乳浊液的脂肪部分聚结率显著降低;当蔗糖酯用量大于0.60%时,其脂肪部分聚结率缓慢减小。这是因为随着蔗糖酯用量的增加,乳浊液的粒径逐渐减小,有利于阻止脂肪球互相碰撞聚结到一起,最终表现为脂肪部分聚结率逐渐降低。
2.5 蔗糖酯用量对乳浊液乳析率的影响
蔗糖酯用量对乳浊液乳析率的影响如图5所示。

图5 蔗糖酯用量对乳浊液乳析率的影响
从图5可以看出,随着蔗糖酯用量的增加,乳析率先减小后增大,最后趋于稳定。当蔗糖酯的用量低于0.60%时,乳浊液的乳析率迅速降低;当蔗糖酯的用量为0.60%时,乳析率达到最小,即蔗糖酯用量为0.60%时乳浊液稳定性最好;此后,随着蔗糖酯用量的增大,乳析率开始缓慢增大,最后趋于平稳。主要原因是:随着蔗糖酯的加入,乳浊液的脂肪部分聚结率逐渐降低,乳浊液的稳定性逐渐增强,宏观上表现为乳浊液的乳析率逐渐减小。当蔗糖酯的用量大于0.60%时,界面上的酪蛋白基本被竞争解析下来,原先由酪蛋白主导的界面膜变为由蔗糖酯主导,界面膜的强度和粘弹性均有所降低,脂肪球易破裂,宏观上表现为乳析率缓慢的增大[10-12]。
3 结论
(1)乳浊液中蔗糖酯的用量为0.60%时,液相蛋白浓度与界面蔗糖酯浓度基本达到最大值。
(2)随着蔗糖酯用量的增加,粒径逐渐减小;当蔗糖酯用量为0.60%时,粒径达到最小,且粒度分布也开始由一个粒径较大的单峰变为由一个粒径较小的小峰和一个粒径较大的主峰组成不规则双峰。
(3)脂肪部分聚结率随着蔗糖酯用量的增加而呈下降趋势。蛋白乳浊液的乳析率随着蔗糖酯用量的增加,乳析率逐渐减小,最后达到动态平衡。
[1]Ivanova M,Janega P,Matejikova J,et al.Activation of Akt kinase accompanies increased cardiac resistance to ischemia/reperfusion in rats after short-term feeding with lard-based high-fat diet and increased sucrose intake[J].Nutrition Research,2011,31(8):631-643.
[2]Szüts A,Pallagi E,Regdon G,et al.Study of thermal behaviour of sugar esters[J].International Journal of Pharmaceutics,2007,336(2):199-207.
[3]龙肇,赵强忠,赵谋明.单甘酯和蔗糖酯复配比例对核桃乳稳定性的影响[J].食品与发酵工业,2009,35(5):181-184.
[4]Rodrr'guez Patino J M,Rodrr'guez Nio M R,Sánchez C C.Protein–emulsifier interactions at the air– water interface[J].Current Opinion in Colloid& Interface Science,2003,8(4/5):387-395.
[5]George A.Competitive adsorption of protein and surfactants in highly concentrated emulsions:effect on coalescence mechanisms[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2003,213(2/3):209-219.
[6]Alan R,Mackie,Patrick Gunning,et al.Orogenic displacement of protein from the oil/water interface[J].Langmuir,2000,16(5):2242-2247.
[7]Constantinos V,Nikiforidis,Vassilios Kiosseoglou.Competitive displacement of oil body surface proteins by Tween 80——Effect on physical stability [J].Food Hydrocolloids,2011,25(5):1063-1068.
[8]刘强,张可,李凤舞,等.蔗糖酯对乳体系影响作用的研究[J].现代食品科技,2010,26(11):11-14.
[9]赵正涛,李全阳,杨倩,等.单甘酯对牛乳体系稳定性影响机理的研究[J].食品科学,2009,30(23):123-126.
[10]赵强忠,余权,苏国万,等.乳化剂用量对搅打稀奶油搅打性能和品质的影响机理研究[J].食品与发酵工业,2009,35(4):175-179.
[11]Hotrum N E.Influence of crystalline fat on oil spreading at clean and protein covered air/water interfaces[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2004,240(1-3):83-92.
[12]Donald F.Darling.Recent advances in the destabilization of dairy emulsions[J].Journal of Dairy Research,1982,49(4):695-712.
[13]Matsumiya K,Takahashi W,Inoue T,et al.Effects of bacteriostatic emulsifiers on stability of milk-based emulsions[J].Journal of Food Engineering,2010,96(2):185-191.
ABSTRACTThe effect of emulsifier S1170(sucrose ester)on particle size distribution,protein concentration in aqueous phase,surface sucrose ester concentration,partial coalescence of fat globule and creaming rate of emulsion stabilized by caseins were investigated.The possible mechanism for the stability of casein emulsion affected by sucrose ester content was also analyzed.The results indicated that with increasing of sucrose ester content,the protein concentration in aqueous phase and surface sucrose ester concentration were increasing,the fat part of the coalescence rate was gradually decreasing,the droplet size and the creaming rate were decreasing,which in turn stabilized the emulsions.The partial coalescence of fat globule decreased slowly,while the creaming rate increased slowly to the dynamic equilibrium value.In summary,the stability of emulsion was the best at sucrose ester content of 0.60%.
Key wordssucrose ester,emulsion,stability,casein
Effects of Sucrose Ester on the Stability of Casein Emulsion
Liu Dao-lin,Zhao Mou-ming,Zhao Qiang-zhong
(College of Light Industry and Food Science,South Chain University of Technology,Guangzhou 510640,China)
硕士研究生(赵强忠副教授为通讯作者)。
*国家自然科学基金赞助项目(20806030),粤港关键领域重点突破项目(2009A020700003)
2012-03-12,改回日期:2012-05-09

