热处理过程中牡蛎闭壳肌肌原纤维蛋白部分理化特性的变化*
陈铮,朱蓓薇,李冬梅,姜鹏飞,赵鑫,邓丽
(大连工业大学食品学院,国家贝类加工技术研究分中心(大连),辽宁 大 连,116034)
热处理过程中牡蛎闭壳肌肌原纤维蛋白部分理化特性的变化*
陈铮,朱蓓薇,李冬梅,姜鹏飞,赵鑫,邓丽
(大连工业大学食品学院,国家贝类加工技术研究分中心(大连),辽宁 大 连,116034)
通过对牡蛎闭壳肌肌原纤维蛋白加热过程中浊度、溶解度、表面疏水性、α螺旋含量和总巯基含量的测定,研究了热处理过程中牡蛎闭壳肌肌原纤维蛋白理化特性的变化,结果表明,在20~40℃,牡蛎闭壳肌肌原纤维蛋白溶液的浊度、溶解度、表面疏水性、α螺旋含量和总巯基含量均无明显变化。在温度高于40℃时,随着温度的升高,牡蛎闭壳肌肌原纤维蛋白的浊度整体呈增大趋势,46℃下变化最为明显;溶解度在40~50℃变化最大,结合浊度的变化规律推测其变性温度为46℃;表面疏水性总体上逐渐增加,在40~50℃变化最大;α螺旋含量总体上逐渐降低,60℃变化最大,当温度达到70℃时约有80%的α螺旋结构被破坏;总巯基含量逐渐降低,50℃时下降最快。
牡蛎,闭壳肌,热处理,肌原纤维蛋白,理化特性
牡蛎(Oyster)是世界上第一大养殖贝类,也是我国四大养殖贝类之一,是一种珍贵的海产软体动物[1]。牡蛎肉质鲜美,蛋白质及糖原含量丰富,富含多种维生素及铜、铁、锌、碘等微量元素,尤其是牛磺酸含量丰富,具有很高的营养价值[2]。牡蛎可食部位主要包括外套膜、闭壳肌和内脏囊,其中闭壳肌肌原纤维蛋白含量丰富[3],外套膜胶原蛋白含量较高[4]。
肌原纤维蛋白在不同的环境和加工条件下,通常表现出不同的功能特性[5]。浊度可以反映蛋白质的聚集程度。溶液中蛋白质聚集形成颗粒的数目越多、体积越大,浊度就越大[6]。肌原纤维蛋白的聚集程度影响其形成凝胶的结构[7],进而影响肉类的品质。蛋白质的溶解度影响其热诱导凝胶性质、起泡性以及肉品的保水性[8],同时溶解度可作为制品过熟程度的判断指标[9]。疏水作用对蛋白质的稳定性、构象和蛋白质功能具有重大意义。由于蛋白质是大分子结构,表面疏水性影响分子间的相互作用,因此对蛋白质的功能具有较大的影响[10]。α螺旋含量和总巯基含量则是反映肌原纤维蛋白理化性质的重要指标。
热处理是水产品加工中常用的方法,加热可以引起蛋白质空间结构的变化以及蛋白质的降解[11]。本实验通过对牡蛎闭壳肌肌原纤维蛋白在加热过程中的浊度、溶解度、表面疏水性以及α螺旋含量、总巯基含量的变化进行研究,探寻牡蛎蛋白的热加工特性,以期对牡蛎资源的有效利用和相关产品的开发提供依据。
1 材料与方法
1.1 材料
1.1.1 原料
新鲜大连湾牡蛎(Crassostrea talienwhanensis),市售。
1.1.2 试剂
Na2HPO4、NaH2PO4、NaCl、二硫苏糖醇(DTT)、MgCl2、无水CuSO4、NaOH、酒石酸钾钠、Tris、尿素(U-rea)、1-苯氨基萘-8-磺酸铵(ANS)等均为分析纯;蛋白质分子质量标准品,宝生物工程(大连)有限公司。
1.1.3 主要仪器
T25数显匀浆机,德国IKA;Z-323K冷冻离心机,德国HERMLE;UV-2100型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;pH计,上海鹏顺科学仪器有限公司;HH-4数显恒温水浴锅,江苏省金坛市荣华仪器制造有限公司;JM-250型电泳仪,大连捷迈科贸有限公司;荧光光谱仪,美国PE公司;J-810型圆二色谱仪,日本JASCO公司。
1.2 实验方法
1.2.1 牡蛎闭壳肌肌原纤维蛋白的提取
牡蛎闭壳肌肌原纤维蛋白的提取参照王耀耀等[12]的方法进行,并根据实际情况进行改进。牡蛎开壳后取闭壳肌洗净、切碎,加入少量水洗液(10 mmol/L的磷酸盐缓冲液,pH 7.0,含40 mmol/LNaCl,0.5 mmol/L DTT和1 mmol/L MgCl2)打浆30 s,再加入20倍体积(mL/g)的水洗液,10000 r/min间歇匀浆4 min。所得匀浆物在12000 r/min离心6 min,将所得沉淀按照上述步骤重复处理2次。向第3次所得沉淀中加入10倍体积(mL/g)的提取液(10 mmol/L的磷酸盐缓冲液,pH 7.0,含0.6 mol/L NaCl),10000 r/min间歇匀浆4 min,然后将匀浆液在13500 r/min离心15 min,所得上清液即为牡蛎闭壳肌肌原纤维蛋白溶液。以上操作均在4℃下进行。
1.2.2 蛋白质浓度的测定
采用双缩脲法[13]对蛋白质浓度进行测定,用牛血清蛋白(BSA)作为标准蛋白。
1.2.3 牡蛎闭壳肌肌原纤维蛋白的热处理方法
参照王耀耀等[12]的方法对牡蛎闭壳肌肌原纤维蛋白进行热处理,并稍作修改。在低于90℃范围内,固定升温速率为1.3℃/min,考察温度点选择为20、30、40、50、60、70、80和90℃,当温度达到相应值时立即取出试管并用流水冷却。
1.2.4 浊度的测定
参照Liu等[14]的方法,将肌原纤维蛋白溶液调整至2 mg/mL,取不同温度加热后的样液各3 mL,在350 nm下测定吸光度,实验重复3次取平均值。
1.2.5 溶解度的测定
测定浊度后的蛋白溶液在4℃、13500 r/min下离心15 min,取上清液,参照徐幸莲等[15]方法测定蛋白质溶解度。
1.2.6 表面疏水性的测定
牡蛎闭壳肌肌原纤维蛋白表面疏水性的测定参照Benjakul等[16]的方法进行,使用1-苯氨基萘-8-磺酸铵(ANS)作为荧光探针,并做了一些改进。取不同浓度并进行热处理后的ANS-蛋白质复合物,在荧光激发波长为383 nm、吸收波长为483 nm下测定其荧光吸收强度。以ANS-蛋白质复合物的荧光强度与蛋白质浓度作图,用直线斜率来表示牡蛎闭壳肌肌原纤维蛋白的表面疏水性。
1.2.7 α螺旋含量的测定
α螺旋含量的测定参照Wang等[17]的方法进行,并稍作改进。取已调整到一定浓度的肌原纤维蛋白溶液进行加热处理。加热处理完毕后,用圆二色谱仪测定各温度点肌原纤维蛋白溶液的椭圆率。比色皿的光程为0.1 cm。α螺旋结构含量值计算:


式中[θ]222为222 nm处的摩尔椭圆率,deg·cm2/dmol;[θ]obs为椭圆率,deg;MW为肌原纤维蛋白平均氨基酸残基分子量,取值为115 g/mol;L为比色皿光程长度,cm;C为肌原纤维蛋白浓度,mg/mL。
1.2.8 总巯基含量的测定
参照Wang等[17]的方法对总巯基含量进行测定。将肌原纤维蛋白溶液稀释到2 mg/mL。取0.5 mL肌原纤维蛋白溶液加热处理,然后向其中加入4.5 mL Tris-HCl缓冲液(含8 mol/L尿素,2%SDS和10 mmol/L EDTA,pH 6.8,0.2 mol/L),再加入0.5 mL 10%DTNB,混匀后40℃保温25 min,在412 nm下测定吸光值。空白为含NaCl(0.6 mol/L)的磷酸盐缓冲液(10 mmol/L,pH 7.0)。计算总巯基含量:
总巯基含量

式中,A412表示在412 nm时的吸光值;V总表示测定时蛋白质溶液的总体积,mL;13600为摩尔吸光系数,mol/(cm·L);L为光程,cm;V表示蛋白溶液体积,mL;C表示蛋白质溶液的浓度,单位mg/mL。
1.2.9 数据处理
热处理过程中牡蛎闭壳肌肌原纤维蛋白溶液浊度、溶解度、表面疏水性、α螺旋含量和总巯基含量的变化率分别按照下面的公式进行计算:
某温度下浊度的变化率=(后一温度下的浊度值-当前的浊度值)/相邻点的温度差值
某温度下溶解度的变化率=(前一温度下的蛋白浓度-该温度下的蛋白浓度)/相邻点的温度差值
某温度下的表面疏水性的变化率=(后一温度下的表面疏水性-该温度下的表面疏水性)/相邻点的温度差值
某温度下的α螺旋含量的变化率=(前一温度下的α螺旋含量-该温度下的α螺旋含量)/相邻点的温度差值
某温度下的总巯基含量的变化率=(前一温度下的总巯基含量-该温度下的总巯基含量)/相邻点的温度差值
2 结果与讨论
2.1 热处理对牡蛎闭壳肌肌原纤维蛋白浊度的影响
由图1可以看出,牡蛎闭壳肌肌原纤维蛋白溶液的浊度随温度升高整体呈现增大趋势。30~44℃时浊度变化不明显,表明在此温度范围内蛋白质没有发生明显的变性聚集;44~58℃时浊度增加趋势较为明显。Paredi等[18]报道,扇贝肌球蛋白的变性温度为41.7~55.0℃,而牡蛎肌原纤维蛋白浊度从44℃开始增加,可以推测可能是由于肌球蛋白的变性聚集引起的。当温度超过58℃,浊度随温度升高继续上升,表明此时蛋白聚集物的结构变得致密,但变化趋势较44~58℃区间略平缓,说明蛋白质聚集物在生成过程要较蛋白质聚集物变得致密过程中浊度的上升更为明显。变化率有1个较大的峰值是46℃,表明46℃时牡蛎肌原纤维蛋白浊度变化最为明显。

图1 热处理对牡蛎闭壳肌肌原纤维蛋白浊度的影响
2.2 热处理对牡蛎闭壳肌肌原纤维蛋白溶解度的影响
由图2可知,在浓度为2 mg/mL条件下,30~40℃时,牡蛎闭壳肌肌原纤维蛋白溶解度变化不明显,说明在此温度范围内蛋白质未发生明显变性,而浊度在此温度范围内的变化不明显也可进一步反映出蛋白质变性的情况;40~50℃时,溶解度明显降低,说明此时蛋白质发生了明显的变性聚集,浊度在此温度范围内也明显升高,这是由于加热促使蛋白质空间结构发生变化,疏水基团暴露后发生聚集导致的;当加热温度超过50℃,溶解度先缓慢下降后又逐渐上升,反映出在这个温度范围内蛋白质的变性情况;变化率的最大峰值为50℃,结合溶解度的变化趋势,可以进一步表明在40~50℃,溶解度的变化最为明显,变性程度最大,同时浊度在46℃时变化率达到最高峰,可以推测出46℃可能是牡蛎闭壳肌肌原纤维蛋白的变性温度。
2.3 热处理对牡蛎闭壳肌肌原纤维蛋白表面疏水性的影响

图2 热处理对牡蛎闭壳肌肌原纤维蛋白溶解度的影响
当温度低于40℃时,牡蛎闭壳肌肌原纤维蛋白结构相对稳定,表面疏水性略有增加,变化趋势与溶解度和浊度的变化趋势相近;40~80℃时,随着温度升高,肌原纤维蛋白疏水性氨基酸残基逐渐暴露,疏水性明显增加。此温度范围内疏水性的增加经历了2个阶段:第1个阶段为40~60℃,第2个阶段为60~80℃。结合1.3.9中表面疏水性变化率公式,变换率峰值最高时为40℃,可以得出温度在40~50℃之间时,肌原纤维蛋白的表面疏水性变化最为明显。这与Benjakul等[16]对鱼类肌原纤维表面疏水性的变化趋势一致。结合肌原纤维蛋白在加热过程中表面疏水性、浊度、溶解度的变化趋势可以明显地反映出蛋白质的变性情况及其变化规律。

图3 热处理对牡蛎闭壳肌肌原纤维蛋白表面疏水性的影响
2.4 热处理对牡蛎闭壳肌肌原纤维蛋白α螺旋含量的影响
当加热温度在20~40℃时,牡蛎闭壳肌肌原纤维蛋白的α螺旋含量变化不明显,约为39%~41%;40~70℃时,α螺旋含量随着温度的升高明显降低,表面蛋白质的空间结构发生了明显的变化,逐渐完成了从二级结构(α螺旋、β折叠)到三级或四级结构的变化;同时,由于此时蛋白质的部分变性使一些天然态内埋藏的疏水肽段暴露于溶剂中而有效地改变了蛋白的表面性质,从而导致在此温度范围内蛋白质的表面疏水性也发生了明显变化。当加热温度升至70℃时,牡蛎闭壳肌肌原纤维蛋白的α螺旋含量降至8%左右,较加热前约有80%的α螺旋的结构被破坏,而温度在70~90℃时α螺旋含量随温度变化不明显。变化率峰值最高时为60℃,说明在60℃左右肌原纤维蛋白的α螺旋含量变化最为明显。以上研究结果与Wang等[17]报道的热处理对猪肉中肌动球蛋白的α螺旋含量变化趋势一致。
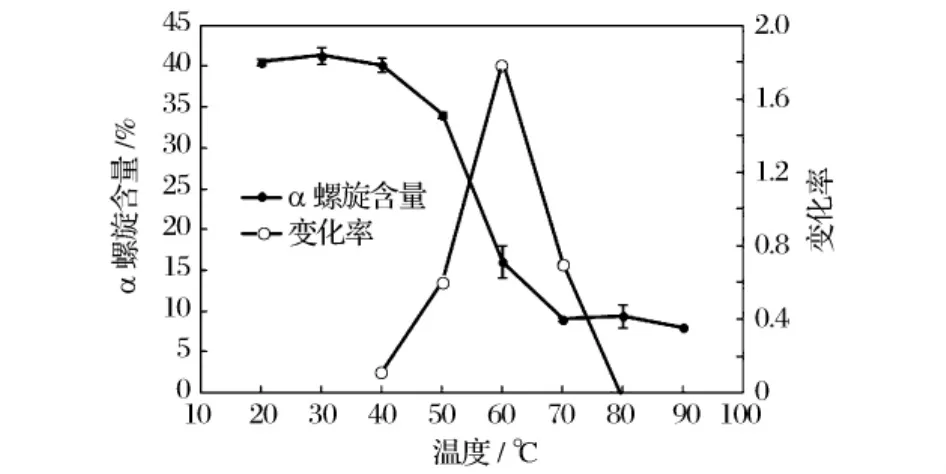
图4 热处理对牡蛎闭壳肌肌原纤维蛋白α螺旋含量的影响
2.5 热处理对牡蛎闭壳肌肌原纤维蛋白总巯基含量的影响

图5 热处理对牡蛎闭壳肌肌原纤维蛋白总巯基含量的影响
由图5可知,牡蛎闭壳肌肌原纤维蛋白在常温(20℃)下总巯基含量约为33 mol/105g蛋白。20~40℃加热过程中肌原纤维蛋白的总巯基含量的变化趋势与浊度、表面疏水性、溶解度、α螺旋含量等的变化趋势相似。当温度在40~90℃之间时,总巯基含量逐渐降低,这是由于蛋白质变性使含巯基基团的活性区域暴露,导致巯基更易被氧化,从而引起总巯基含量的下降。其中在40~60℃之间时下降尤其明显,变化率在50℃存在一个最大峰值,也反映出此温度范围内总巯基含量的变化最明显,60~90℃之间时总巯基含量下降趋势较40~60℃之间平稳,该结果与姚磊等[19]研究鲫肌原纤维蛋白加热过程中的总巯基含量变化基本一致。表明牡蛎闭壳肌肌原纤维蛋白从40℃时开始有大分子物质产生,而浊度、表面疏水性、溶解度、α螺旋含量以及总巯基含量也恰好在40℃左右开始发生变化,在40~60℃时之间均表现出较为明显的变化规律。
3 结论
(1)热处理温度在20~40℃时,牡蛎闭壳肌肌原纤维蛋白溶液的浊度、溶解度、表面疏水性、α螺旋含量和总巯基含量均无明显变化。在温度高于40℃时,随着温度的升高,浊度和表面疏水性整体呈逐渐增加的趋势,溶解度、α螺旋含量和总巯基含量整体呈逐渐降低的趋势;
(2)牡蛎闭壳肌肌原纤维蛋白的溶解度在40~50℃之间时变化最大,浊度在46℃条件下变化最大,由此推测其变性温度为46℃。
[1]叶盛权,郑贤德,黄甫.牡蛎冷冻加工工艺[J].冷饮与速冻食品工业,2003,9(1):12-13.
[2]董晓伟,姜国良,李立德,等.牡蛎综合利用的研究进展[J].海洋科学,2004(4):62-65.
[3]Cruz-Romero M,Smiddy M,Hill C.Effects of high pressure treatment on physicochemical characteristics of fresh oysters(Crassostrea gigas)[J].Innovative Food Science and Emerging Technologies,2004(5):161-169.
[4]Mizuta S,Miyagi T,Yoshinaka R.Characterization of the quantitatively major collagen in the mantle of oyster Crassostrea gigas[J].Fisheries Science,2005,71(1):229-235.
[5]罗永康,潘道东,沈慧星,等.蛋白质浓度、pH、离子强度对鲢鱼肌原纤维蛋白黏度的影响[J].食品与发酵工业,2004,30(7):52-54.
[6]Thorarinsdottir K A,Arason S,Geirsdottir M,et al.Changes in myofibrillar proteins during processing of salted cod(Gadus morhua)as determined by electrophoresis and differential scanning calorimetry[J].Food Chemistry,2002,77(3):377-385.
[7]费英,韩敏义,杨凌寒,等.pH对肌原纤维蛋白二级结构及其热诱导凝胶特性的影响[J].中国农业科学,2010,43(1):164-170.
[8]Vani B,Zayas J F.Foaming properties of selected plant and animal proteins[J].Journal of Food Science,1995,60(5):1025-1028.
[9]丁丽敏.蛋白溶解度作为评定豆粕过熟程度指标的研究[J].中国农业大学学报,1998,3(001):105-109.
[10]Sheard P R,Fellows A,Ledward D Aaa,et al.Macromolecular charges Associated with the heat treatment of soya isolate[J].Food Technology,1988,21:55-60.
[11]朱蓓薇.海珍品加工理论与技术的研究[M].北京:科学出版社,2010.
[12]王耀耀,朱蓓薇,董秀萍,等.鲍鱼腹足肌原纤维蛋白的组成及其性质[J].大连工业大学学报,2011(3):183-186.
[13]袁道强,黄建华.生物化学实验和技术[M].北京:中国轻工业出版社,2006.
[14]Liu M N,Foegeding E A,Wang S F,et al.Denaturation and aggregation of chicken myosin isoforms[J].Journal of Agricultural and Food Chemistry,1996,44(6):1435-1440.
[15]徐幸莲,韩敏义,林丽军,等.兔骨骼肌肌球蛋白溶液浊度和溶解度研究[J].南京农业大学学报,2003,26(4):93-96.
[16]Benjakul S,Visessanguan W,Ishizaki S,et al.Differences in gelation characteristics of natural actomyosin from two species of bigeye snapper,Priacanthus tayenus and Priacanthus macracanthus[J].Journal of Food Science,2001,66(9):1311-1318.
[17]Wang H,Pato M,Pietrasik Z,etal.Biochemical and physicochemical properties of thermally treated natural actomyosin extracted from normal and PSE pork Longissimus muscle[J].Food Chemistry,2009,113(1):21-27.
[18]Paredi M E,Tomas M C,Crupkin M.Thermal denaturation of myofibrillar proteins of striated and smooth adductor muscles of scallo p(Zyg ochlamy s patag onica).A differential scanning calor imetric study[J].Journal of Agricultural and Food Chemistry,2002,50:830-834.
[19]姚磊,罗永康,沈慧星,等.鲫肌原纤维蛋白加热过程中理化特性变化规律[J].水产学报,2010(8):1303-1308.
ABSTRACTThe effects of heat treatment on the physiochemical properties changes of myofibrillar proteins from oyster adductor muscle including turbidity,solubility,surface hydrophobicity,α helix content and total sulphydryl content were investigated.The results showed that all the above indicators remained invariable when the heating temperature was 20~40℃.When the temperature was higher than 40℃,obvious changes of the above indicators were obtained.As the temperature rised,the turbidity of the oyster myofibrillar proteins increased gradually and changed remarkably at 46℃.The solubility and surface hydrophobicity both changed obviously during 40~50℃and the denaturation temperature was determined to be 46℃.The α helix content of myofibrillar protein decreased gradually and the most rapid changes occurred at 60℃.About 80%of the α helix was damaged when the temperature increased to 70℃.The total sulphydryl content decreased gradually when the temperature was higher than 40℃,and the most obvious changes were observed at 50℃.
Key wordsoyster,adductor muscle,heat treatment,myofibrillar protein,physiochemical properties
Physiochemical Changes of Myofibrillar Protein from Oyster Adductor Muscle During Heat Treatment
Chen Zheng,Zhu Bei-wei,Li Dong-mei,Jiang Peng-fei,Zhao Xin,Deng Li
(School of Food Science and Technology,Dalian Polytechnic University,National R&D Branch Center for Shellfish Processing(Dalian),Dalian 116034,China)
硕士研究生(李冬梅为通讯作者)。
*国家十二五“863”计划主题项目新型水产品加工装备开发与新技术研究(编号:2011AA100803)
2011-12-03,改回日期:2012-02-25

