天山冻土中产低温蛋白酶菌株的筛选、鉴定及酶学性质*
祁丹丹,杨瑞金,华霄,沈莲莲,张文斌,赵伟
1(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
2(江南大学食品学院,江苏 无 锡,214122)
天山冻土中产低温蛋白酶菌株的筛选、鉴定及酶学性质*
祁丹丹1,杨瑞金2,华霄2,沈莲莲1,张文斌2,赵伟2
1(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
2(江南大学食品学院,江苏 无 锡,214122)
借助形态观察、生理生化指标测定及16S rDNA序列分析,对从新疆天山冻土中筛选得到的产低温蛋白酶菌株进行鉴定,确定其为Pseudomonas sp.(假单胞菌属)N-8。通过单因素试验和正交实验对其发酵条件进行优化,确定最佳发酵培养基配方为(g/L):葡萄糖10,酵母粉8,酪蛋白20,K+0.4,pH 7.0。酶学性质研究表明,该菌产生的低温蛋白酶最适作用pH为7.0,在pH 7.0~8.0呈现良好的稳定性;最适作用温度为25℃,在25、35、45℃下均呈现良好的稳定性;金属离子Cu2+、K+、Ca2+、Mn2+对酶活有一定的抑制作用,其中Cu2+抑制作用明显,Fe2+、Mg2+、Na+、Zn2+对酶活力有不同程度的激活作用。
耐冷菌,低温蛋白酶,酶学性质,假单胞菌属
天山冻土属于我国高海拔高山常年冻土,冻土环境中微生物会产生一系列适应低温、寡营养、强辐射、冻融等极端因子的分子机制,为低温微生物生理多样性提供了可能[1]。低温酶由于在低温环境下具有较高的酶活性,有助于在保证催化效率的前提下降低反应温度和缩短反应时间,从而大幅度节约能源[2],因而在食品加工、日化产品、皮革加工等需要低温催化的行业中具有较高的开发利用价值[3]。目前发现,产低温蛋白酶的菌有假单胞菌属(Psedomonas)[4]、黄杆菌属(Flavobacterium)[5]、气单孢菌属(Aeromonas)[6]、希瓦氏菌属(Shewanella)[7]、弧菌属(Vibrio)[8]。这些低温菌在永久性低温环境下经过长期的进化适应,已有着适应低温环境的特殊结构与生理生化机制。它们所产生的低温蛋白酶也有着独特的生理生化特征与结构特征。有关低温微生物的资源勘探与代谢活性产物研究,已成为国际微生物学研究的热点之一[9],我国的一些研究机构也积极开展低温蛋白酶生产菌株的筛选工作[10-11]。
本课题组从新疆冻土中筛选出1株产低温蛋白酶的耐冷菌株,经鉴定为假单胞菌属,对其发酵条件进行优化以提高其产酶能力,并对其所产低温蛋白酶的粗酶酶学性质进行了初步研究,为极地微生物产低温蛋白酶的研究打下一定的基础。
1 材料和方法
1.1 实验材料
样品采自新疆天山冰川海拔3845 m处。沿2 m深的冻土剖面每隔20 cm取样,迅速将其装入已灭菌的保鲜盒内,置于车载冰箱保存,运回实验室后,在超净台上削去表皮可能受到污染的样品,于-20℃保存备用。
1.2 培养基
PYG富集培养基(g/L):蛋白胨0.5,酵母粉1,葡萄糖1,CaCl20.02,K2HPO4·3H2O 0.1,MgSO4·7H2O 0.04,NaCl 0.5,pH 7.2;
初筛培养基(g/L):蛋白胨0.05,酵母膏0.03,酪蛋白1,琼脂1.5,pH 7.0;
发酵培养基(g/L):葡萄糖1,酵母粉0.4,酪蛋白1,MgSO4·7H2O 0.02,K2HPO4·3H2O 0.1,pH 7.0。
1.3 产低温蛋白酶菌种的筛选
初筛:吸取富集后的培养液用倍比稀释法制不同的稀释度移入初筛平板中,涂匀,15℃培养。待菌落长好后,挑选透明圈较大菌株,斜面保存。
温度复筛:以40℃为上限生长温度[12],即在该温度不生长的菌株为耐冷菌。将初筛得到的产蛋白酶菌株在初筛平板上点样,在40℃不生长的菌株,为试验菌株。
蛋白酶活力的测定:按照SB/T10317—1999规定的福林(Folin)试剂显色法测定酶活,进一步筛选出产酶能力强的菌株。底物2%的酪蛋白,pH 7.2磷酸盐缓冲液,15℃反应10 min,660 nm处测定OD值,计算酶活力。在上述条件下,1 mL酶液每分钟反应产生1 μg酪氨酸为1个酶活单位(U)。
1.4 菌种鉴定
1.4.1 菌落形态观察、生理生化试验
将所得菌株进行革兰氏染色,在电镜下观察菌株形态,参考《伯杰细菌鉴定手册》(第八版)[13]及《常见细菌系统鉴定手册》[14]进行生理生化鉴定。
1.4.216S rDNA PCR扩增和序列分析
扩增引物为通用引物,
上游引物(F):5'-AGAGTTTGATCCTGGCTCAG-3',
下游引物(R):5'-TACGGCTACCTTGTTACGACTT-3'。
PCR反应过程:94℃预变性4 min,94℃变性1 min,55℃退火1 min,72℃延伸2 min,35个循环;72℃补齐10 min。用标准PCR反应体系进行PCR扩增。PCR产物电泳(1.0%琼脂糖凝胶),回收目的片段,纯化产物连接pMD18-T载体,转入感受态E.coli DH5α,LB/Amp/X-Gal/IPTG平板上挑选白斑,抽提质粒,PCR鉴定阳性重组菌,送上海博尚生物技术有限公司测序。
1.4.3 系统发育树分析
利用CLUSTAL X将所测序列与Genbank中核酸序列进行比对,选用MEGA 5.0软件Kimura 2-parameter距离模型进行neighbour-joining分析生成系统发育树,并进行分析。
1.5 发酵条件优化
1.5.1 培养时间对菌体生长及产酶的影响
连续培养72 h,每隔6 h取1次样,测菌体生长量(OD600nm),同时制备粗酶液,测定酶活。
1.5.2 发酵温度对菌体生长及产酶的影响
分别在10、15、20、25、30、35℃下进行摇瓶,考察不同发酵温度对菌体生长和产酶的影响。
1.5.3 发酵培养基组成对产酶的影响
选取葡萄糖、酵母粉、酪蛋白、K+4个因子,采用4因素3水平正交表L9(34)设计正交实验,考察培养基组成对产酶的影响。
1.5.4 发酵条件对产酶的影响
选取种龄、起始pH、接种量、装液量4个因子,采用正交表L9(34)设计正交实验,考察不同发酵条件对产酶的影响。
1.6 粗酶酶学性质的研究
1.6.1 粗酶的最适温度和热稳定性
最适温度测定:将酶活力测定中的反应温度分别控制在10、15、20、25、30、35、40、45、50、55、65℃,其他条件不变,分别测定酶活。
热稳定性测定:将粗酶液分别置于25、35、45、55℃,保温15、30、45、60 min,冷却后测酶活。
1.6.2 粗酶的最适pH和pH稳定性
最适作用pH测定:配置不同pH的缓冲液,并用相应缓冲液配置2%酪蛋白溶液作底物,测定酶活。
pH稳定性测定:将用不同pH缓冲液处理的酶液分别放置在25℃下保温1 h后测酶活。其中pH 5.0~7.0用磷酸盐缓冲液,pH 8.0~9.0用Tris-HCl缓冲液,pH 10.0~11.0用硼砂-氢氧化钠缓冲液。
1.6.3 金属离子对酶活的影响
不同金属离子Fe2+、Mn2+、K+、Na+、Cu2+、Ca2+、Mg2+、Zn2+水溶液与等体积蛋白酶混合,使最终离子浓度为5 mmol/L,25℃反应15 min,测酶活性。
2 结果与讨论
2.1 产低温蛋白酶菌株的筛选
从天山冻土中通过酪蛋白平板法筛选到66株具有蛋白酶活性菌株,经温度复筛及Folin法测定酶活,筛选得到5株产蛋白酶活力较高的耐冷菌株,结果如表1所示。由表1可以看出,菌株N-8所产蛋白酶酶活最高,选取该菌做进一步研究。

表1 产蛋白酶菌株筛选结果
2.2 菌种鉴定
2.2.1 菌落形态
该菌为革兰氏阴性菌,菌体呈杆状,细胞单个,大小为(0.5~0.8)μm×(2.0~3.2)μm,有荚膜,有鞭毛(见图1);在酪蛋白平板上,菌落直径3~4 mm,呈圆形,乳白色,不透明,表面光滑,边缘整齐,易挑取,产生明显的透明圈。
2.2.2 生理生化特性
由表2生理生化特性可以发现,该菌株接触酶、精氨酸双水解酶、硝酸盐(还原)反应为阳性,能水解明胶,硫化氢试验、伏-普二氏试验(VP)、甲基红试验(MR)为阴性,不能发酵葡萄糖、乳糖、麦芽糖、蔗糖、纤维二糖、鼠李糖、棉子糖。

图1 N-8菌株透射电镜照片(5000×8)

表2 分离菌株的生理生化特性
2.2.3 系统发育树分析
经PCR扩增后,该菌株16S rDNA片段长约1500 bp,将其16S rDNA序列同NCBI数据库的相似序列进行同源性比较,如图2所示。Blast分析显示该菌与Pseudomonas extremaustralis 14-3在同一分支,二者序列相似性为99%。综合菌株的形态特征、生理生化特性、16S rDNA序列以及系统进化树的结果,可以将分离菌株归为Pseudomonas属,命名为Pseudomonas sp.N-8。
2.3 发酵条件优化
2.3.1 培养时间对菌体生长及产酶的影响
图3显示了培养时间对菌体产酶的影响。在对数生长期,虽然菌体生长旺盛,但酶活很低。随着稳定期到来,酶活迅速升高。该菌在48 h酶活最高,随着生长速度减慢,酶活也逐渐降低。从细菌生长曲线分析,酶的积累主要发生在对数生长后期,说明对数生长后期菌体不再大量繁殖,主要产生蛋白酶。因此酶的收获应控制在细菌生长稳定期。
2.3.2 培养温度对菌体生长及产酶的影响

图2 菌株Pseudomonas sp.N-8及相关细菌16S rDNA序列系统发育树
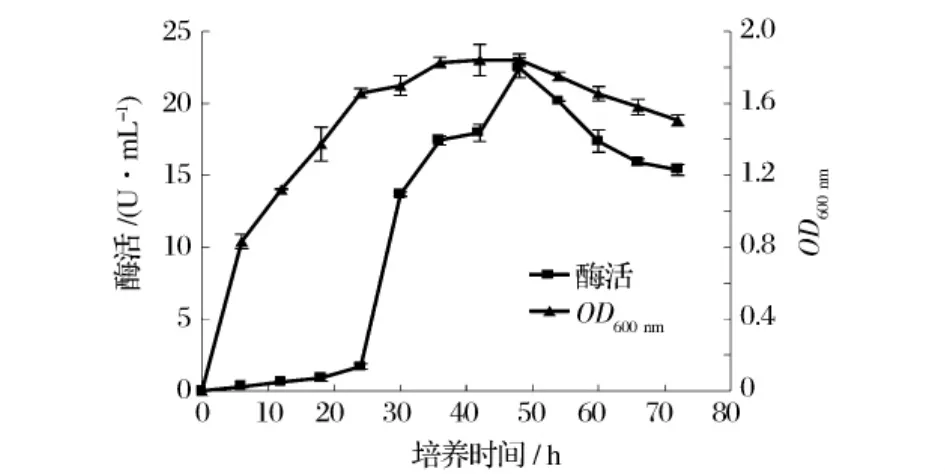
图3 培养时间对菌体产酶的影响
图4 显示培养温度对菌体产酶的影响。菌株在20℃菌体生长及产酶情况较好,温度高于或低于此温度菌体生长和产酶能力有明显下降的趋势。
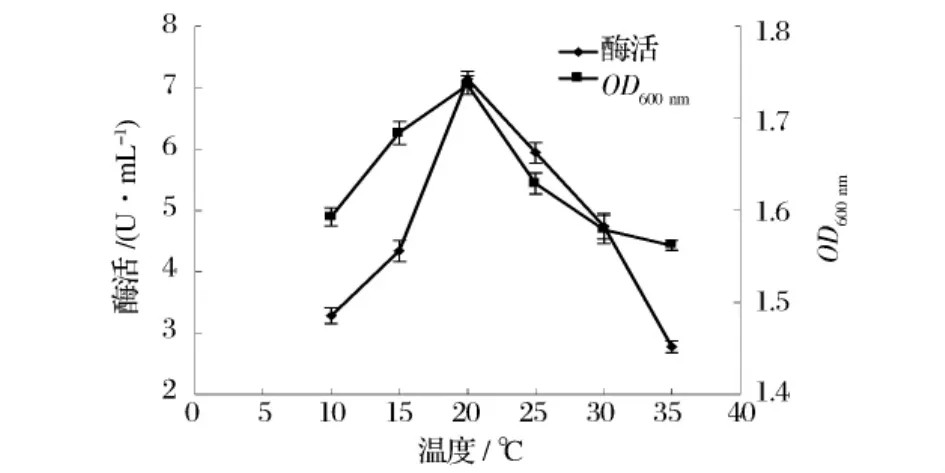
图4 培养温度对菌体产酶的影响
2.3.3 发酵培养基组成对产酶的影响
极差分析结果表明(表3),各因素对产酶的影响大小顺序为:酪蛋白>酵母粉>葡萄糖>K+;最佳培养基配方为(g/L):葡萄糖10,酵母粉8,酪蛋白20,K+0.4;按最佳组合测定发酵液酶活为47.34 U/mL。
2.3.4 发酵条件对产酶的影响
极差分析结果表明(表4),各因素对产酶的影响大小顺序为:种龄>起始pH>接种量>装液量;最佳培养条件为:种龄24 h,起始pH 7,接种量4%,装液量50 mL/250 mL。按最佳组合测定发酵液酶活为49.56 U/mL。

表3 培养基组成的正交试验设计与结果
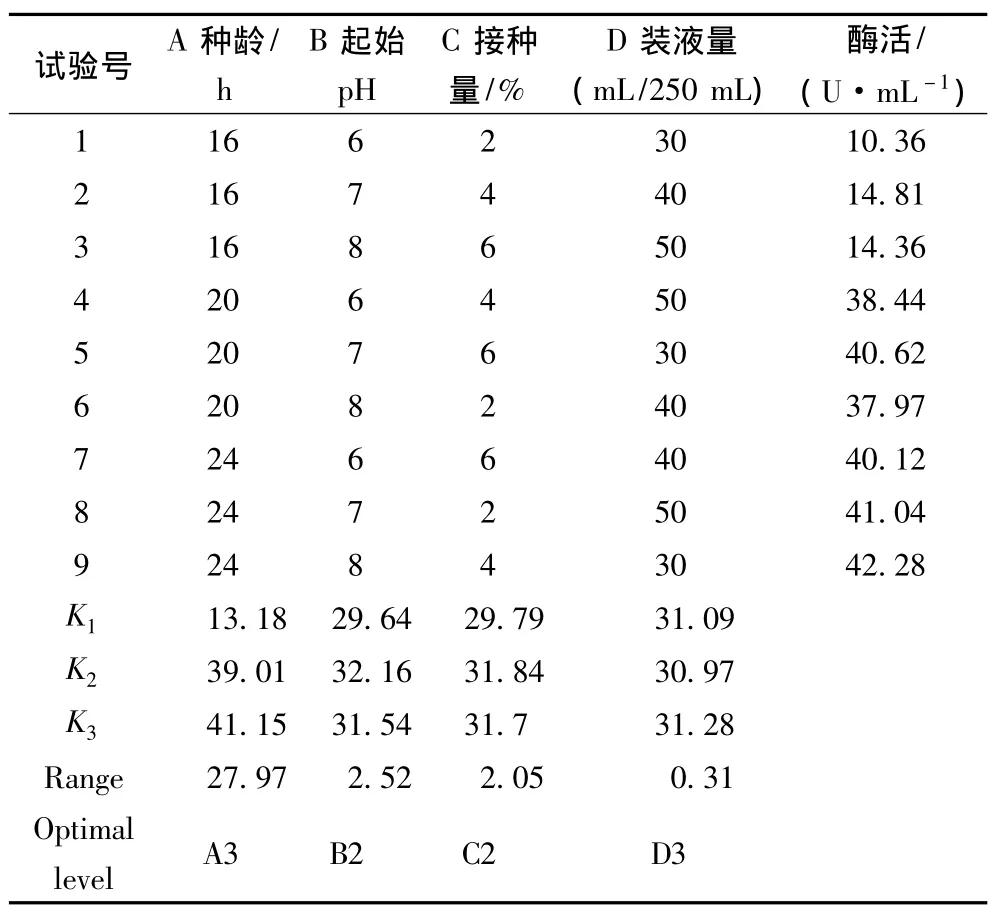
表4 发酵条件的正交试验设计与结果
2.4 粗酶酶学性质研究
2.4.1 粗酶的最适温度
温度对Pseudomonas sp.N-8产低温蛋白酶活力的影响结果如图5所示。该酶在10℃时可保持约60%的相对酶活,随着温度的升高,酶活逐渐提高,在25℃酶活最高,高于此温度酶活开始下降。在温度20~30℃范围内,低温蛋白酶都能保持较高的酶活,温度超过40℃,酶活急剧下降,65℃时酶活不足最高酶活的10%。因此,N-8所产蛋白酶的最适温度为25℃。
2.4.2 热稳定性
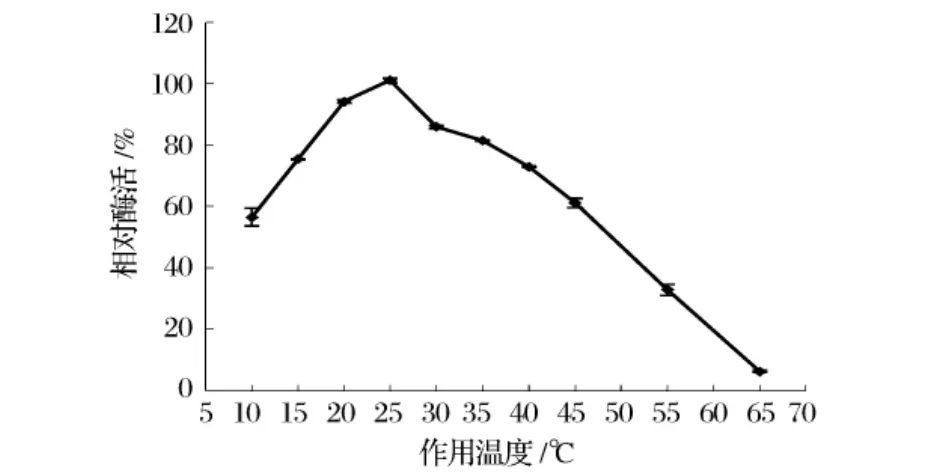
图5 酶的最适温度
菌株N-8所产低温蛋白酶热稳定性如图6所示。该酶在25℃呈现良好的稳定性,保温60 min仍可保持95%的酶活;在35、45℃保温45 min酶活丧失了20%左右;在55℃下保温30 min后酶活丧失了75%。这与报道的低温蛋白酶热稳定性相符,即在较高温度下(>50℃)酶可快速失活[2,3]。

图6 酶的热稳定性
2.4.3 粗酶的最适pH
pH对Pseudomonas sp.N-8产低温蛋白酶活性的影响结果如图7所示。菌株N-8所产低温蛋白酶最适pH为7.0,在pH 7.0~7.5范围内保持较高酶活。在酸性或碱性环境中,酶活大幅度下降。故菌株N-8所产低温蛋白酶为中性蛋白酶。

图7 酶的最适pH值
2.4.4 pH的稳定性
菌株N-8所产低温蛋白酶pH稳定性如图8所示。菌株N-8所产低温蛋白酶pH在7.0~8.0范围内相对酶活达到90%以上,在pH 5.0时酶活下降约40%,在pH 10.0时酶活下降约25%。说明菌株N-8所产低温蛋白酶在pH 7.0~8.0范围内呈现较好的稳定性。
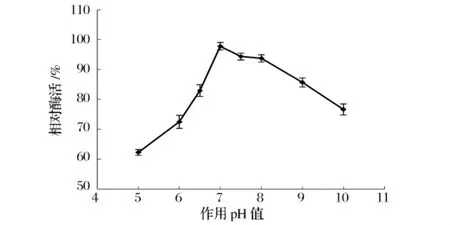
图8 酶的pH稳定性
2.4.5 金属离子对酶活的影响
金属离子对Pseudomonas sp.N-8产低温蛋白酶活性的影响结果如图9所示。K+、Cu2+、Ca2+、Mn2+对蛋白酶有不同程度的抑制作用,其中Cu2+的抑制作用明显;Fe2+、Mg2+、Na+、Zn2+对蛋白酶有不同程度的激活作用。

图9 金属离子对酶活的影响
3 结语
低温蛋白酶主要由生存在低温冷冻环境中的微生物产生,目前大多数产酶菌株是从南、北极和常年恒定在低温的极端环境中分离而得。本课题从新疆天山长年冷冻的土壤中分离获得1株产低温蛋白酶的菌株,经鉴定为Psedomonas属,并对其生长、产酶条件和粗酶性质做了初步研究。报道低温蛋白酶的最适酶活温度大部分为15~40℃,如史劲松等报道耐冷菌株SYP-A2-3所产低温蛋白酶的最适酶活温度为15℃[15],徐国英等报道Pseudoalterom onas sp.QI-1(假交替单胞菌属)所产蛋白酶的最适酶活温度为40℃[16]。本研究分离菌株产低温蛋白酶的最适温度为20℃,酶活最适作用温度为25℃,55℃保持30 min酶活丧失75%,65℃下作用酶活仅保留不到10%。本文筛选的菌株为今后低温酶的嗜冷机制研究及其在食品、洗涤剂、化妆品、皮革等工业上的应用研究奠定基础。
[1]张明,顾燕玲,徐宇丽,等.天山1号冰川底部沉积层产-半乳糖苷酶低温菌株的系统发育分析及生理多样性[J].微生物学报,2011,51(12):1605-1615.
[2]Margesin R,Dieplinger H,Hofmann J,et a1.A cold-active extracellular metalloprotease from Pedobacter cryoconitis:production and properties[J].Research in Microbiology,2005,156(4):499-505.
[3]Quanfu W,Yanhua H.Purification and properties of an extracellular cold-active protease from the psychrophilic bacterium Pseudoalteromonas sp.NJ276[J].Biochemical Engineering Journal,2008,38(3):362-368.
[4]Rahman R N,Geok L P,Basri M.An organic solvent-stable alkaline protease from Pseudomonas aeruginosa strain K:Enzyme purification and characterization[J].Enzyme and Microbial Technology,2006,39(7):1484-1491.
[5]王跃军,孙谧,洪义国.黄海黄杆菌YS-9412-130低温碱性蛋白酶的制备工艺研究[J].水产研究,2001,22(2):11-19.
[6]Nakasone N,Toma C,Song T,et al.Purification and characterization of a novel metalloprotease isolated from Aeromonas caviae[J].FEMS Microbiology Letters,2004,207(1):127-132.
[7]Kulakova L,Galkin A,Nakayama T,et al.Improvement of thermostability of cold-active serine alkaline protease from the psychrotrophic bacterium Shewanella sp.strain Ac10 by rational mutagenesis[J].Journal of Molecular Catalysis B:Enzymatic,2003,22(1/2):113-117.
[8]Venugopal M,Saramma A V.Characterization of alkaline protease from Vibrio fluvialis strain VM10 isolated from a mangrove sediment sample and its application as a laundry detergent additive[J].Process Biochemistry,2006,41:1239-1243.
[9]Yinxin Z,Bo Ch,Yang Z,et al.Polar microorganisms,a potential source for new natural medicines:a review[J].Acta Microbiologica Sinica,2008,48(5):659-700.
[10]林念炜,张锐,赵晶,等.南极产低温蛋白酶菌株Marinobacter sp.R2的发酵条件及酶学性质研究[J].厦门大学学报,2004,43(6):866-869.
[11]刘静,闵行,章骥,等.一株产低温蛋白酶菌株的筛选及纯酶研究[J].浙江大学学报,2006,32(3):251-256.
[12]吴虹,郑穗平.低温微生物适应低温的分子机制[J].生命的化学,2001,21(2):163-164.
[13]Buchanan R E,Gibbens N E.伯杰细菌鉴定手册[M].8版.北京:科学出版社,1984:274-325.
[14]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:128-190.
[15]史劲松,吴奇凡,许正宏,等.中国冰川1号产适冷蛋白酶耐冷菌的分离鉴定及产酶条件[J].微生物学报,2005,45(2):258-262.
[16]徐国英,林学政,王能飞,等.产低温蛋白酶极低菌株的筛选及Pseudoalterom onas sp.QI-1产蛋白酶粗酶性质[J].生物加工过程,2010,8(2):56-60.
ABSTRACTAstrain producing the cold-adapted protease has been isolated from the frozen soil of the Tianshan Mountains,China.Based on the morphological,physiological,biochemical properties and 16S rDNA sequence analysis,the strain was identified as Pseudomonas sp.N-8.Fermentation conditions were optimized by single factor and orthogonal experiments.The optimal medium components were determined as follows:10 g/L glucose,8 g/L yeast powder,20 g/L casein,0.4 g/L KH2PO4,pH 7.0.The research on the properties of crude enzyme showed that the optimal pH and temperature for activity were 7.0 and 25℃,respectively.As to the thermal stability of the cold-adapted protease,it was stable over the range of 25~45℃.The test of pH stability indicated that the cold-adapted protease was more stable within pH 7.0~8.0.The protease activity was inhibited by Cu2+,K+,Ca2+,and Mn2+,but it was stimulated by Fe2+,Mg2+,Na+,and Zn2+.
Key wordspsychrotrophs,cold-adapted protease,enzymatic properties,Psedomonas
Screening,Identification of Pseudomonas sp.N-8 producing Cold-adapted Protease and the Study on Enzymatic Properties
Qi Dan-dan1,Yang Rui-jin2,Hua Xiao2,Shen Lian-lian1,Zhang Wen-bin2,Zhao Wei2
1(State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
2(School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
硕士研究生(杨瑞金教授为通讯作者)。
*江苏省自然科学基金“疏水纳米微环境中β-半乳糖苷酶转糖基反应机制的研究”(编号BK2011149),以乳糖异构化为目标的葡萄糖异构酶定向改造研究中高通量筛选模型的建立(其他)
2012-03-20,改回日期:2012-04-27

