高效降解褐藻胶新菌种的筛选、鉴定及产酶条件优化*
魏丹,窦文芳,李恒,李会,许正宏,,史劲松
1(江南大学 医药学院,江苏 无 锡,214122)
2(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)
高效降解褐藻胶新菌种的筛选、鉴定及产酶条件优化*
魏丹2,窦文芳1,李恒1,李会1,许正宏1,2,史劲松1
1(江南大学 医药学院,江苏 无 锡,214122)
2(江南大学工业生物技术教育部重点实验室,江苏无锡,214122)
以褐藻酸钠为唯一碳源,从腐烂的海带中筛选出1株高效降解褐藻胶的菌株,根据其形态学特征、生理生化特性和16S rDNA序列分析鉴定该菌株属于白蚁菌属(Isoptericola),命名为嗜盐白蚁菌WX(Isoptericola halotolerans WX)。菌株WX的最佳培养基组成为:褐藻酸钠6 g/L、蛋白胨5 g/L、酵母粉2.5 g/L、NaCl 25 g/L、MgSO42 mmol/L、CaCl20.5 mmol/L、KH2PO41 mmol/L、FeSO40.2 mmol/L、MnSO40.3 mmol/L;摇瓶最佳培养条件为:250 mL三角瓶装瓶量50 mL,pH 8.0,培养温度25℃,摇床转速180 r/min,培养时间44 h。2 mmol/L Mg2+和0.2 mmol/L Fe2+对酶活力有明显的促进作用。在优化后的培养条件下,褐藻胶裂解酶活力达到432 U/mL,较优化前提高了13倍。此外,嗜盐白蚁菌WX同时具有淀粉酶和褐藻胶裂解酶活性,具有广泛的应用前景。
褐藻胶裂解酶,嗜盐白蚁菌,褐藻寡糖,筛选,产酶条件优化,淀粉酶
褐藻胶是一种酸性多糖,为β-D-甘露糖醛酸(β-D-1,4-mannuronic acid,简称M)和α-L-古洛糖醛酸(α-L-1,4-guluronicacid,简称G)以C-1,4糖苷键非均聚形成的线性分子,无分支和侧链,相对分子质量可达3.2万~18.6万[1]。褐藻寡糖是褐藻胶的降解产物,具有抗肿瘤、抗凝血、抗氧化作用,还能够促进多种植物的根部生长,起到延长植物生命周期的作用。褐藻胶裂解酶可通过β-消去反应降解褐藻胶,并在非还原性末端C 4,5之间形成不饱和双键[2],是褐藻寡糖的酶法制备的主要途径。
根据底物专一性,褐藻胶裂解酶可分为聚甘露糖醛酸裂解酶(EC 4.2.2.3)和聚古罗糖醛酸裂解酶(EC 4.2.2.11)[3]两种类型。目前已发现50多种褐藻胶裂解酶,主要来源于海洋藻类、软体动物、海洋细菌、陆生真菌及少数噬菌体和病毒[4-7],通过富集褐藻附生菌并进行筛选可以获得产酶菌株,但大多数菌株产酶水平较低,如不动杆菌X8、Microbulbifer species 6532A和Bacillus amyloliquefaciens所产褐藻胶裂解酶分别为157.3 U/mL、114.8 U/mL和6.48 U/mL(紫外法)[8-10],而且这些酶受底物专一性影响,对褐藻胶的降解位点较少,是酶法制备褐藻寡糖的主要限制因素。因此,筛选高效降解褐藻胶新菌种,寻找适合褐藻寡糖生产的特异性褐藻胶裂解酶对开发褐藻胶资源,探索高值化利用新途径,扩大褐藻寡糖在药品、功能食品、植物生长调节剂等领域的应用具有十分迫切的意义。
本研究从腐烂的海带中筛选得到1株具有低底物专一性、高褐藻胶裂解酶活力的菌株,通过形态学特征、生理生化特性、16S rDNA基因序列分析进行菌种鉴定,并对其产酶条件进行初步探索,为酶学性质研究及褐藻寡糖的酶法制备奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品来源
腐烂的海带,采自于连云港中大海藻工业有限公司,4℃密闭保存。
1.1.2 培养基
(1)富集培养基与初筛培养基(g/L):(NH4)2SO45,K2HPO42,NaCl 30,MgSO4·7H201,FeSO4·7H2O 0.01,褐藻酸钠5,琼脂15,pH 7.5。
(2)种子培养基与发酵培养基(g/L):蛋白胨5,酵母提取物1,褐藻酸钠5,NaCl 30,pH 7.5。
1.2 产褐藻胶裂解酶菌株的筛选
将连续驯化5代的培养液用无菌生理盐水按照10-5到10-10进行梯度稀释,吸取0.1 mL的稀释液涂布到初筛培养基平板上。28℃恒温培养72 h后,观察菌落形态,选取生长良好且具有透明水解圈的菌株,接入到发酵培养基中,28℃、200 r/min培养48 h,测定发酵上清液中的酶活力。
1.3 褐藻胶裂解酶的活力测定方法
改良的DNS(3,5-二硝基水杨酸)法:由于褐藻酸钠的热不稳定性,对DNS法进行适当改良。取0.1 mL酶液加入1 mL 1%褐藻酸钠溶液(0.05 mol/L、pH 7.0的Na2HPO4-NaH2PO4缓冲液配制)中,40℃反应20 min后,加入1 mL DNS溶液,沸水浴反应3 min,迅速冷却后定容至10 mL,用紫外分光光度计于520 nm下测定吸光值。
1个酶活力单位(U)定义为:1 mL酶液在上述条件下,每分钟产生1 μg还原糖所需要的酶量。
1.4 菌株WX的鉴定
1.4.1 形态学特征与生理生化特征鉴定
将菌株WX涂布于初筛培养基平板上,28℃培养48 h,观察细胞形态和菌落特征。部分生理生化鉴定参照《伯杰细菌鉴定手册》。
1.4.216S rDNA鉴定[11]
利用通用引物[12]对菌株WX进行16S rDNA基因序列的扩增。将克隆后的样品送至上海生工生物技术公司进行测序。测序结果在GenBank中进行BLAST序列比对,确定种属。遵循邻接法和最大相似法原则,应用CLUSTAL、MEGA4.0等软件进行聚类分析与同源性分析,构建系统发育树。
1.5 产酶条件的优化
在250 mL三角瓶中装入20 mL发酵培养基,按2%(体积分数)接种种子液,于28℃,200 r/min摇瓶培养48 h后测定褐藻胶裂解酶酶活力。所有实验均设3个平行。前一步优化结果用于后续实验。
2 结果与分析
2.1 褐藻胶降解菌株的筛选
通过富集培养,从腐烂的海带中筛选出10株能在以0.5%(w/v)褐藻酸钠为唯一碳源的平板上生长且形成透明水解圈的菌株,大部分为细菌。根据Hc值(透明圈直径/菌落直径)能够初步判断褐藻胶裂解酶活力的大小。挑选Hc>2的10株菌株进行摇瓶复筛,对其产酶能力进行比较,结果表明,菌株WX发酵液酶活力最高,并且经5代遗传稳定性培养证明该菌株的产酶能力较稳定,故作为下一步继续研究的菌株。
2.2 菌株WX鉴定
2.2.1 形态学特征
菌株WX在初筛平板上培养48 h后,菌落呈圆形,黄色,不透明,表面湿润光滑。菌株WX为短杆状或近似球形,无鞭毛,无孢子,有荚膜(图1),革兰氏染色阳性。

图1 菌株WX的透射电镜图
2.2.2 生理生化特性
菌株WX可在20~40℃,pH 5.5~11.0的条件下生长,最适温度为25℃,最适pH为8.0。最高能够耐受30%的NaCl,在含有4%的NaCl中生长最旺盛。其余生理生化特性如表1所示。白蚁菌DSM 10177T(Isoptericola variabile DSM 10177T)[13]是白蚁菌属(Isoptericola)唯一的一个有效种。比较两者生理生化特征,基本相同,进一步验证菌株WX属于白蚁菌属。但在利用果糖、甘露醇及MR实验存在差异性,表明菌株WX可能是白蚁菌属潜在的一个新种。
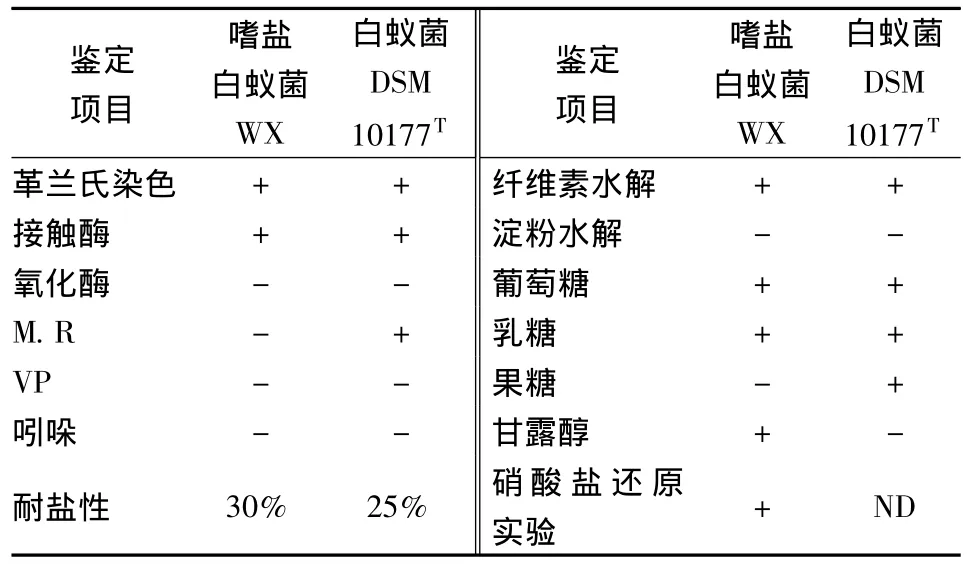
表1 嗜盐白蚁菌WX与嗜盐白蚁菌DSM 10177T生理生化特征比较
2.2.316S rDNA基因序列及系统发育树分析
测序得到菌株WX的16S rDNA基因序列含有1481 bp(GenBank登录号:JQ288840)。系统发育树表明(图2),菌株WX与Isoptericola halotolerans(AB489222)亲缘关系最近,16S rDNA序列相似性为100%。同时结合菌株的形态学特征和生理生化特性,将其归类为白蚁菌属(Isoptericola),命名为嗜盐白蚁菌WX(Isoptericola halotolerans WX)。

图2 菌株WX的16S rDNA序列系统发育树
嗜盐白蚁菌属隶属于放线菌(Actinobacteria),是Stackebrandt等[14]近期才提议成立的一个新属。到目前为止,该属只包含了唯一的一个有效种I.variabile DSM 10177T。Zhang等[13]从青海分离了1株嗜盐白蚁菌I.halotolerans YIM 70177T,并对其特性进行了初步研究。而通过生理生化特征比较,本文所筛选的嗜盐白蚁菌WX(I.halotolerans WX)与白蚁菌DSM 10177T(I.variabile DSM 10177T)存在一定差异,表明菌株WX可能是白蚁菌属潜在的一个新种,但仍需要根据这两株菌株的细胞化学组成分析及基因组DNA-DNA的杂交结果来定论。
2.3 产酶条件优化
2.3.1 碳源对产酶的影响
主要研究了果糖、乳糖、褐藻酸钠、麦芽糖、淀粉、蔗糖、海藻糖、葡萄糖、甘油、山梨醇分别作为碳源时对菌株WX的产酶情况的影响。结果表明,只有以褐藻酸钠为唯一碳源时,褐藻胶裂解酶才具有降解活性。因此可以推测菌株WX所产的褐藻胶裂解酶为诱导酶。据文献报道,大多数褐藻胶裂解酶均属于诱导酶[15]。在此基础上,进一步研究了不同浓度的褐藻酸钠对菌株WX产酶的影响。图3表明,当褐藻酸钠浓度为0.6%时,褐藻胶裂解酶活性最高。原因可能是培养基的黏度增加影响菌株产酶,也可能是作为唯一碳源的褐藻酸钠虽然是诱导菌株WX分泌褐藻胶裂解酶的必要诱导物,但底物浓度过高可能会影响该菌株的正常代谢。
2.3.2 氮源对产酶的影响

图3 褐藻酸钠浓度对菌株WX菌体浓度和产酶的影响
氮源是微生物生长和代谢所需营养物质的重要来源,也是构成酶的重要成分。本文选取了0.5%(w/v)的无机氮源、有机氮源与复合氮源进行比较(图4)。结果显示,嗜盐白蚁菌WX能在多种氮源条件下生长,但在无机氮源(硫酸铵、氯化铵、草酸铵)中生长缓慢,未检测到酶活。而在有机氮源中同时具有较高的生物量和酶活,其中酵母粉与蛋白胨为最佳组合氮源,最适配比为5 g/L和2.5 g/L。复合氮源不仅能较好的促进菌体的生长,更有益于产酶能力的提升,推测可能原因是蛋白胨、酵母粉等有机氮源经酶、酸、碱水解后获得的胨、肽、氨基酸等组成的水溶性混合物,更容易被菌株分解利用,从而促进菌株生长[16]。

图4 蛋白胨与酵母粉浓度对菌株WX生长和产酶的影响

表2 不同氮源对菌株产酶的影响
2.3.3 NaCl及金属离子对产酶的影响
在以上工作基础上,考察了不同浓度NaCl(0~4%)对菌株WX产酶的影响(图5)。不同浓度的NaCl对菌株WX的生长和产酶均有显著的促进作用,这可能与该菌株原生环境密切有关,菌株WX产酶的最适NaCl浓度为25 g/L。不同种类的金属离子对菌株WX的生长影响不明显,其对产酶能力的影响见表3。结果表明,当Mg2+、Fe2+的添加浓度分别为2 mmol/L和0.2 mmol/L时,褐藻胶裂解酶的酶活力提高近1倍;而Fe3+、Cu2+、Zn2+表现为抑制作用(图6)。

表3 不同金属离子对菌株WX产酶的影响

图5 NaCl浓度对菌株WX菌体浓度和产酶的影响

图6 金属离子对菌株WX产酶的影响
实验发现,NaCl对菌株WX所产的褐藻胶裂解酶具有重要作用。当培养基中不含有NaCl时,菌株WX几乎不产酶。另外实验中发现,分离纯化后的褐藻胶裂解酶在NaCl不存在时也表现出一定活性,因而推测NaCl可能是菌株WX合成褐藻胶裂解酶途径中的必需物,或是通过改变细胞膜的通透性影响了该酶的分泌。具体原因还需后续实验探索。此外,NaCl及一些金属离子对褐藻胶裂解酶具有明显地促进作用,使其酶活力提高了近1.5倍。原因可能是NaCl及金属离子可以破坏底物周围的水分子,使酶与底物充分结合;也可能是其能够影响酶与底物结合时的电荷,使之形成更稳定的酶与底物复合物[17]。
2.3.4 培养基初始pH对产酶的影响
培养基初始的pH值直接影响着菌体细胞的通透性、稳定性以及代谢产物酶系的活性,而且通过影响培养基中营养物质的离子化程度,间接影响着微生物对营养物质的吸收。如图7所示,菌株WX生长、产酶最适pH为8.0,这与已报道的海洋细菌来源的褐藻胶裂解酶的适宜pH均为6~8相一致[18]。说明该菌株适合在偏碱环境下生长、产酶,酸性条件易使酶的结构发生变化,从而影响裂解酶的活力。该结果也与氮源的利用相符合。微生物利用无机氮源时,体系pH往往是降低的,而复杂氮源能够缓冲体系的pH变化,为菌体生长、产酶创造良好的环境。
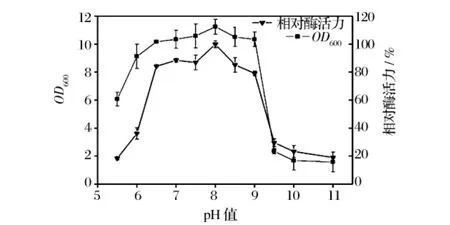
图7 pH值对菌株WX菌体浓度和产酶的影响
2.3.5 培养温度、装液量和摇床转速对产酶的影响
菌体细胞的生长是由一系列严格有序的生化反应所组成,而生化反应受温度影响较大,故温度对菌体细胞的生长和产酶具有显著的影响。将菌株WX在20℃、25℃、30℃、35℃、40℃、50℃下进行发酵培养,其产酶结果显示,菌株WX最佳培养温度为25℃。先前的研究也表明,大多数褐藻胶降解菌产酶的适宜温度范围为25~30℃。
装液量也是制约菌种生长及产酶的一个重要因素。装瓶量过少,水分容易挥发,过大则溶氧降低,影响菌体生长,导致产酶下降。于250 mL三角烧瓶中分别加入10、20、35、50、65、80、95、110 mL发酵培养基,考察装液量对菌株WX产酶的影响。实验结果表明,装液量为50 mL时,褐藻胶裂解酶活力最高,说明该菌株对通气量要求不是十分严格。
试验还测定了不同摇瓶转速(150 r/min、180 r/min、210 r/min、240 r/min)对菌株WX产酶的影响。结果显示摇瓶转速对菌株WX生长及产酶作用不明显,适宜转速为150~180 r/min。
2.4 菌株WX的发酵产酶曲线
在最佳培养基和最适条件下,考察了菌株WX的发酵产酶情况(图8)。分析图8可知,菌株WX生物量在于40 h达到最大,发酵液中酶活力于44 h达到最高,为432 U/mL,即菌株发酵产酶的最高点出现在菌体生长的稳定期之后,产酶与生长表现出一定的偶联性,但在时间上略微滞后。故所产的褐藻胶裂解酶属于生长半偶联型,即酶合成伴随细胞生长而开始,但在细胞生长进入稳定期后酶仍可以延续合成一段较长时间。此类酶的合成不受产物的反馈抑制或分解代谢物的阻遏,所对应的mRNA较稳定[19],为褐藻胶裂解酶的工业化生产提供了可能。

图8 菌株WX的生长曲线和产酶曲线
另外,通过透明圈实验发现,菌株WX可以产生淀粉酶催化淀粉水解,说明该菌株具有淀粉酶活性,是否具有其他生物酶活性尚在研究中。刘妍等[20]已在澳大利亚厚皮海绵中筛选出了21株具有多重生物酶活性,同时具有褐藻胶裂解酶和淀粉酶活性。此外,实验发现,嗜盐白蚁菌WX所产的褐藻胶裂解酶为双功能酶,既可以降解聚古罗糖醛酸嵌段,又可以降解聚甘露糖醛酸嵌段,但更易作用于难于降解的聚古罗糖醛酸嵌段。目前,只有少数菌株可以产生双功能的褐藻胶裂解酶,此酶的发现无疑为生产具有生物活性的低聚合度褐藻寡糖提供了可能。因此,这株隶属于放线菌的嗜盐白蚁菌WX(I.halotolerans WX)具有极大的潜在开发和应用价值。
3 结论
(1)本文从腐烂的海带中筛选出1株稀有菌株WX,经形态学特征、生理生化特征和分子鉴定将其归为白蚁菌属,命名为嗜盐白蚁菌WX(Isoptericola halotolerans WX)。目前,褐藻胶裂解酶主要来源于假单胞菌、弧菌、固氮菌等,尚未有白蚁菌属分泌该酶的报道。同时,本文在国内外首次报道了产褐藻胶裂解酶的白蚁菌属(Isoptericola)菌株的选育。
(2)产酶优化实验表明,嗜盐白蚁菌WX的最佳培养基组成为:褐藻酸钠6 g/L、蛋白胨5 g/L、酵母粉2.5 g/L、NaCl 25 g/L、MgSO42 mmol/L、CaCl20.5 mmol/L、KH2PO41 mmol/L、FeSO40.2 mmol/L、Mn-SO40.3 mmol/L;摇瓶最佳培养条件为250 mL三角瓶装瓶量50 mL,pH 8.0,培养温度25℃,摇床转速180 r/min,培养时间44 h。
(3)嗜盐白蚁菌WX具有产酶时间短、生长速度快的特点,且所产褐藻胶裂解酶具有较高活性(432 U/mL),是规模化生产褐藻寡糖的优势菌株。该酶属于生长半偶联型,可以通过延长菌株生长周期、提高菌体量进一步提高酶活性。此外,该酶的双功能性和双重酶活性大大提升了该菌株的应用价值,对其研究具有一定意义。
[1]Gacesa P.Enzyme Degradation of Alginates[J].International Journal of Biochemistry,1992,24(4):545-552.
[2]Wong TY,Preston LA,Schiller NL.Alginate lyase:Review of Major Sources and Enzyme Characteristics,Structure-Function Analysis,Biological Roles,and Applications[J].Annual Review of Microbiology,2000,54:289-340.
[3]Sawabe T,Ohtsuka M,Ezura Y.Novel alginate lyases from marine bacterium Alteromonas sp.strain H-4[J].Carbohydrate Research,1997,304(1):69-76.
[4]Sim SJ,Baik KS,Park SC,et al.Characterization of alginate lyase gene using a metagenomic library constructed from the gut microflora of abalone[J].Journal of Industrial Microbiology and Biotechnology,2011,39(4):585-593.
[5]Li LY,Jiang XL,Guan HS,et al.Three Alginate Lyases from Marine Bacterium Pseudomonas fluorescens HZJ216:Purification and Characterization[J].Applied Biochemistry and Biotechnology,2011,164(3):305-317.
[6]Hu X,Jiang X,Hwang HM.Purification and characterization of an alginate lyase from marine bacterium Vibrio sp.mutant strain 510-64[J].Current Microbiology,2006,53(2):135-140.
[7]Kim DE,Lee EY,Kim HS.Cloning and characterization of alginate lyase from a marine bacterium Streptomyces sp.ALG-5[J].Marine Biotechnology,2009,11(1):10-16.
[8]侯保兵,刘书来,张建友,等.褐藻胶裂解酶产生菌的发酵优化研究[J].水产科学,2009,28(11):667-670.
[9]刘玉佩,汪立平,赵勇,等.解淀粉芽孢杆菌产褐藻胶裂解酶的发酵条件优化[J].湖南农业科学,2010,5(23):17-20.
[10]Wakabayashi M,Sakatoku A,Noda F,et al.Isolation and characterization of Microbulbifer species 6532A degrading seaweed thalli to single cell detritus particles[J].Biodegradation,2011,23(1):93-105.
[11]Weisburg WG,Barns SM,Pelletier DA,et al.16S ribosomal DNA amplification for phylogenetic study[J].Journal of Bacteriology,1991,173(2):697-703.
[12]Cello FD,Bevivino A,Chiarini L,et al.Biodiversity of a Burkholderia cepacia Population Isolated from the Maize Rhizosphere at Different Plant Growth Stages[J].Applied and Environment Microbiology,1997,63(11):4485-4493.
[13]Zhang YQ,Schumann P,Li WJ,et al.Isoptericola halotolerans sp.nov.,a novel actinobacterium isolated from saline soil from Qinghai Province,north-west China[J].International Journal of Systematic and Evolutionary Microbiology,2005,55(5):1867-1870.
[14]Stackebrandt E,Schumann P,Cui XL.Reclassification of Cellulosimicrobium variabile Bakalidou et al.2002 as Isoptericola variabilis gen.nov.,comb,nov.[J].International Journa of Systematic and Evoutionary Microbiology,2004,54(3):685-688.
[15]Momma K,Okamoto M,Mishima Y,et al.A novel bacterial ATP-binding cassette transporter system that allows uptake of macromolecules[J].Journal of Bacteriology,2000,182(14):3998-4004.
[16]张宁宁.褐藻酸降解菌株S3的筛选分离及培养条件和产酶能力[J].东北林业大学学报,2010,38(10):106-108.
[17]马悦欣,纪涛,李慧琼,等.假交替单胞菌LJ1菌株产褐藻胶裂解酶的培养条件优化及酶学性质[J].微生物学报,2009,49(8):1086-1094.
[18]李丽妍,管华诗,江晓路,等.海藻工具酶——褐藻胶裂解酶研究进展[J].生物工程学报,2011,27(6):838-845.
[19]郭勇.酶工程[M].第三版.北京:科学出版社,2009:116-120.
[20]刘妍,李志勇.具有多重酶活性的澳大利亚厚皮海绵共附生放线菌的研究[J].生物技术通报,2006(5):121-125.
ABSTRACTA high efficient novel alginate-degrading microorganism was isolated from rotten seaweed using sodium alginate as the sole carbon source.Based on the morphological,physiological characteristics and 16S rDNA sequence,the strain was identified as Isoptericola halotolerans WX.The optimized fermentation medium was composed of sodium alginate 6.0 g/L,tryptone 5.0 g/L,yeast extract 2.5 g/L,NaCl 25.0 g/L,MgSO42 mmol/L,CaCl20.5 mmol/L,KH2PO41 mmol/L,FeSO40.2 mmol/L,and MnSO40.3 mmol/L.The optimal culture condition was that the strain was cultured in 250 mL shake flasks containing 20 mL medium with shaking speed of 180 r/min and initial pH 8.0 at 25℃for 44 h.Besides,2 mmol/L Mg2+and 0.2 mmol/L Fe2+had remarkable effect on enzyme activity.Under the optimized conditions,the activity of alginate lyase was increased significantly from 32 U/mL to 432 U/mL,around 13-fold compared with the state without optimization.Additionally,Isoptericola halotolerans WX was demonstrated to possess the activity of amylase,which confers its extensive potential applications.
Key wordsalginate lyase,Isoptericola halotolerans,alginate oligosaccharides,isolation,fermentation optimization,amylase
Isolation,Identification,and Fermentation Optimization of a High Efficient Novel Alginate-degrading Strain
Wei Dan2,Dou Wen-fang1,Li Heng1,Li Hui1,Xu Zheng-hong,Shi Jin-song1
1(School of Medicine and Pharmaceutics,Jiangnan University,Wuxi 214122,China)
2(Key Laboratory of Industrial Biotechnology,Ministry of Education,Jiangna University,Wuxi 214122,China)
硕士研究生(史劲松教授为通讯作者,E-mail:shijs@163.com)。
*十二五国家科技支撑计划项目(2012BAD33B06),中央高校基本科研业务费专项资金(JUSRP31101),江苏省自然科学基金(BK2009065)
2012-03-22,改回日期:2012-05-04

