啤酒花多糖的提取及脱蛋白工艺研究
乔茜茜,祁 英,孙建忠,刘玉梅
(新疆大学化学化工学院,新疆乌鲁木齐830046)
啤酒花多糖的提取及脱蛋白工艺研究
乔茜茜,祁 英,孙建忠,刘玉梅*
(新疆大学化学化工学院,新疆乌鲁木齐830046)
以超临界液态二氧化碳萃取后的啤酒花残渣为原料,采用正交实验和单因素实验,确定了啤酒花多糖的热水微波辅助萃取的最佳工艺条件:提取时间2h,料液比1∶10,提取温度90℃,微波功率750W作用时间12min;此条件下多糖提取率为2.76%。对得到的粗多糖,以蛋白脱除率和多糖保留率为指标,在比较Sevag法,盐酸-正丁醇法,三氯乙酸-正丁醇法,木瓜/菠萝蛋白酶法对粗多糖中蛋白质的脱除效果的基础上,考察了酶法和化学法联用脱蛋白工艺,并最终确定菠萝蛋白酶-三氯乙酸-正丁醇的脱蛋白效果最好,最佳条件为温度45℃,酶解时间0.5h,酶添加量22.5U/mL,pH5.5,三氯乙酸-正丁醇法除蛋白1次,蛋白脱除率和多糖保留率分别为86.77%和77.37%;而木瓜蛋白酶-盐酸-正丁醇的脱蛋白工艺在有效脱除蛋白质的同时,多糖损失最少,最佳条件为温度55℃,酶解时间0.5h,酶添加量36U/mL,pH5.5,盐酸-正丁醇法除蛋白1次,蛋白脱除率和多糖保留率分别为77.37%和84.43%。
啤酒花,多糖,提取,脱蛋白
Abstract:The hops were pre-processed which use supercritical carbon dioxide extraction as samples.The optimal extraction processing parameters were investigated by orthogonal experiments combined with single factor experiments.The best technological conditions for hot distilled water extraction by microwave-assisted was extraction time of 2h,ratio of solid-liquid 1∶10,extraction temperature of 90℃ and 750W of microwave power for 12min,and the yield of polysaccharides from hops was up to 2.76%under this condition.Protein removal rate and polysaccharide retention rate were used to evaluate and compare the effectiveness for several methods,namely Savage method,hydrochloric acid-n-butanol,trichloroacetic acid(TCA)-n-butanol,papain/bromelain method.Based on the investigation,the combinatorial method between enzymatic hydrolysis and chemical method was used to evaluate the technical of deproteinization.Bromelain-TCA-n-butanol was found to be the best method for the deproteinization of hop crude polysaccharides.The optimal operating conditions of Bromelain-trichloroacetic acid(TCA)-n-butanol method were temperature 45℃,hydrolysis time 0.5h,substrate concentration 22.5U/mL of bromelain and pH5.5 followed by once treatment with trichloroacetic acid(TCA)-n-butanol method,the amount of protein removed was 86.77%while polysaccharide remained 77.37%during the deproteinization process.But compared with the loss rate of polysaccharide,the papainhydrochloric acid-n-butanol method was better.The optimal operating conditions of papain-hydrochloric acid-n-butanol method were temperature 55℃ ,hydrolysis time 0.5h,substrate concentration 36U/mL of bromelain and pH5.5 followed by once treatment with hydrochloric acid-n-butanol method,the amount of protein removed was 77.37%while polysaccharide remained 84.43%during the deproteinization process.
Key words:hop;polysaccharides;extraction;deproteinization
啤酒花,学名蛇麻(Humulus Lupulus L.),是桑科律草属多年蔓生草本植物,主要用于啤酒酿造。近年来的研究发现,啤酒花中除含有影响啤酒风味质量的挥发性成分和苦味树脂类成分外,其中的多酚和类黄酮类物质还具有非常重要的药理活性作用,已从中分离和鉴定出了数百种化合物[1],但对啤酒花中的多糖类物质的研究相对较少。研究表明,多糖类物质在生物体内不仅是能量来源或结构材料,更重要的是它参与了各种重要的生命活动,具有可与蛋白质、核酸相比拟的信息功能,与蛋白质、核酸一样,糖类也是涉及生命活动本质的三类生物大分子之一[2-3]。早期人们普遍认为多糖类物质本身没有活性,但随着研究的深入,多糖类物质的结构和活性逐渐被研究人员揭示,许多动植物多糖类物质均展现出了很强的生物活性,如:降血脂、降血糖、抗肿瘤、增强免疫力、抗氧化和抑菌等作用[4-8],部分已被医学界在临床上用于肿瘤、肝炎和心血管疾病等的辅助和康复治疗,因此,对植物多糖的研究已成为当今国内外研究热点之一[9]。本文基于前期的研究工作,考察了啤酒花多糖的提取和脱蛋白工艺,旨在为啤酒花中多糖类物质的进一步研究和开发利用提供数据参考。
1 材料与方法
1.1 材料与仪器
啤酒花(品种为马可波罗) 新疆三宝乐农业科技开发有限公司,采用超临界液态二氧化碳萃取后的啤酒花残渣,实验前采用95%的乙醇进一步脱除其中小分子量的单糖和部分杂质,低温干燥后备用;木瓜蛋白酶(活力单位>800U/mg)、菠萝蛋白酶(活力单位>500u/mg) 上海源叶生物科技有限公司;考马斯亮蓝G-250、苯酚(重蒸)、浓硫酸、葡萄糖、95%乙醇、浓磷酸、氯仿、正丁醇、三氯乙酸等试剂 均为分析纯。
R-501旋转蒸发仪 上海申科机械研究所;BS210S电子天平 德国赛多利斯,读数精度:0.1mg,称重范围:0~210g;UV-5300紫外/可见分光光度计上海元析仪器有限公司;PHS-3DpH计 上海精密仪器有限公司雷磁仪器厂;79-1磁力加热搅拌器 江苏省金坛市医疗仪器厂;HH-S4数显恒温水浴锅 金坛市医疗仪器厂;LD4-2离心机 北京医用离心机厂;WP750L23-6微波炉 格兰仕。
1.2 实验方法
1.2.1 粗多糖的提取及含量测定 啤酒花粗多糖的提取:称取适量上述处理的啤酒花样品置于烧杯中,按一定料液比、提取温度和提取时间在热水浴中浸提3次,冷却后过滤,合并清液,清液经减压浓缩至一定体积后,加入95%乙醇,使多糖溶液中乙醇浓度为80%,醇沉24h取底部析出的粗多糖配成一定体积的溶液。采用苯酚-硫酸法[10]测定其吸光度,以葡萄糖为标准样品,横坐标为葡萄糖浓度,纵坐标为吸光值,绘制标准曲线,根据标准曲线计算其含量。其标准曲线方程为A=0.02271+9.29524C,相关系数R=0.9995,线性范围0.01~0.09mg/mL。据此计算出样品中啤酒花多糖的含量(式1)并根据测定结果计算多糖提取率。
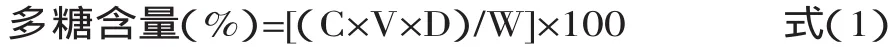
式中:C为样品溶液多糖浓度(mg/mL);V为样品溶液体积(mL);D为样品溶液稀释倍数;W:样品质量(mg)。

1.2.2 粗多糖中蛋白质含量的测定 蛋白质含量的测定采用考马斯亮蓝法[11]。以牛血清白蛋白为标准样品,横坐标为牛血清白蛋白浓度,纵坐标为吸光值,绘制蛋白质的标准曲线,根据标准曲线计算。根据数据进行回归分析得到标准曲线方程:A=0.05697+0.75183C,相关系数R=0.99889,线性范围0.1~0.9mg/mL。据此计算出样品中蛋白的浓度,再根据式(2)计算蛋白的含量。
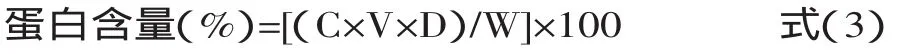
式中:C为样品溶液蛋白浓度(mg/mL);V为样品溶液体积(mL);D为样品溶液稀释倍数;W:样品质量(mg)。
1.2.3 粗多糖脱蛋白方法
1.2.3.1 Sevag法[12]取2g/100mL粗多糖溶液50mL,加入其1/4体积的Sevag试剂(V氯仿∶V正丁醇=4∶1),磁力搅拌20min,3000r/min离心5min弃去沉淀,取上层清液再加入Sevag试剂按上述方法重复操作,分别取每次离心后的上清液测定其蛋白含量和多糖含量,确定Sevag法最佳的脱蛋白次数。
1.2.3.2 木瓜(papain)/菠萝蛋白酶(bromelain)法[13]木瓜蛋白酶或菠萝蛋白酶取0.05g,用蒸馏水溶解,精确定容50mL,得到酶液最终浓度为1mg/mL,pH为7.0。将粗多糖溶液(2g/100mL)放入37℃水浴锅中预热10min,在一定温度和一定pH下加入蛋白酶,酶解一定时间后,离心,取上清液测定溶液中蛋白含量和多糖含量。选取酶添加量、酶解时间、温度、pH四个因素,各取三个水平,进行L9(34)正交实验,以获得最佳酶法脱蛋白条件。
1.2.3.3 盐酸(HCl)/盐酸-正丁醇法(HCl-n-butanol)
取5份20mL粗多糖溶液(2g/100mL),分别加入2mol/L的盐酸溶液调节pH至2.0、2.5、3.0、3.5、4.0,4℃静置过夜。次日3000r/min离心20min,弃去沉淀收集上清液,测定上清液中蛋白质含量和多糖含量[14]。确定最佳条件后,向其加入正丁醇(V多糖溶液∶V正丁醇=5∶1),磁力搅拌20min,3000r/min离心5min,弃去上层蛋白质,取下层清液再加入正丁醇重复操作,分别取每次离心后的清液测定其蛋白含量和多糖含量,通过分析脱蛋白次数对多糖溶液中多糖含量和蛋白含量的影响,确定最佳的脱蛋白条件。
1.2.3.4 三氯乙酸(TCA)/三氯乙酸-正丁醇法(TCA-n-butanol) 取5份20mL粗多糖溶液(2g/100mL),分别加入5%的TCA溶液调节pH至2.0、2.5、3.0、3.5、4.0,4℃静置过夜。次日3000r/min离心20min,弃去沉淀收集上清液,测定上清液中蛋白质含量和多糖含量[15]。确定最佳条件后,按1.2.3.3盐酸-正丁醇法中正丁醇的处理方法进行后续脱蛋白操作,确定最佳的脱蛋白条件。
1.2.3.5 木瓜/菠萝蛋白酶-Sevag法(papain/bromelain-Sevag) 将粗多糖溶液(2g/100mL)放入37℃水浴锅中预热10min,按1.2.3.2得到的木瓜/菠萝蛋白酶脱蛋白最优条件对样品脱蛋白实验,再按1.2.3.1 Sevag法最佳的脱蛋白条件处理后,即得木瓜/菠萝蛋白酶-Sevag法的脱蛋白溶液,测定其蛋白含量和多糖含量,确定此法的蛋白脱除率和多糖保留率。
1.2.3.6 木瓜/菠萝蛋白酶-盐酸-正丁醇法(papain/bromelain-HCl-n-butanol) 将粗多糖溶液(2g/100mL)放入37℃水浴锅中预热10min,按1.2.3.2得到的木瓜/菠萝蛋白酶脱蛋白最优条件进行脱蛋白实验,再按1.2.3.3盐酸-正丁醇法所述实验条件脱蛋白一次后,即得木瓜/菠萝蛋白酶-盐酸-正丁醇法的脱蛋白溶液,测定其蛋白含量和多糖含量,确定此法的蛋白脱除率和多糖保留率。
1.2.3.7 木瓜/菠萝蛋白酶-三氯乙酸-正丁醇法(papain/bromelain-TCA-n-butanol) 将粗多糖溶液(2g/100mL)放入37℃水浴锅中预热10min,按1.2.3.2得到的木瓜/菠萝蛋白酶脱蛋白最优条件进行脱蛋白实验,再按1.2.3.4三氯乙酸-正丁醇法所述实验条件脱蛋白一次后,即得木瓜/菠萝蛋白酶-三氯乙酸-正丁醇法的脱蛋白溶液,测定其蛋白含量和多糖含量,确定此法的蛋白脱除率和多糖保留率。
1.2.4 啤酒花多糖保留率及蛋白脱除率的计算
1.3 统计分析
实验数据的统计分析结果均是采用Microsoft Excel或Origin Pro 8.0专业软件来处理的,实验数据表示为平均值(n≥3)±标准偏差。
2 结果与讨论
2.1 啤酒花多糖提取正交实验
啤酒花粗多糖的提取是采用水提醇沉的方法完成的。本实验以提取温度、料液比、提取时间为考察因素,以粗多糖提取率为考核指标,选择L9(34)正交表设计了三因素三水平的正交实验,误差用空列来估计,结果见表1。
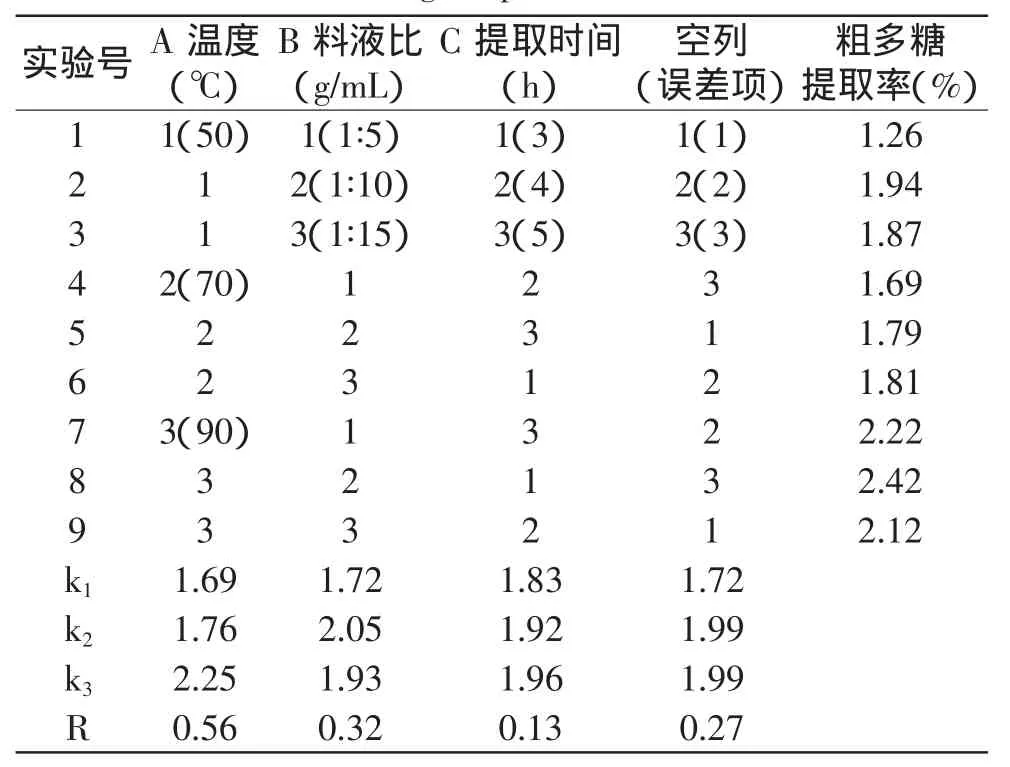
表1 正交实验结果Table 1 Results of three-factors,three-levels orthogonal array design experiments
对正交实验结果进行方差分析,结果见表2。
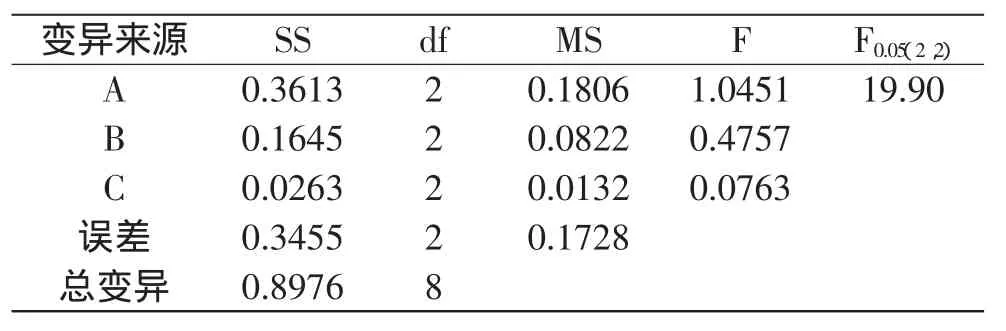
表2 方差分析表Table 2 Analysis of variance
由表1和表2可知,三个因素对啤酒花多糖提取率的影响均不显著,其中,误差项的极差大于提取时间的影响,可能是由于正交实验选择的时间因素范围较窄,未能反应出提取时间的影响,因此,时间的影响尚需通过进一步的单因素实验来考察。由正交实验经极差分析得到的最优组合为A3B2C3,即温度为90℃、料液比为1∶10、提取时间5h。此条件下多糖提取率为2.47%。
2.2 微波处理对多糖提取工艺的优化
由正交实验极差分析可知提取时间5h为最好的因素,但该实验组合并未出现在正交实验中,且正交实验所反映出的提取时间的选择也不完全恰当,因此,单因素实验中首先对提取时间对多糖提取率的影响进行了进一步的优化。同时,由于正交实验中并未对微波作用时间进行优化,单因素实验也对此条件进行了优化。
2.2.1 提取时间对粗多糖提取率的影响 本实验在正交实验确定了温度90℃、料液比1∶10、微波功率750W的条件下,采用单因素实验考察了微波辅助提取3min在1、2、3、4、5h提取时间下啤酒花多糖提取率依次为1.79%、2.37%、2.42%、2.43%和2.47%。结果表明,在1h和2h的提取条件下,多糖提取率增长比较明显,2h以后多糖提取率基本趋于平衡,这可能是由于随着时间的延长,多糖会水解,所以提取的时间不宜过长,同时为了减少能源的损耗,采用2h作为最佳提取时间。
2.2.2 微波作用时间对粗多糖提取率的影响 根据2.2.1的结果,3min微波辅助作用即可有效地提高萃取效率。考虑到当微波作用时间较短时,啤酒花多糖分子可能会释放不充分,因此,下列实验对在提取温度90℃、料液比1∶10、提取时间为2h、微波功率750W的条件下,采用单因素实验考察了微波作用时间在3、6、9、12、15min下啤酒花多糖提取率依次为2.37%、2.52%、2.65%、2.76%和2.79%。结果表明,随着微波作用时间的增长,多糖提取率依次升高,但是12min和15min多糖提取率趋于稳定,为了减少能耗,同时避免由于微波作用可能会造成多糖的损失,最终选择微波作用时间为12min。
比较上述正交实验和单因素实验结果可知,优化后的啤酒花多糖的最佳提取工艺条件为提取温度90℃、料液比1∶10、提取时间2h、期间采用微波辅助萃取12min。由于蛋白质的溶解性与多糖相似,采用水提醇沉法所得到的粗多糖中蛋白质的含量也较高,由上述工艺所得啤酒花多糖粗提物中经测定多糖含量为15.85%,蛋白质含量为22.75%。因此,为了提高多糖的含量以便进一步纯化样品,又对啤酒花多糖粗提物中蛋白质的脱除工艺进行了研究。
2.3 啤酒花粗多糖脱蛋白工艺的研究
脱蛋白是对多糖进行纯化的第一步,多糖中的蛋白质主要以两种形式存在,一是以纯糖链,另一种是糖链与肽链结合,形成的糖肽或糖蛋白。多糖脱蛋白并不是为了彻底去除蛋白,主要是脱除游离蛋白。本实验以蛋白脱除率和多糖保留率来考察啤酒花粗多糖中蛋白质的脱除效果,比较了Sevage法、木瓜/菠萝蛋白酶法、盐酸-正丁醇法、三氯乙酸(TCA)-正丁醇法以及酶法分别和上述几种方法结合对脱除啤酒花粗多糖中蛋白质的工艺条件,通过方法组合和工艺优化确定最优方案。
2.3.1 Sevag法 图1为Sevag法进行脱蛋白的实验结果。结果表明,随着Sevag法重复操作次数的增加,蛋白脱除率逐渐升高,但总体上脱除对蛋白质的脱除效率不高,且重复4次后蛋白脱除率基本不再变化,而多糖保留率会随对蛋白脱除次数的增加逐渐下降。这可能是由于Sevag试剂反复处理后形成的凝胶物中会夹带少量多糖物质,并且少量与多糖结合很牢或被多糖包裹的糖蛋白也难以用Sevag法彻底脱除,同时,与蛋白结合的糖蛋白也容易发生凝聚沉淀,将会导致样品中多糖保留率的下降。此外,实验过程中使用的有机溶剂氯仿和正丁醇不但容易造成多糖活性下降,而且还会造成有毒溶剂氯仿的残留。当Sevag法处理6次后,蛋白脱除率仅为23.73%、多糖保留率也下降到76.76%,即多糖中大部分蛋白仍未能去除。因此,啤酒花粗多糖脱蛋白不宜采用Sevag法。
2.3.2 木瓜/菠萝蛋白酶法 酶法脱蛋白在多糖纯化过程中应用较多,其操作过程简单,一次即可完成,并能减少多糖的损失;操作条件温和,有利于保持多糖的活性;酶解过程中蛋白酶可将蛋白质分解成小分子,可降低溶液浓度,有利于多糖溶出,且避免了有毒的有机溶剂带来的危害[16]。因此采用木瓜蛋白酶和菠萝蛋白酶进行正交实验考察脱蛋白工艺条件,从而选择出最优条件。由于酶活性对pH和温度比较敏感,酶解时间和酶浓度会影响蛋白脱除率,因此以酶解温度、酶解时间、酶添加量、pH为考察因素,采用加权评分法对其正交实验结果进行统计分析。采用了L9(34)正交实验设计,进行了四因素三水平实验。本实验结果分析采用综合加权评分法,评分公式为:综合指数(%)=脱蛋白率(%)×2+多糖保留率(%)。表3为木瓜蛋白酶的正交实验的因素水平和正交实验结果;表4为菠萝蛋白酶的正交实验的因素水平和正交实验结果。
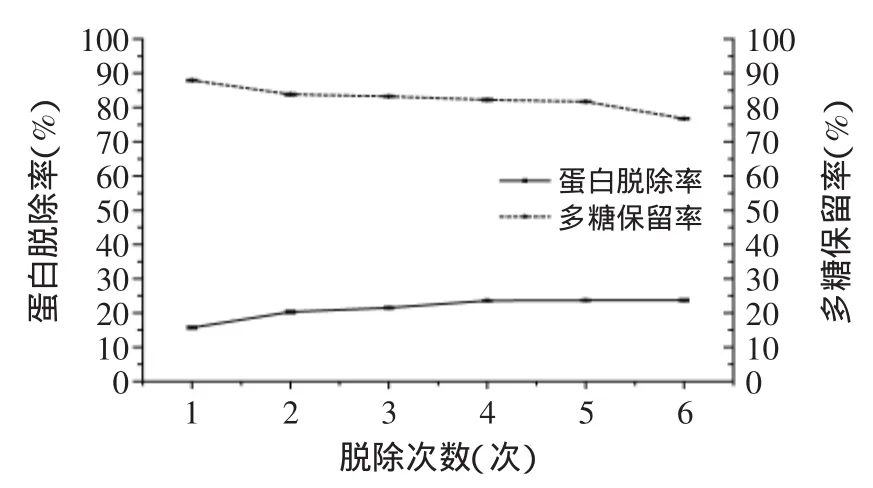
图1 Sevag法对蛋白脱除率及多糖保留率的影响Fig.1 Effect of Sevag method on the protein removal rate and polysaccharide retention rate
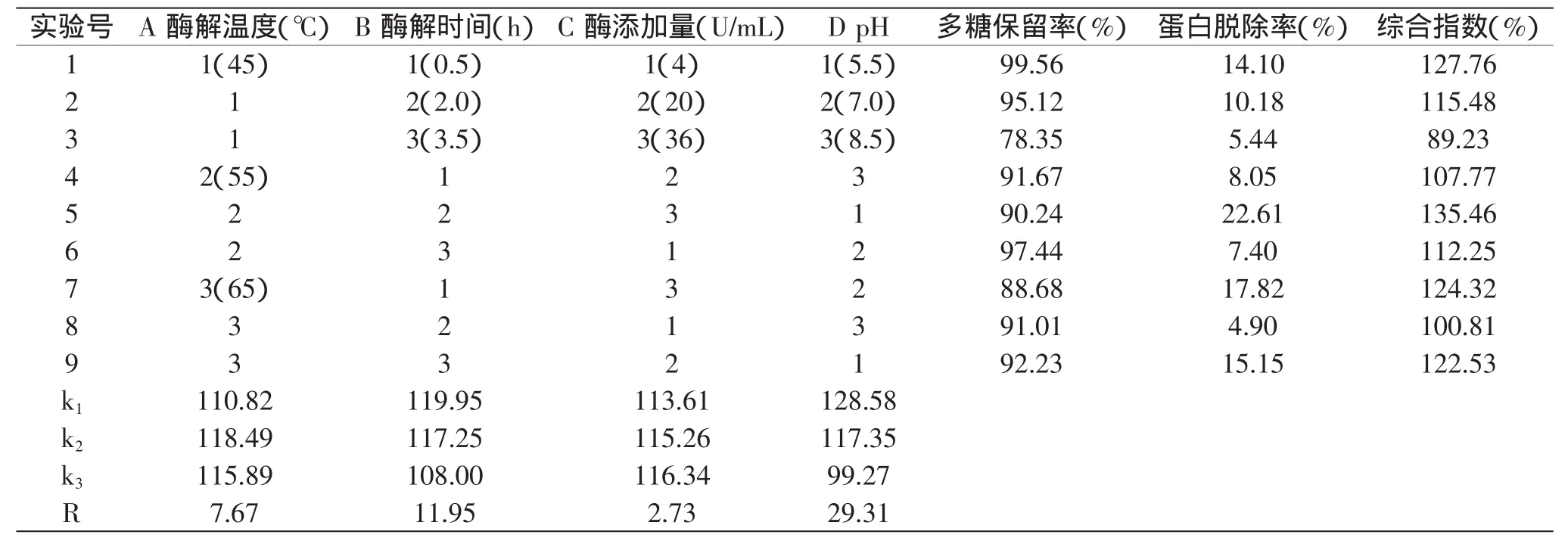
表3 木瓜蛋白酶正交实验结果Table 3 Results of four-factors,three-levels orthogonal array design experiments

表4 菠萝蛋白酶正交实验结果Table 4 Results of four-factors,three-levels orthogonal array design experiments
由表3极差分析结果可以看出,影响木瓜蛋白酶法蛋白脱除率的因素依次为:pH>酶解时间>酶解温度>酶添加量。最优水平组合为A2B1C3D1,即酶解温度为55℃、酶解时间为0.5h、酶添加量为36U/mL、pH为5.5。此条件下,蛋白脱除率为22.71%,多糖保留率为92.34%,综合指数为137.76%。
由表4极差分析结果可以看出,影响菠萝蛋白酶法蛋白脱除率的因素依次为:pH>酶解时间>酶添加量>温度。最优水平组合为A2B1C3D1,即温度为45℃、酶解时间为0.5h、酶添加量为22.5U/mL、pH为5.5。此条件下,蛋白脱除率为26.73%,多糖保留率为89.41%,综合指数为142.87%。
由以上结果可以看出,酶法对多糖中蛋白的脱除率较低,可能是由于这两种蛋白酶对啤酒花中蛋白质的专属性较差,因此,单一使用酶法很难将多糖粗提取物中的蛋白质除去。
2.3.3 盐酸-正丁醇法 图2为单独采用盐酸进行脱蛋白的实验结果。结果表明,随着反应液pH的增大,溶液中蛋白脱除率逐渐下降,但在pH>3后变化不明显,多糖保留率则呈逐渐上升的趋势,其保留率都在90%之上,在pH为4时,多糖的保留率甚至达到了96.58%。当反应液pH为2时,蛋白脱除率最高可达47.42%,此时多糖保留率也可达90.51%,故确定pH=2时为盐酸脱蛋白的最优条件。图3为盐酸-正丁醇法进行脱蛋白的实验结果。结果表明,此法脱蛋白效果要比单独采用盐酸进行脱蛋白和Sevag法脱蛋白效果明显。反应液中蛋白脱除率随着正丁醇脱蛋白次数的增加而不断增大,在处理3次后蛋白脱除率趋于平稳,而多糖保留率却随着脱蛋白次数的增加而不断减小,多糖保留率较低。这可能是由于实验中正丁醇试剂的反复使用中夹带少量多糖物质,造成凝聚,导致多糖保留率降低。故确定盐酸-正丁醇法最佳的脱蛋白条件为pH=2,正丁醇处理3次,其蛋白脱除率为77.13%、多糖保留率为73.56%。
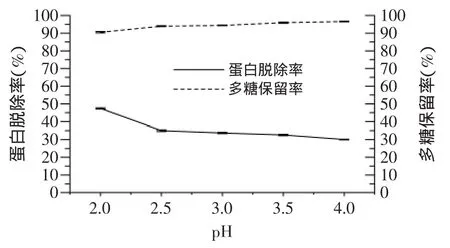
图2 盐酸法对蛋白脱除率及多糖保留率的影响Fig.2 Effect of hydrochloric acid method on the protein removal rate and polysaccharide retention rate
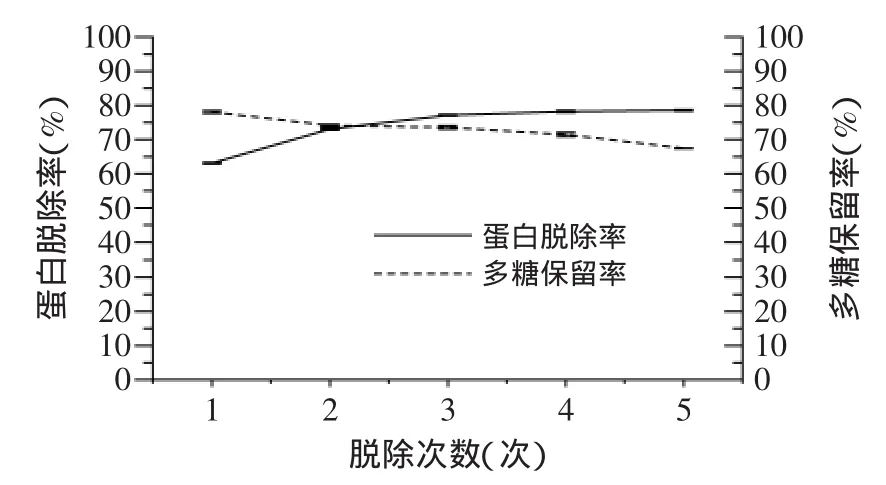
图3 盐酸-正丁醇法对蛋白脱除率及多糖保留率的影响Fig.3 Effect of hydrochloric acid-n-butanol method on the protein removal rate and polysaccharide retention rate
2.3.4 三氯乙酸-正丁醇法 图4为单独采用三氯乙酸进行脱蛋白的实验结果。结果表明,随着反应液酸度的增大,溶液中蛋白脱除率逐渐上升,而多糖保留率则呈逐渐下降趋势。这可能是由于随着酸度的增大,即三氯乙酸用量的加大,其与蛋白质结合生成的沉淀会吸附一部分的多糖,造成多糖保留率明显下降。当反应液pH=2时,蛋白脱除率达到最高值为55.56%,此时多糖保留率为82.89%,效果较好,故确定pH=2是三氯乙酸脱蛋白的最佳条件。图5为三氯乙酸-正丁醇法进行脱蛋白的实验结果。结果表明,此法与盐酸-正丁醇法的脱蛋白率和多糖保留率相比,其变化趋势相一致,且其脱蛋白率与盐酸-正丁醇法的结果基本相同,但其多糖保留率较低,在使用正丁醇处理3次后,其多糖保留率仅有62.91%。故确定三氯乙酸-正丁醇法最佳的脱蛋白条件为pH=2,正丁醇处理3次,其蛋白脱除率为77.88%、多糖保留率为62.91%。
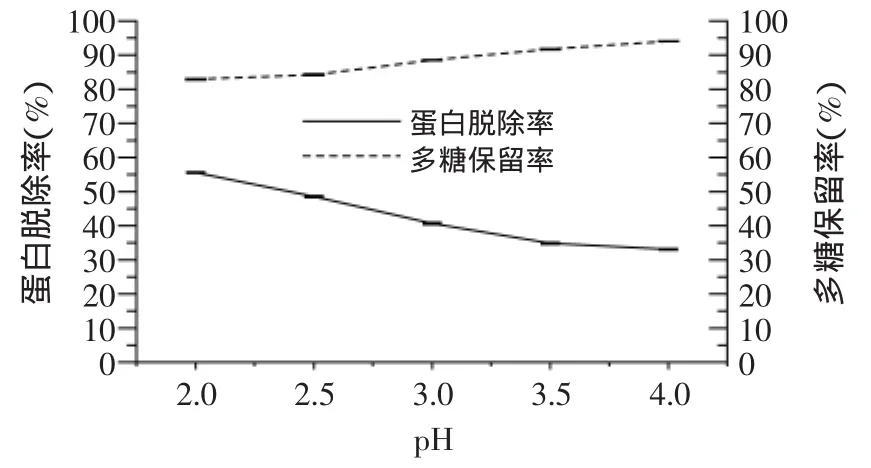
图4 三氯乙酸法对蛋白脱除率及多糖保留率的影响Fig.4 Effect of trichloroacetic acid method on the protein removal rate and polysaccharide retention rate
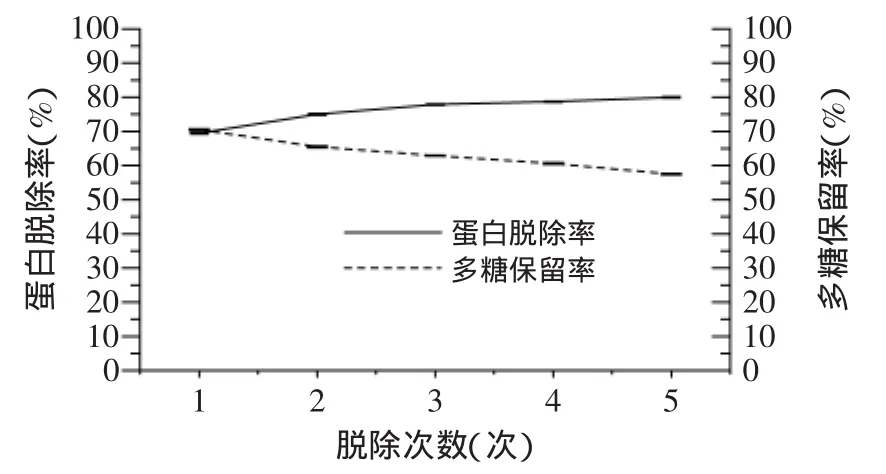
图5 三氯乙酸-正丁醇法对蛋白脱除率及多糖保留率的影响Fig.5 Effect of trichloroacetic acid-n-butanol method on theprotein removal rate and polysaccharide retention rate
2.3.5 酶法联用进行脱蛋白结果比较 采用Sevag法进行脱蛋白,其效率较低,且需重复多次,增加了多糖随凝胶物沉淀而损失的可能。采用盐酸-正丁醇法和三氯乙酸-正丁醇法进行脱蛋白,其蛋白脱除率较Sevag法有很大地提高,但多糖损失较大,且正丁醇的反复使用有可能导致部分多糖的降解。考虑到酶法条件温和,可以使大部分的游离蛋白质和部分结合蛋白水解,应该可以减少溶剂的处理次数,因此下列实验比较了上述方法与酶法联用对多糖中蛋白质的脱除效果,结果见表5。
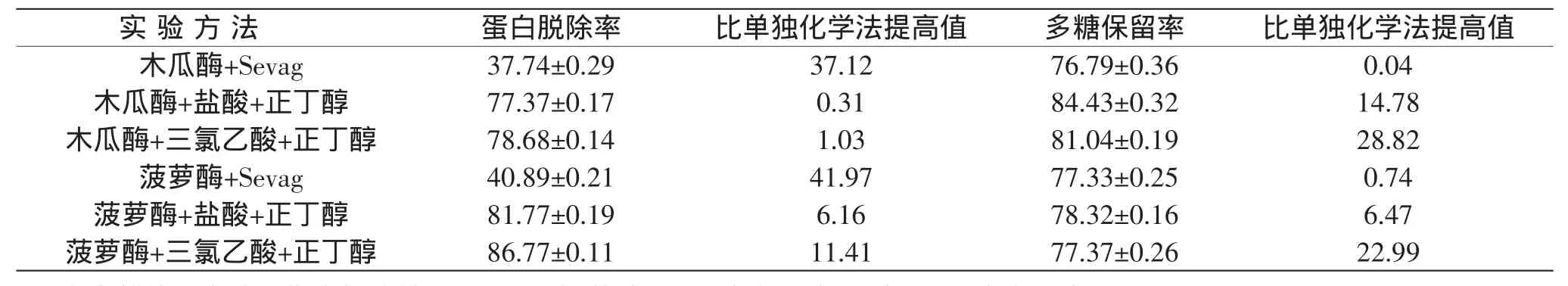
表5 各种脱蛋白方法的结果比较(%)Table 5 Comparisons of protein removal rates and polysaccharide retention rate by different deproteinization methods(%)
由表5可知,酶法与化学法联用脱除啤酒花多糖中蛋白质的效果明显优于单独采用酶法或化学法脱蛋白效果,同时由于溶剂处理次数减少,多糖保留率也均有提高。其中,酶法与Sevag法联用的蛋白脱除率提高的效果最为明显,可能是由于一些与多糖结合很牢或被多糖包裹的蛋白无法被Sevag法单独除去,采用酶法联用可以将少许蛋白降解下来,同时减少了溶剂的使用次数。但总体分析,酶-盐酸/三氯乙酸-正丁醇法的蛋白脱除率和多糖保留率明显高于酶-Sevag法。其中,菠萝蛋白酶-三氯乙酸-正丁醇的脱蛋白效果最为理想,经过1次处理后,蛋白脱除率和多糖保留率分别为86.77%和77.37%,基本能将粗多糖中的蛋白除去,同时并没有造成多糖过度的损失。而木瓜蛋白酶-盐酸-正丁醇法脱蛋白的效果略低,但多糖的保留率得到了有效地提高,也不失为一种较好的工艺条件。
3 结论
近年来的研究表明,许多植物中的多糖类物质均具有一定的生理活性,但往往由于资源缺乏或含量较低,对其有效利用并非易事。啤酒花为新疆的特色经济作物,在其加工过程中有约80%以上的萃余物被废弃,如能提取并分离其中的多糖类物质,从中筛选活性较高的啤酒花多糖组分,对扩大植物活性多糖的来源和拓展啤酒花的使用范围,增加综合利用的价值均具有一定的意义。本文通过正交实验和单因素实验的比较,得到了啤酒花多糖的最佳提取方法为采用热水微波辅助萃取工艺:提取时间2h、提取温度90℃、料液比1∶10、微波作用时间12min;在此条件下啤酒花多糖的提取率为2.76%。对提取得到的粗多糖,可采用酶-盐酸/三氯乙酸-正丁醇法的方法进行脱蛋白处理,经此处理后,可得到多糖含量约为60%左右,而蛋白质含量低于1%的啤酒花多糖提取物。该方法溶剂使用量小,操作简单,可得到初步提纯后的啤酒花多糖样品,为进一步的纯化和结构分析、鉴定奠定了研究基础。
[1]刘玉梅.啤酒花的化学成分及药理作用研究进展[J].食品科学,2009,30(23):521-527.
[2]金城,张树政.糖生物学与糖工程的兴起与前景[J].生物工程进展,1995,15(3):12-17.
[3]David J Schaeffer,Vietor S Krylov.Anti-HIV activity of extracts and compounds from algae and cyanobacteria[J].Eeotoxicology and Environmental Saefty,2000,45:207-227.
[4]陈义勇,顾小红,汤坚.桦褐孔菌多糖IOP3a的分离纯化及其体外抗肿瘤活性研究[J].食品科学,2010,31(15):91-94.
[5]翟蓉,吕丽爽,金邦荃.何首乌多糖降血脂作用的研究[J].食品与机械,2010,26(15):87-91.
[6]郭庆启,张娜,张岭.微波辅助提取仙人掌多糖工艺条件及抑菌效果的研究[J].中国调味品,2010,35(10):97-100.
[7]于淑池,周俊波,彭忠,等.安吉白茶多糖的微波辅助提取及其抗氧化活性[J].食品与发酵工业,2010,36(6):180-183.
[8]弓建红,许小华,王俊敏,等.白扁豆多糖对正常小鼠体内抗氧化和免疫实验研究[J].食品工业科技,2010,31(9):337-338.
[9]仰榴青,徐佐旗,吴向阳.银杏多糖的研究进展[J].食品科学,2004,25(11):372-375.
[10]乔茜茜,祈英,刘玉梅.啤酒花多糖提取工艺研究及含量的测定[J].中国酿造,2011(4):52-54.
[11]王多宁,赵雁武,田芙蓉.考马斯亮蓝微盘比色法测定蛋白质含量[J].第四军医大学学报,2001,22(6):528-529.
[12]汪艳群,孟宪军,李冬男,等.五味子多糖脱蛋白工艺的研究[J].食品工业科技,2011(3):280-284.
[13]李勇,董玉玮,苗敬芝,等.牛蒡菊糖提取工艺的研究[J].食品科学,2009,30(18):202-205.
[14]董英,张艳芳,孙艳辉.水飞蓟粗多糖脱蛋白方法的比较[J].食品科学,2007,28(12):82-84.
[15]王传名,董祺,管从胜.日照绿茶粗多糖脱蛋白研究[J].食品工业科技,2010(8):274-276.
[16]张一芳,冯怡,徐德生,等.枸杞多糖酶法脱蛋白工艺研究[J].应用化工,2010,39(10):1532-1533.
Extraction and protein removal of polysaccharides from hops
QIAO Qian-qian,QI Ying,SUN Jian-zhong,LIU Yu-mei*
(College of Chemistry and Chemical Engineering,Xinjiang University,Urumqi 830046,China)
TS261
B
1002-0306(2012)16-0251-06
2012-02-01 *通讯联系人
乔茜茜(1986-),女,在读硕士,主要从事天然产物功能因子与分析检测的研究。
新疆维吾尔自治区科技支疆计划项目(200991247)。

