北虫草发酵过程中营养成分及代谢物变化研究
解春艳,凌 威,顾颖娟,顾振新,*
(1.廊坊师范学院生命科学学院,河北廊坊 065000;2.南京农业大学农业部农畜产品加工与质量控制重点开放实验室,江苏南京210095)
北虫草发酵过程中营养成分及代谢物变化研究
解春艳1,凌 威1,顾颖娟2,顾振新2,*
(1.廊坊师范学院生命科学学院,河北廊坊 065000;2.南京农业大学农业部农畜产品加工与质量控制重点开放实验室,江苏南京210095)
研究了北虫草摇瓶发酵过程中培养基营养成分及其代谢物质变化情况,测定了培养基的pH、总糖、还原糖和可溶性蛋白及游离氨基酸等成分含量,探明了北虫草菌体生长、多糖及虫草素生成规律。结果显示:随发酵时间的延长,发酵液的pH、可溶性固形物、总糖和还原糖含量均总体呈下降趋势;游离氨基酸含量呈先变化迟缓而后上升趋势;北虫草菌丝体及虫草素产量随时间延长先增加后下降;粗多糖含量总体略呈下降趋势。
北虫草,菌丝体,粗多糖,虫草素,液态深层发酵
Abstract:The change of the main nutriments of the medium and the metabolites during shake flash fermentation of Cordyceps militaris was investigated.The pH,total sugar,deoxidized sugar,free amino nitrogen and soluble protein was detected,and the growth of Cordyceps militaris and the production of crude polysaccharide and cordycepin were also determined.Results indicated that soluble solid components,total sugar and deoxidized sugar was reduced with prolong of the fermentation,and mycelium and cordycepin was increased firstly and then reduced.The content of free amino nitrogen was firstly changed slowly and then increased.The crude polysaccharide was reduced a few.
Key words:Cordyceps militaris;mycelium;crude polysaccharide;cordycepin;submerged fermentation
北虫草(Cordyceps militaris)又名北冬虫夏草、蛹虫草等,是我国名贵的药用真菌和新资源食品。其中富含虫草多糖、虫草素等特征功能成分[1-2],因而具有提高人体免疫力、缓解疲劳、抗肿瘤、抗衰老、降血脂等功能[3-6]。研究表明,人工培养的北虫草菌丝体与天然虫草具有相同的功效[7-8],可作为天然虫草的替代品。国内外学者也采用多种方法获得北虫草菌丝体[1,9],液态深层发酵因其发酵周期短、发酵条件易控制,是目前报道较多的一种发酵方法。发芽糙米、豆粕和大麦芽中富含有充足的碳源、氮源和微量元素,已证实北虫草可在上述原料组成的培养基中良好生长[10]。本文采用前期优化得到的上述几种原料混合而成的物质为发酵培养基,在确定的最佳发酵条件下培养,以期对发酵过程中培养液的主要营养成分、pH和北虫草特征代谢产物进行探讨。
1 材料与方法
1.1 材料与仪器
北虫草 CM-3菌株,购自江苏省农科院食用菌研究所;发芽糙米、大麦芽和豆粕 购自南京市集贸市场;淀粉酶、糖化酶及木瓜蛋白酶 均购自国药集团化学试剂有限公司;3,5-二硝基水杨酸、考马斯亮蓝G-250、茚三酮、亮氨酸、牛血清白蛋白(BSA)、无水乙醇等 均购自南京化学试剂有限公司;斜面及平板培养基 采用PDA培养基(马铃薯20%,葡萄糖2%,琼脂2%,pH自然);种子培养基 采用PD液体培养基,装液量60mL/250mL,pH自然;发酵培养基 装液量60mL/250mL,以发芽糙米浆、麦芽汁和豆粕汁为原料,按三者比例为55∶5∶40进行配制,调pH为6.0。
FSD-100A型电动粉碎机 台州市新恩精密粮仪有限公司;HH-6型数显恒温水浴锅 常州国华电器有限公司;DJM-50L胶体磨 上海东华高压均质机厂;手持折光仪(Brix0~32%) 日本产;UV-2802紫外可见分光光度计 尤尼柯(上海)仪器有限公司;DZ-900往复式摇床 江苏太仓市实验设备厂;LDZX-40AI立式自动压力蒸汽灭菌器 上海申安医疗器械厂;DHG-9030A电热恒温鼓风干燥箱 上海一恒科技有限公司。
1.2 实验方法
1.2.1 发芽糙米浆、麦芽汁和豆芽汁、豆粕汁及豆汁的制备 发芽糙米浆:发芽糙米经粉碎后过60目筛,取一定量发芽糙米粉,添加4倍体积蒸馏水,混匀,于90~95℃糊化30min;降温至60℃,添加0.2%发芽糙米粉质量的α-淀粉酶,60℃保持1h。液化后,将混合物过胶体磨,添加0.2%发芽糙米粉质量的糖化酶,混匀后于60℃保温2h;之后过150目筛,调节其可溶性固形物含量为6°Brix。
麦芽汁:大麦芽经粉碎机粉碎后过60目筛,取一定量麦芽粉添加4倍体积蒸馏水,混匀后于35~37℃保温30min,50~55℃保温60min,65℃保温3h。水解后,将混合物离心,转速为4000r/min,时间10min;混合上清液并调节其可溶性固形物为6°Brix。
豆粕汁:豆粕经粉碎机粉碎后过60目筛,取一定量豆粕粉添加10倍体积蒸馏水,100℃保持10~15min;降温至60℃,添加0.2%豆粕质量的木瓜蛋白酶,混匀,于60℃保持2h;后将混合物离心,转速为4000r/min,时间10min;收集上清液并调节其可溶性固形物为6°Brix。
1.2.2 种子液的制备 斜面试管菌种点种于PDA培养基的培养皿中央,25℃培养6d后,用直径为6mm的打孔器取4片菌种,接种于种子培养基中,25℃摇床(100r/min)培养5d。
1.2.3 液态发酵培养 种子液接种于发酵培养液中,接种量为10%,温度25℃,摇床转速为100r/min,培养时间7d。
1.2.4 测定指标及方法
1.2.4.1 菌体干重 北虫草发酵液过150目不锈钢筛网,用蒸馏水冲洗菌丝体至洗出液无色,收集菌丝于60℃烘至恒重。
1.2.4.2 菌体中虫草素含量 取0.5g已烘干菌体,以1∶10料液比添加50%乙醇,于50℃超声波中超声提取60min后,离心,将上清液用50%的乙醇溶液定容至10mL,取1mL用0.45μm滤膜过滤,滤液用安捷伦1200液相色谱测定,色谱柱为Prodigy ODS-C18反相色谱柱,4.6mm×250mm,5μm,进样量20μL,流动相为甲醇和0.02mol/L的磷酸二氢钾,体积比为15∶85,流速1.0mL/min,检测波长为260nm,测定温度为40℃[11-12]。
1.2.4.3 胞外粗多糖 取离心所得上清液10mL,加入4倍体积的无水乙醇,于4℃冰箱中静置12h,4000r/min离心20min,沉淀,于65℃烘至恒重,每处理重复3次[13]。
1.2.4.4 其他指标 对离心得到上清液的总糖、还原糖、可溶性固形物、pH、游离氨基酸和可溶性蛋白等指标进行测定。
2 结果与讨论
2.1 北虫草菌丝体生长曲线
如图1所示,北虫草接种后,能较快地适应新的环境,其菌丝体迅速生长,延迟期表现不明显;在其生长1~5d时,是北虫草菌的对数生长期,在该过程中,北虫草菌呈直线生长;当生长至第5d时,由于其繁殖产生的代谢产物对其生长产生抑制作用,使得北虫草菌丝体产量不再增加,进入菌体生长稳定期;发酵至第8d时,菌丝体产量下降,北虫草的生长进入衰亡状态。
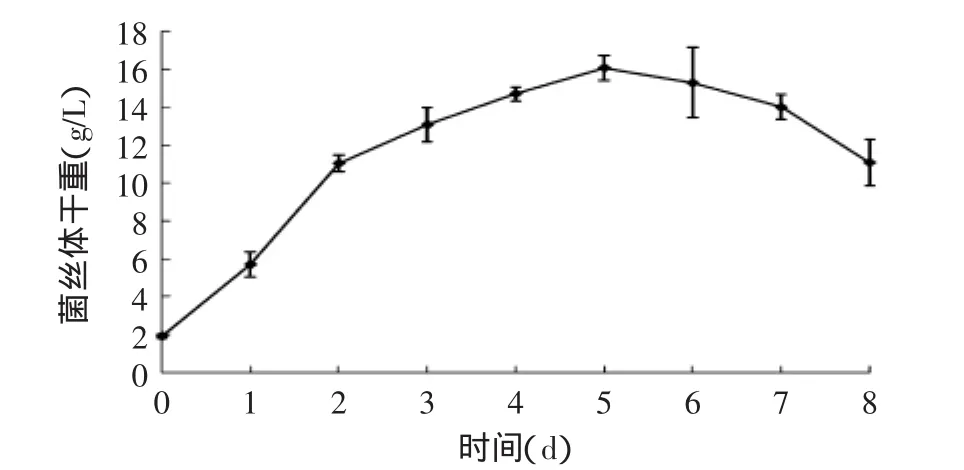
图1 北虫草菌丝体干重的变化Fig.1 Change of dry mycelium weight of Cordyceps militaris with fermentation
2.2 北虫草胞外粗多糖产量的变化
由图2可知,在北虫草发酵过程中,胞外粗多糖含量总体略呈现下降的趋势。在发酵初期,菌丝体生长较少,胞外多糖分泌较少,而本研究中以发芽糙米、大麦芽和豆粕为培养基,其中富含有非虫草多糖的粗多糖,因而在初期粗多糖含量较高;而后随着菌丝体的生长,其生成多糖含量略有增加,而其生长过程中产生的淀粉酶、纤维素酶等具有降解原料中粗多糖的能力[13],使多糖含量下降,而在图2中显示的是两者差值,故多糖含量略有下降。第7d始,菌丝体进入其衰亡期,对原料消耗量显著下降,而使胞外粗多糖略有增加。

图2 北虫草培养液中胞外粗多糖含量的变化Fig.2 Change of extracellular polysaccharide content in the medium of Cordyceps militaris
2.2 北虫草菌丝体胞内虫草素含量变化
在整个发酵过程中,北虫草菌体中虫草素含量呈先增加后下降的变化趋势(图3),且在不同的生长阶段其增加趋势略有不同。在发酵初期(0~2d),菌体生长缓慢,其代谢产物虫草素也呈缓慢的增长;在北虫草生长3~5d中,处于其对数生长期,该过程中菌体中的虫草素含量也显著增加;而后进入稳定期,该过程中,虫草素生成继续增加,在第7d时,北虫草菌体中虫草素含量最高,为1.73mg/g;在第7d后,发酵进入北虫草的衰亡期,部分菌体出现自溶,菌体内的物质释放到胞外,进而测得菌丝体中虫草素含量呈下降趋势。
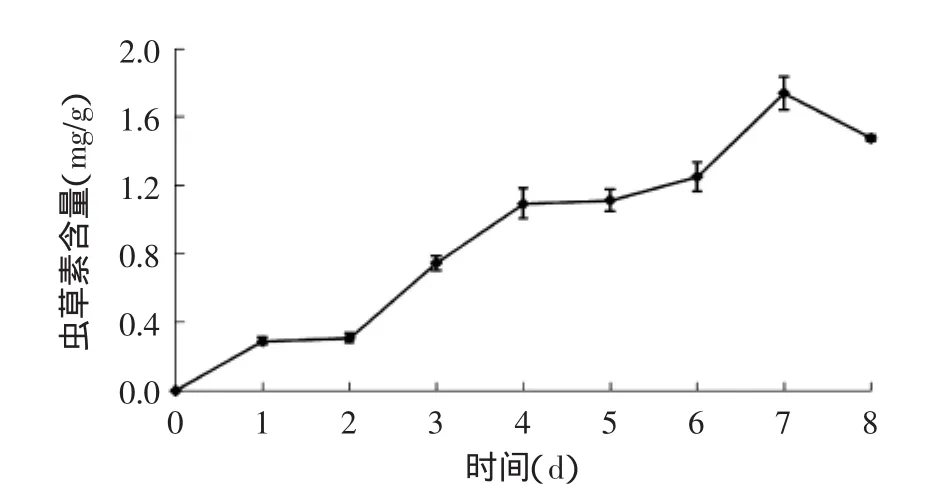
图3 北虫草菌丝体中虫草素糖含量的变化Fig.3 Change of intracellular cordycepin content of Cordyceps militaris
2.4 北虫草发酵液中pH的变化
由图4可知,在北虫草液态深层发酵过程中,发酵液的pH在发酵开始后的3d内变化显著,由pH5.3降至pH4.5,这主要是由于北虫草菌丝体的耗氧生长繁殖,发酵前3d由于菌体的大量生长繁殖,在这个过程中通过EMP和TCA途径产生有机酸等酸性物质[14],导致pH急剧下降。发酵3d后pH缓慢下降并最终稳定在4.5左右,说明北虫草在生长阶段有自我调节酸碱度的能力。

图4 北虫草培养液pH的变化Fig.4 Change of pH in the medium of Cordyceps militaris
2.5 北虫草发酵液可溶性固形物含量的变化
北虫草发酵液的可溶性固形物含量先下降后基本不变而后又略有增加(如图5所示)。在发酵0~4d时,发酵液可溶性固形物含量显著下降,而后在5~7d,可溶性固形物含量基本不变,在8d,该指标又略有增加;发酵液中可溶性固形物含量的变化与菌丝体的生长具有相关性,发酵初期,菌丝体迅速生长,大量消耗培养基中的营养成分,使得发酵液的可溶性固形物含量显著下降,而后菌体生长缓慢,消耗减少,可溶性固形物含量变化不大,最后部分菌体自溶,释放其内容物,进而使发酵液可溶性固形物略有上升。
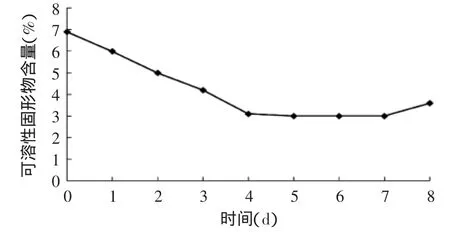
图5 北虫草培养液的可溶性固形物含量的变化Fig.5 Change of soluble solids in the medium of Cordyceps militaris
2.6 北虫草发酵液中总糖和还原糖含量变化
如图6所示,随发酵时间的延长,北虫草培养液中总糖和还原糖含量的变化趋势基本相同,两者间的相关系数可达0.993;在发酵0~5d,发酵液中总糖和还原糖含量显著下降,而后两者含量变化不明显。其原因是发酵初期,北虫草菌丝体大量繁殖,迅速消耗培养基中的碳源,进而使总糖和还原糖含量显著下降;在发酵5~7d时,菌丝体处于其稳定期,不再生长,对营养成分消耗下降,而表现出总糖和还原糖含量基本不变。

图6 北虫草培养液中总糖和还原糖含量的变化Fig.6 Change of total sugar and reducing sugar content in the medium of Cordyceps militaris
2.7 北虫草发酵液中可溶性蛋白和游离氨基酸含量变化
由图7可见,可溶性蛋白与游离氨基酸含量变化趋势显著不同,随发酵时间的延长,游离氨基酸先变化迟缓后上升,而可溶性蛋白含量先下降后上升;在发酵初期,菌丝体大量生长,进而需要消耗氮源,使得可溶性蛋白含量显著下降;而后随着蛋白酶的分泌,将水解培养基中不溶性蛋白将其转化为可溶性蛋白或游离氨基酸,进而测定结果为可溶性蛋白和游离氨基酸在发酵4~8d时呈增加趋势。报道称,北虫草生长中对氮源要求较高,其适宜在氨基酸等简单氮源中生长[15],即在培养基中优先消耗氨基酸;在生长后期时,培养基中氨基酸含量下降,北虫草大量生成蛋白酶以水解蛋白,为其生长提供游离氨基酸[16]。
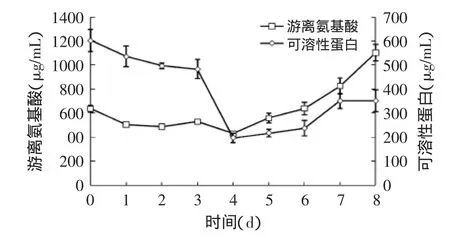
图7 北虫草培养液中可溶性蛋白和游离氨基酸含量的变化Fig.7 Change of soluble protein and free amino nitrogen content in the medium of Cordyceps militaris
3 结论
研究了北虫草菌丝体液态深层发酵过程中发酵液的主要营养成分、pH及菌丝体代谢物质的变化情况。pH、可溶性固形物含量、总糖和还原糖在发酵过程均总体呈下降趋势;游离氨基酸含量先变化迟缓而后上升;菌丝体产量、虫草素含量呈先增加后下降趋势;胞外粗多糖含量略有下降;可溶性蛋白含量先下降后上升。
[1]Masuda M,Urabe E,Sakurai A,et al.Production of cordycepin by surface culture using the medicinal mushroom Cordyceps militaris[J].Enzyme and Microbial Technology,2006,39:641-646.
[2]张平,朱述钧,钱大顺,等.北冬虫夏草功能成分及保健作用分析[J].江苏农业科学,2003(6):105-107.
[3]金田,石俊英.近五年北虫草药理作用研究进展[J].食品与药品,2011,13(9):358-360.
[4]杜秀菊,张劲松,蔡连捷,等.北虫草体外抗病毒、抗肿瘤活性部位的筛选[J].食品科学,2011,32(17):313-316.
[5]李义勇,陈玉婵,李冬利,等.几种虫草菌发酵提取物的抗菌抗肿瘤活性研究[J].食品工业科技,2010,31(6):88-90,93.
[6]李晓磊,赵珺,高长城,等.虫草醇提物的抗氧化活性及保健酒的研制[J].食品工业科技,2010,31(6):229-231.
[7]吴雪晶,马慧君,刘宁.北虫草与冬虫夏草的药用价值比较[J].浙江食用菌,2009,5(8):12-14.
[8]胡亚平.功能性食药用菌蛹虫草的开发技术研究[D].长沙:湖南农业大学,2004:3-6.
[9]Shih IL,Tsai KL,Hsieh C.Effects of culture conditions on the mycelial growth and bioactive solid metabolite production in submerged culture of Cordyceps militaris[J].Biochemical Engineering Journal,2007,33:193-201.
[10]解春艳,顾振新,顾颖娟,等.北虫草液态发酵天然培养基的优化研究[J].食品工业科技,2012,33(4):223-226
[11]Mao XB,Eksriwong T,Chauvatcharin S,et al.Optimization of carbon source and carbon-nitrogen ratio for cordycepin production by submerged cultivation of medicinal mushroom Cordyceps militaris[J].Process Biochemistry,2005,40:1667-1672.
[12]Mao XB,Zhong JJ.Significant effect of NH4+on cordycepin production by submerged cultivation of medicinal mushroom Cordyceps militaris[J].Enzyme Microbiology Technology,2006,38:343-350.
[13]陈志杰,顾振新,解春艳.灵芝发酵过程中营养物质及相关酶活性变化研究[J].中国酿造,2008,178(1):26-29.
[14]诸葛健,李华钟.微生物学[M].北京:科学出版社,2004:236-238.
[15]Shih IL,Tsai KL,Hsieh CY.Effects of culture conditions on the mycelial growth and bioactive metabolite production in submerged culture ofCordyceps militaris[J].Biochemical Engineering Journal,2007,33:193-201.
[16]Hattori M,Isomura S,Yokoyama E,et al.Extracellular Trypsin-like proteases produced by Cordyceps militaris[J].Journal of Bioscience and Bioengineering,2005,100:631-636.
Study on changes of nutriments and metabolites during fermentation of Cordyceps militaris
XIE Chun-yan1,LING Wei1,GU Ying-juan2,GU Zhen-xin2,*
(1.Life Science Institute,Langfang Nnormal College,Langfang 065000,China;2.Key Laboratory of Agricultural and Animal Products Processing and Quality Control,Ministry of Agriculture,Nanjing Agricultural University,Nanjing 210095,China)
TS201.2
A
1002-0306(2012)16-0179-04
2011-12-06 *通讯联系人
解春艳(1983-),女,博士,副教授,研究方向:食品新资源的应用与功能性食品开发。
廊坊市科学技术研究与发展计划项目(2011012001);廊坊师范学院博士基金项目(LSZB201003)。

