丙烯酰胺对大鼠肝脏P4502E1活力的影响
张海明,张丽
(1.山西农业大学 信息学院,山西 太谷030800;2.太原市星火技术发展中心,山西 太原030009)
丙烯酰胺(acrylamide,Acr)具有毒性和潜在的致癌性,食品中丙烯酰胺的存在及食用安全性引起了社会的高度重视[1,2]。目前,丙烯酰胺的研究主要对其毒性进行试验,包括一般毒性、神经毒性、生殖毒性、致癌性等。Acr进入机体主要通过诱导P4502E1,然后代谢为GA或者与谷胱甘肽结合形成N-乙酰基-S-半胱氨酸及其硫氧化物,进一步在体内各个组织器官作用产生毒性[3~6]。因此,研究Acr的代谢机制是研究其毒性的关键。但丙烯酰胺在体内的代谢过程仍不十分清楚,Acr在代谢生成GA的过程中,GA的生成量与Acr的摄入剂量是否有关,不同剂量下它的作用机制是否相同也不十分清楚。为更深入地了解丙烯酰胺的代谢机理以及毒性机制,以Sprague-Dawley雄性大鼠为试验动物,随机分组进行丙烯酰胺染毒试验,来观察Acr对大鼠肝脏P4502E1的影响。
1 材料
试验动物:
清洁级Sprague-Dawley大鼠(雄性)80只,体重为180~220g,鼠龄50d。
80只大鼠随机分为低、中、高3个剂量组和1个对照组,采用腹腔注射法,染毒剂量分别设为0、25、50、100mg·kg-14个等级,染毒时,按蒸馏水与Acr等体积配成不同浓度用的稀释液,对照组用等体积的生理盐水替代。实验过程中隔日染毒,持续时间为12周。
分别在第3、6、9实验周的末次染毒4h后,各组随机抽取4只大鼠处死,取出肝脏并用预冷的生理盐水冲洗,然后用滤纸吸干,切小块后置于液氮罐中,在-70℃冰箱保存备用。
2 方法
取冻存的肝脏提取肝微粒体。取部分肝组织剪成碎块,用含 KCl(0.15mol·L-1)的磷酸缓冲液(0.1mol·L-1,pH=7.4)进行多次冲洗以除掉组织中的血液成分,按1∶4(W/V)加入KCl-磷酸缓冲溶液,使用内切式组织匀浆机将组织制备成肝匀浆,用超速离心机将其离心(9000r·min-1)15 min,取上清液,进一步离心(10 000r·min-1)60 min,弃上清液所得到的粉红色沉淀即肝微粒体。将其悬浮于KCl-磷酸缓冲溶液(内含体积比为30%甘油),然后置于-120℃冰箱中,保存备用[7]。以上操作均应在低温冰浴中进行。
采用分光光度计测定P4502E1的活力。
3 结果与分析
从表1和图1中可以看出,P4502E1活力随染毒时间延长,有逐渐上升的趋势。在25mg·kg-1剂量组随染毒时间增加而酶活力升高,差异极显著(P<0.01)。在50mg·kg-1、100mg·kg-1剂量组,大鼠肝脏P4502E1酶活力在染毒第6周表现出峰值现象。同一时间不同剂量组的比较发现,随剂量的增加酶活力增强,但在第12周以25mg·kg-1剂量组活力最高,差异极显著(P<0.01)。

表1 Acr染毒大鼠肝微粒体P4502E1活力变化Table 1 P4502E1vigor in rat liver microsome to use narcotics with Acr
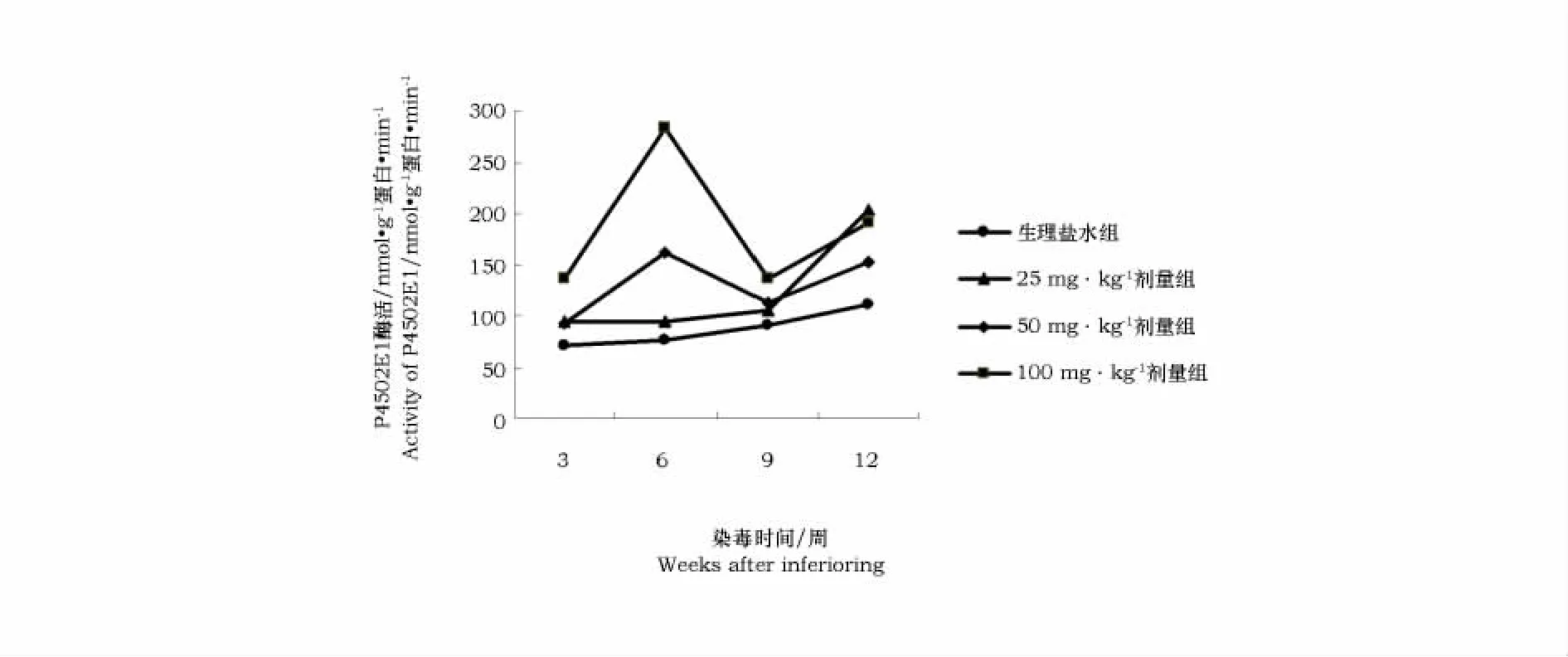
图1 不同剂量组P4502E1酶活力比较Fig.1 Compare of P4502E1enzyme activity in different doses
4 讨论
细胞色素是一类以铁卟啉(或血红素)作为辅基的电子传递蛋白,广泛参与动、植物,酵母以及好氧菌、厌氧光合菌等的氧化还原反应。细胞色素P4502El是细胞色素大家族的成员之一,在人肝脏中含量最丰富,并且富集于肝小叶中心区域,近年陆续发现在鼻腔、食道、胃、小肠、结肠、肺、肾、皮肤等许多肝外组织器官有不同程度的表达。细胞色素P4502E1主要负责小分子量物质如丙酮、乙醇、乙酸等及异烟肼、水杨酸类药物和亚硝胺、芳香族类致癌物的代谢,已确定为P4502E1的底物多达75种,其中大部分为前致癌物和前毒物,少部分为药物[6~9]。而这些底物对P4502E1又具有诱导作用。本实验结果显示,P4502E1活力随染毒时间延长,有逐渐上升的趋势,这与底物Acr对P4502E1的诱导作用有关。
Adler对显性致死性突变评价实验中,用1_ABT(1_ABT是P450酶的抑制剂)处理父本鼠,1_ABT能抑制Acr代谢为GA,可降低显性致死性突变发生率。细胞色素氧化酶P450抑制剂1_ABT可阻断丙烯酰胺经细胞色素P450的氧化代谢,导致人角质形成细胞DNA损伤明显下降。Sunmer等以13C标记的Acr染毒Fischer大鼠和B6C3F1小鼠,用核磁共振分析动物的尿代谢物,证实Acr在体内能通过与巯基加成而经谷胱甘肽代谢,在小鼠实验发现50%的丙烯酰胺在肝微粒体P4502E1作用下代谢成GA,后者可进一步和谷胱甘肽结合,在谷胱甘肽-S-转移酶作用下代谢清除或以原形排泄[3~5],其转化率可能与体内丙烯酰胺的水平有关[10]。Calleman CJ等实验发现,以极低浓度母体化合物Acr腹腔注射大鼠,经代谢约有60%转化为GA[11],对Acr暴露工人的血红蛋白加合物测定显示Acr在人体也转化为具有基因毒性的GA,且在低暴露水平下测得体内GA和Acr的剂量比为3∶10[12]。低剂量(25mg·kg-1)丙烯酰胺,体内环氧丙酰胺的转化率为51%,而高剂量(100mg·kg-1)时转化率13%[13]。在本实验结果中,整个攻毒过程中,酶活力会出现一个峰值,早期,随着攻毒时间的延长酶活力增加,出现峰值后逐渐降低,而且,在50、100mg·kg-1剂量组,酶活力峰值出现较25mg·kg-1剂量组早6周,高剂量组P4502E1活力较早出现降低,会使得GA转化率较早降低。由此可见,P4502E1在丙烯酰胺的代谢中是重要的代谢酶。
5 结论
P4502E1活力随染毒时间延长,有逐渐上升的趋势,但并不是一直上升,而是出现峰值后下降。在25mg·kg-1剂量组随染毒时间增加而酶活力升高,差异极显著。在50、100mg·kg-1剂量组,大鼠肝脏P4502E1酶活力均在染毒第6周表现出峰值现象。同一时间不同剂量组的比较发现,随剂量的增加酶活力增强,但在第12周以25mg·kg-1剂量组活力最高,差异极显著。
[1]Rosen J,Heilenas K E.Analysis acrylamide in cooked foods by liquid chromatography tandem mass spectrome try[J].An alyst,2002,127:880-882.
[2]Tareke E,Ryaberg P,Karlsson S,et a1.Acrylamide:A cooking careinogent[J].Chem Res Toxicol,2000,13:517-522.
[3]Sumner S C J,MacNeela J P,Fennel T R,et al.Characterization and quantitation of urinary metabolites of[1,2,3-13C]acrylamide in rats and mice using13C nuclear magnetic resonance spectroscopy[J].Chem Res Toxieol,1992,5(1):81-89.
[4]Mukhtar H,Dixit R,Seth P K.Reduction in cutaneous and hepatic glutathione contents,glutathionr S-transferase and aryl hydrocarbon hydroxylase activities following topical application of acrylamide to mouse[J].Toxicol Lett,1981,9:153-156.
[5]Sumner S C,Selvaraj L,Nauhaus S K,et al.Urinary metabolites from F344rats and B6C3F1mice coadministered acrylamide and acrylonitrile for 1or 5days[J].Chem RES Toxicol,1997,10:1152-1160.
[6]Nishimoto I N,Hanaoka T,Sugimura H,et al.Cytochrome P4502E1polymorphism in gastric cancer in Brazil:case-control studies of Japanese Brazilians and non-Japanese Brazilians[J].Cancer Epidemiol Biomarkers Prev,2000,9:675-680.
[7]王水良,贺智敏,朱建华,等.人CYP4502E1异源性表达模型的建立及底物的表达诱导作用[J].中国病理生理杂志,2004,20(2):166-169.
[8]张慧锋,王月鹏,李妍.细胞色素P450的研究进展[J].吉林医药学院学报,2005,26(3):174-177.
[9]赵博,王中伟.细胞色素P450的研究进展[J].山东农业大学学报,2004,35(1):142-144.
[10]Miller M J,Carter D E,Sipes I G.Phanmacokinetica of acrylamide in Fischer-344rats[J].Toxieol Appl Pharmacol,1982,63:36-44.
[11]Calleman C J,Stern L G,Bergmark E,et al.Linear versus nonlinear models for hemoglobin adduct formation by acrlamide and its metabolite glycidamide:implications for risk estimation[J].Cancer Epidemiol Biomakers Prev,1992,1:361-368.
[12]Bergmark E,Calleman C J,He,et al.Determination of hemoglobin adducts in humans occupationally exposed to acrylamide[J].Toxicol Applpharmacol,1993,120:45-54.
[13]E Bergmark,C J Calleman,L G Costa,Formation of hemoglobin adducts of acrylamide and its epoxide metabolite glycidamide in the rat[J].Toxicol Appl Pharmacol.1991,111:352-363.

