肥大细胞和蛋白酶激活受体-2表达在胃食管反流病中的意义
高 欣 张振玉 徐兆军 姜宗丹 陈菲菲 王劲松
南京医科大学附属南京医院消化科1(210006) 病理科2
胃食管反流病(GERD)系指胃内容物反流入食管,引起不适症状和(或)并发症的一种疾病,可分为非糜烂性反流病(NERD)、糜烂性食管炎(EE)和Barrett食管(BE)[1]。肥大细胞(mast cells,MC)是一种广泛存在于人体组织,尤其是皮肤、呼吸道和消化道的组织细胞,胞质内有大量含组胺、类胰蛋白酶(tryptase)、肝素等介质的分泌颗粒,MC活化脱颗粒可在组织内引起速发型过敏反应(炎症)。多项研究[2~6]发现MC活化脱颗粒或细胞溶解释放的炎症介质参与了酸或胆汁诱导的食管黏膜损伤。蛋白酶激活受体-2(protease-activated receptor-2,PAR-2)广泛表达于消化道,可被胰蛋白酶激活,诱导促炎反应。对不同类型GERD患者和无反流对照者食管黏膜中 PAR-2 表达和分布的研究[7,8]显示,PAR-2活化和表达上调在GERD的发生及其相关黏膜改变和炎症反应中起重要作用。本研究采用免疫组化方法检测GERD患者食管黏膜上皮中的MC数量和PAR-2表达情况并分析其间的相关性,旨在明确两者在GERD发病中的意义。
对象与方法
一、研究对象
纳入62例于2007年1月~2008年12月因反酸、烧心等反流症状在南京医科大学附属南京医院就诊,经胃镜检查、24 h食管pH监测和质子泵抑制剂(PPI)试验确诊的 GERD 患者。诊断标准[1,9]:①24 h食管pH监测DeMeester评分<14.72为酸反流阴性,≥14.72为酸反流阳性(病理性酸反流);②内镜检查见食管远端黏膜破损,排除其他原因后可诊断为EE;③有典型或不典型反流症状,内镜检查未见食管黏膜破损且24 h食管pH监测或PPI试验结果阳性可诊断为NERD。同期20例无反流症状、胃镜检查无异常发现、对研究方案知情同意的非GERD患者作为正常对照组。研究方案经医院伦理委员会审核、批准。
二、研究方法
1.标本采集:入组受检者于胃镜检查时在齿状线上方2~3 cm鳞状上皮处(EE患者于糜烂周围相对正常黏膜处)取一块活检组织,4%甲醛溶液固定24 h,常规脱水、透明、石蜡包埋、切片,用于免疫组化染色。
2.免疫组化染色:采用EnVision免疫组化二步法(EnVision免疫组化检测试剂盒,DAKO公司)。鼠抗人MC类胰蛋白酶单克隆抗体为福州迈新生物技术开发有限公司产品,可直接使用,无需稀释;山羊抗PAR-2多克隆抗体为Santa Cruz Biotechnology,Inc.产品,使用时按1∶200稀释。具体操作步骤参照试剂盒说明书。
3.MC计数:类胰蛋白酶阳性MC呈棕褐色。于光学显微镜下(×400)选取阳性细胞密度最高的5个视野进行计数,取均值。
4.PAR-2免疫组化评分:PAR-2阳性细胞胞质呈棕色。于光学显微镜下(×100)选取表达强度最高的5个视野,分别行胞质着色评分和阳性细胞比例评分,PAR-2免疫组化评分为各视野两项评分乘积的均值。胞质着色评分:无表达,0分;弱表达,1分;中等表达,2分;强表达,3分。阳性细胞比例评分:无阳性细胞,0分;<10%,1分;≥10%且<50%,2分;≥50%且<80%,3分;≥80%,4分。
三、统计学分析
应用SPSS 17.0统计软件,计数资料以率或构成比表示,组间比较采用χ2检验,计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD法,两变量间相关性的分析采用Pearson相关分析,P<0.05为差异有统计学意义。
结 果
一、一般情况
62例 GERD患者中男34例,女28例,年龄26~78岁,平均(50.0±13.7)岁。EE组30例,男18例,女12例,年龄29~74岁,平均(49.4±11.5)岁;NERD组32例,男、女各16例,年龄26~78岁,平均(51.1±15.2)岁。20例正常对照者中男、女各10例,年龄27~75岁,平均(63.8±7.1)岁。三组间性别构成和平均年龄差异无统计学意义。
二、食管黏膜上皮MC数量
食管黏膜上皮类胰蛋白酶免疫反应产物主要定位于MC胞质中,少数MC胞质、胞核均着色。EE组和NERD组MC数量均明显多于正常对照组,组间差异有统计学意义,EE组与NERD组间差异无统计学意义(见图1、表1)。
三、食管黏膜上皮PAR-2表达
食管黏膜上皮PAR-2免疫反应产物定位于细胞质。EE组和NERD组PAR-2免疫组化评分均明显高于正常对照组,组间差异有统计学意义,EE组与NERD组间差异无统计学意义(见图1、表1)。
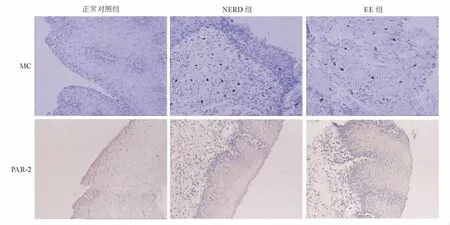
图1 MC、PAR-2在各组食管黏膜上皮中的表达和分布(免疫组化染色,×100)
表1 各组食管黏膜上皮MC数量和PAR-2免疫组化评分比较()
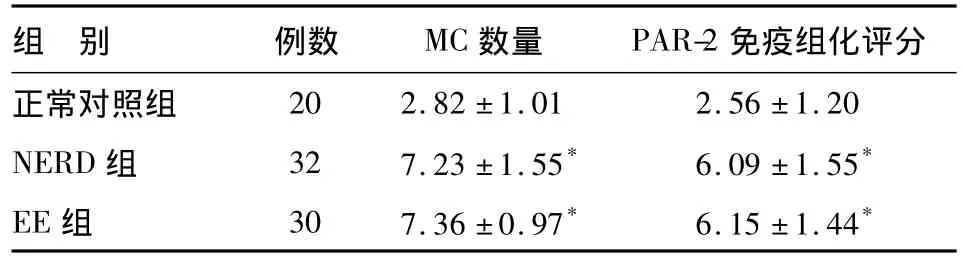
表1 各组食管黏膜上皮MC数量和PAR-2免疫组化评分比较()
*与正常对照组比较,P<0.01
组 别 例数 MC数量 PAR-2免疫组化评分正常对照组20 2.82±1.01 2.56±1.20 NERD组 32 7.23±1.55* 6.09±1.55*EE组 30 7.36±0.97* 6.15±1.44*
四、GERD患者食管黏膜上皮MC数量与PAR-2免疫组化评分的相关性
Pearson相关分析显示,EE组和NERD组中的MC数量均与PAR-2免疫组化评分呈正相关(r=0.875,P <0.01;r=0.884,P<0.01)。
讨 论
MC是一种重要的炎性细胞,广泛分布于消化道黏膜,组织发生炎症反应时,MC可被激活,进而产生脱颗粒效应,释放大量炎症介质,放大炎症反应。Barclay等[6]予负鼠食管腔内灌注 HCl,发现其食管黏膜着色MC数量较对照组减少约50%,MC平均面积、核面积和完整颗粒面积亦显著降低,提示食管酸暴露可使黏膜中的MC活化脱颗粒或使细胞溶解释放炎症介质,从而参与EE的病理生理学机制。其后多项研究[2~5]证实食管黏膜暴露于酸或胆汁可激活MC脱颗粒释放炎症介质,进而引起食管黏膜损伤。类胰蛋白酶是活化的MC释放的介质之一,具有胰蛋白酶样活性,在MC介导的多种反应中起重要作用,常被作为MC活化的标记物[10]。本研究以类胰蛋白酶阳性细胞代表MC,发现EE组和NERD组食管黏膜上皮中的MC数量显著多于正常对照组,证实了MC在GERD发病机制中的作用。
PARs家族迄今已发现四种亚型,分别为PAR-1、PAR-2、PAR-3、PAR-4,其中 PAR-2 广泛表达于内皮组织、粒细胞以及消化道,能被多种丝氨酸蛋白酶,如胰蛋白酶、类胰蛋白酶激活,在胃肠道炎症反应中起重要作用。Kandulski等[7]发现GERD患者食管黏膜上皮中的PAR-2基因表达显著上调,上皮层PAR-2弥漫强阳性染色,PAR-2表达上调与促炎细胞因子白细胞介素-8(IL-8)表达以及食管黏膜组织形态学改变呈正相关;体外实验亦显示,培养于酸性培养基中的食管鳞状上皮细胞PAR-2基因表达显著上调,PAR-2的活化可引起 IL-8表达和分泌。这些发现提示PAR-2介导的通路参与了GERD的发病机制。Inci等[8]的研究显示食管黏膜上皮中的PAR-2可被十二指肠胃食管反流物中的胰蛋白酶激活,胰蛋白酶-PAR-2通路参与了GERD的发病机制。本研究同样观察到EE组和NERD组食管黏膜上皮中的PAR-2表达显著强于正常对照组,证实PAR-2表达上调与GERD的发生密切相关。
何韶衡等[11,12]发现 PAR-2 激动剂可高效激活人结肠MC,诱导其释放类胰蛋白酶和组胺,表明MC上可能存在PAR-2,PAR-2为MC表面的重要受体。推测MC可通过其分泌的类胰蛋白酶激活自身或邻近MC的PAR-2,对脱颗粒信号进行自我放大,从而放大炎症反应。Jacob等[13]的研究证实,在应激和炎症状态下,MC释放的类胰蛋白酶可激活结肠细胞上的PAR-2,从而增加细胞间隙通透性。目前尚未见关于MC与PAR-2在GERD中关系的报道。本研究发现EE和NERD患者食管黏膜上皮中的MC数量增多、PAR-2表达上调且两者呈正相关,提示MC在GERD患者食管黏膜损伤中的作用可能与PAR-2的活化有关,且两者在EE和NERD中的作用未显示出明显差异。
综合本研究以及既往研究结果,可以认为食管黏膜上皮中的MC与PAR-2共同参与了GERD的发病机制。推测在GERD发生过程中,食管黏膜上皮中的PAR-2被广泛激活,分布于MC表面的PAR-2活化后激活MC,诱导其脱颗粒释放炎症介质,同时反流的酸或胆汁亦可能激活MC,而MC释放的类胰蛋白酶又可激活PAR-2,MC由此对脱颗粒信号进行自我放大,从而放大炎症反应,加重食管黏膜损伤。由于本研究采用的是回顾性研究方法,对入组GERD患者的病史资料掌握有限,缺乏EE内镜分级资料,且内镜活检组织均取自肉眼观察相对正常的食管黏膜,常规病理检查无特殊发现,故未能进一步分析MC和PAR-2与EE内镜分级、食管黏膜组织病理学表现之间的关系以及患者接受规范治疗前后两者的变化。后续研究拟采用前瞻性研究方法,对MC和PAR-2在GERD发病机制中的作用进行更深入的探索。
1 林三仁,许国铭,胡品津,等;中国胃食管反流病共识意见专家组.中国胃食管反流病共识意见(2006年10月三亚)[J]. 胃肠病学,2007,12(4):233-239.
2 Paterson WG,Kieffer CA,Feldman MJ,et al.Role of plateletactivating factor in acid-induced esophageal mucosal injury[J].Dig Dis Sci,2007,52(8):1861-1866.
3 Eros G,Kaszaki J,Czóbel M,et al.Effects of phosphatidylcholine pretreatmentduring acute experimental biliary reflux(Article in Hungarian)[J].Magy Seb,2005,58(6):406-414.
4 White RJ,Morris GP,Cooke K,et al.Morphology and glycoconjugate content of opossum esophageal epithelium and glands:regional heterogeneity and effects of acidinduced mucosal injury and recovery[J].Dig Dis Sci,2005,50(9):1591-1604.
5 Paterson WG.Role of mast cell-derived mediators in acidinduced shortening of the esophagus[J].Am J Physiol,1998,274(2 Pt 1):G385-G388.
6 Barclay RL,Dinda PK,Morris GP,et al.Morphological evidence of mast cell degranulation in an animal model of acid-induced esophageal mucosal injury[J].Dig Dis Sci,1995,40(8):1651-1658.
7 Kandulski A,Wex T,Mönkemüller K,et al.Proteinaseactivated receptor-2 in the pathogenesis of gastroesophageal reflux disease[J].Am J Gastroenterol,2010,105(9):1934-1943.
8 Inci K,Edebo A,Olbe L,et al.Expression of proteaseactivated-receptor 2(PAR-2)in human esophageal mucosa[J].Scand J Gastroenterol,2009,44(6):664-671.
9 Johnson LF,DeMeester TR.Development of the 24-hour intraesophageal pH monitoring composite scoring system[J].J Clin Gastroenterol,1986,8 Suppl 1:52-58.
10 Abraham WM.Tryptase:potential role in airway inflammation and remodeling[J].Am J Physiol Lung Cell Mol Physiol,2002,282(2):L193-L196.
11 何韶衡,谢华,何永松.蛋白酶激活受体2(PAR-2)激动剂对肥大细胞释放类胰蛋白酶的影响[J].生理学报,2002,54(6):531-534.
12 何韶衡,谢华.蛋白酶激活受体2激动剂对肥大细胞释放组胺的影响[J].免疫学杂志,2004,20(4):263-266.
13 Jacob C,Yang PC,Darmoul D,et al.Mast cell tryptase controls paracellular permeability of the intestine.Role of protease-activated receptor 2 and beta-arrestins[J].J Biol Chem,2005,280(36):31936-31948.

