胃肠道活检和手术标本的病理检查要点
随着内镜检查的普及,使许多无明显症状的消化道早癌得以诊断。早期胃癌的肉眼形态常不典型,内镜下难以与炎症相鉴别,而质子泵抑制剂(PPI)的广泛应用使部分早期胃癌病灶产生假性愈合,更加大了诊断难度,延误治疗。当病理学检查发现恶性癌细胞数量很少时,黏液染色往往能显示HE染色切片难以发现的少量印戒细胞癌和(或)低分化腺癌,有助于癌的诊断。细致、深入的病理学检查对临床诊治具有重要意义。
黏膜活检标本
一、黏膜活检标本的处理
1.原则:活检标本取材要足够大,深度要达到黏膜肌层(见图1);不同部位的标本须分瓶标记、及时固定。需向病理医师提供取材部位、内镜所见和简要病史。必要时提供内镜照片或示意图。
2.病灶的取材:正确内镜活检是避免假阴性的关键。第一块活检标本应取准,否则因出血会影响以后取材的准确性;溃疡病灶应在溃疡隆起边缘的内侧黏膜组织多点取材,应避开溃疡底部的坏死组织(苔)(见图2)。怀疑癌的病灶至少应取3块以上的活检。
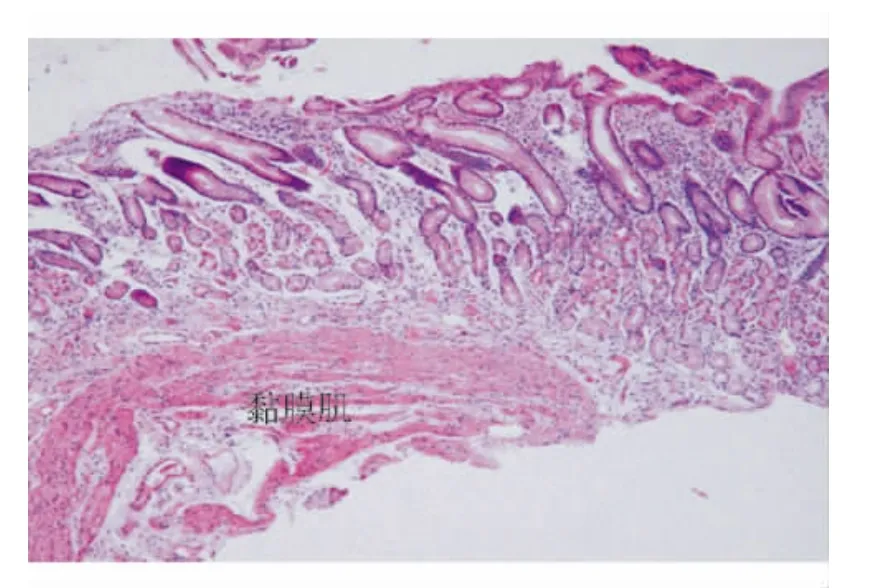
图1 取材深达黏膜肌层的胃黏膜切片(HE染色,×100)
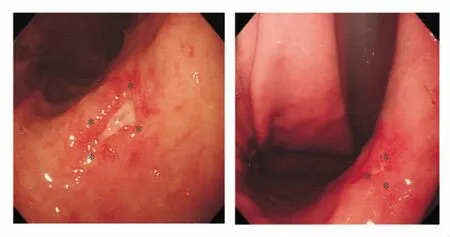
图2 溃疡病灶取材位置示意图
3.慢性胃炎取材:根据“中国慢性胃炎共识意见(全国第二届慢性胃炎共识会议2006年9月14~16日上海)”,取材块数和部位由内镜医师根据需要决定;一般取2~5块。如取5块(见图3),则胃窦2块取自距幽门2~3 cm处的大弯(A2)和小弯(A1),胃体取自距贲门8 cm的大弯(胃体大弯中部,B2)和距胃角近侧4 cm的小弯(B1)以及胃角(IA)各1块;对可能或肯定存在的病灶应另取材。用于科研的标本按照悉尼系统要求取5块活检。
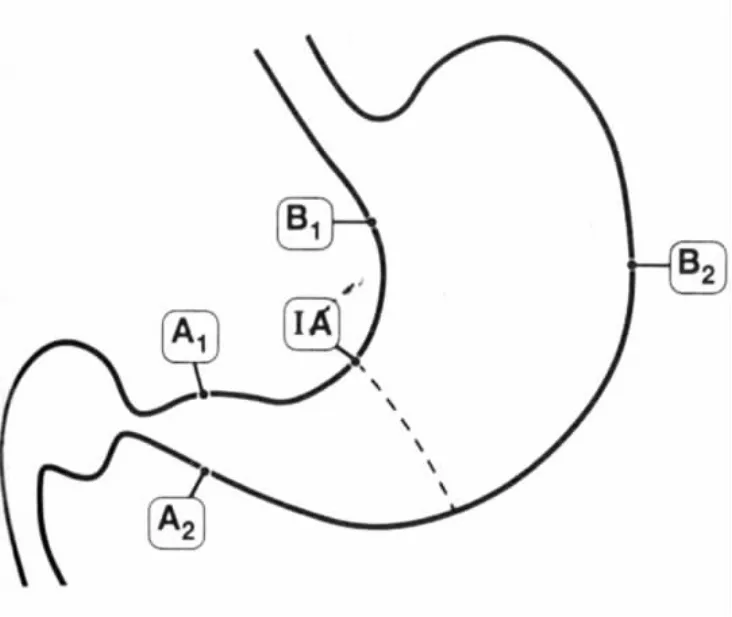
图3 新悉尼系统慢性胃炎的5点取材点示意图
4.肠镜活检取材:在病变和正常黏膜处多点取材。从盲肠至直肠(包括回肠末端)每隔10~20 cm黏膜活检1~2块。原则上在炎症受累区域多点取材;对溃疡病灶,应在溃疡基底、边缘、周围黏膜以及溃疡之间多点活检。包埋方向要正确(应保证大多数隐窝纵切)。
5.小肠活检注意点:活检后应立即固定;制片过程中应特别注意方向性,标准的小肠活检切片是黏膜腺体应垂直于黏膜肌(见图4),尽量避免斜切。
绒毛的形态与高度是诊断营养不良性疾病的主要判断依据。测量绒毛的高度是比较隐窝高度(crypt height,CH)和绒毛的高度(villous height,VH)。正常小肠 CH∶VH=0.43 ±0.1。乳糜泻时黏膜变平,绒毛萎缩但隐窝上皮增生,上皮内淋巴细胞增多,固有膜炎症细胞增多。Wipple病时绒毛变形,固有膜内有多量巨噬细胞浸润。α-重链病时固有膜弥漫性淋巴细胞和浆细胞浸润。
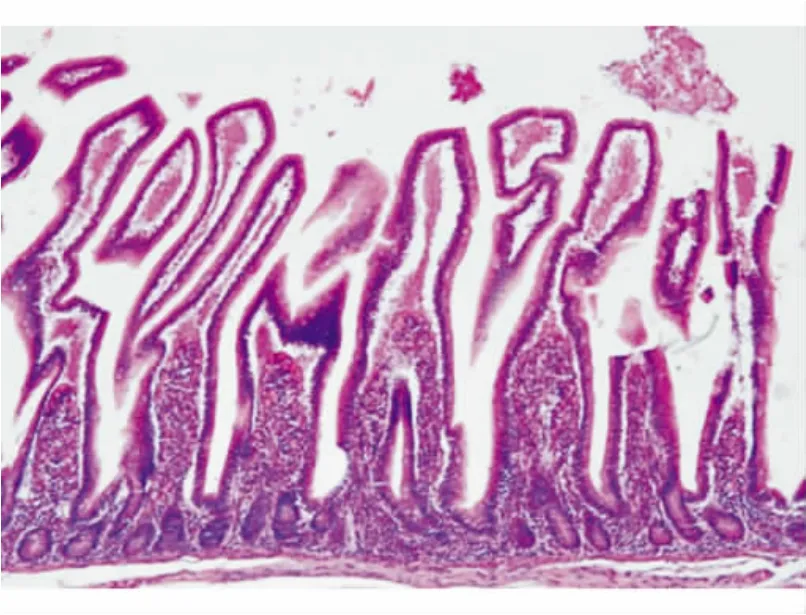
图4 小肠黏膜腺体垂直于黏膜肌(HE染色,×100)
二、标本的染色方法
除常规HE染色外,根据实验室习惯检测幽门螺杆菌(Helicobacter pylori,Hp)可选用 Giemsa染色、Warthin-Starry染色,根据需要可作 AB/PAS染色(pH 2.5)和HID/AB染色,以显示肠化生亚型。
三、黏膜活检加做黏液染色的好处
黏液染色是用AB/PAS染料显示细胞内黏液的方法,活检病理诊断应快速、准确和不漏诊,除常规染色和病理医师经验外,加做黏液染色对病理诊断有很大帮助。
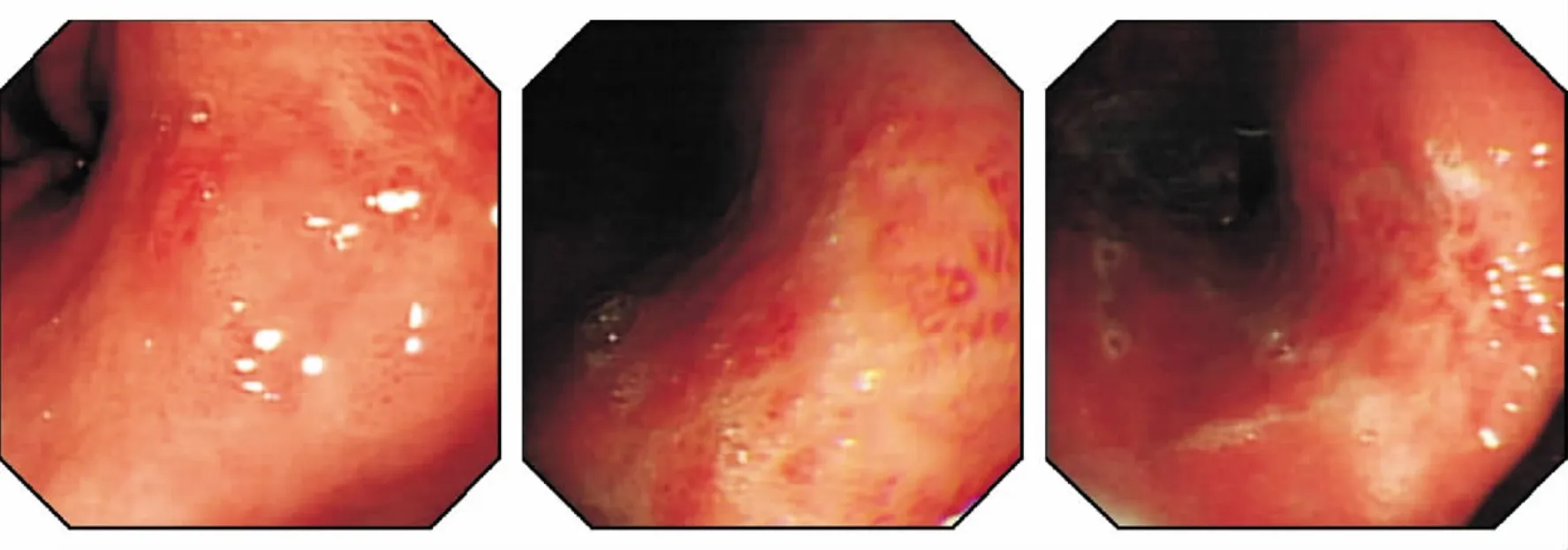
图5 胃炎样癌,胃镜示黏膜充血、糜烂
1.胃黏膜活检是诊断早期胃癌,尤其是微小癌最有效的诊断手段。早期胃癌的肉眼形态常不典型(见图5),表现为胃炎样癌、小胃癌、微小或片状糜烂、息肉癌变和假性愈合等,胃角、胃体多见,内镜较难判断其良恶性。近年来这类癌的比例逐渐增多。此外,由于PPI的广泛应用,部分早期胃癌病灶产生假性愈合,加大了诊断难度,使有些患者虽经多次活检仍不能确诊,延误治疗。刚开始发生癌变的细胞,缺乏恶性肿瘤的异型性,尤其是当细胞数量很少时,资深的消化病理医师也很难下肯定的诊断。当活检癌细胞数量很少时(见图6A),黏液染色对明确诊断有非常大的价值(见图6B),往往能显示HE染色切片难以发现的少量印戒细胞癌和(或)低分化腺癌,有助于早癌的诊断。
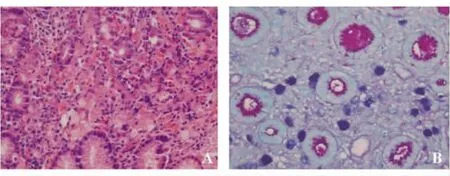
图6 胃黏膜活检病理切片
凡病理检查疑似恶性而胃镜检查无典型病变可寻者,有必要将原组织蜡块再多切、深切;必要时可加做黏液AB/PAS染色,或建议重取活检,或在短期内复查。
病例,男性,50岁,2008年10月27日胃镜检查示胃窦黏膜粗糙,散在充血糜烂灶(见图7),该处活检2块。病理检查发现其中1块黏膜(表面披覆上皮完好)浅层见小堆富含黏液的异型细胞(见图8A绿色虚线区),部分呈印戒样(AB/PAS染色阳性,见图8B),诊断为胃腺癌。手术标本检查胃黏膜未见明显充血、糜烂、溃疡或隆起病灶(见图9)。于胃角胃窦部,每隔2~3 mm逐一取材,共42块。病理诊断:胃窦Ⅱb型早期胃癌,范围约1.8 cm×1.5 cm(图中红色虚线处);以印戒细胞癌和低分化腺癌为主;癌组织呈膨胀性生长,局限于黏膜层内。癌旁黏膜中度慢性胃炎伴明显萎缩和肠化生;腺体呈多灶性异型增生,以轻度为主。
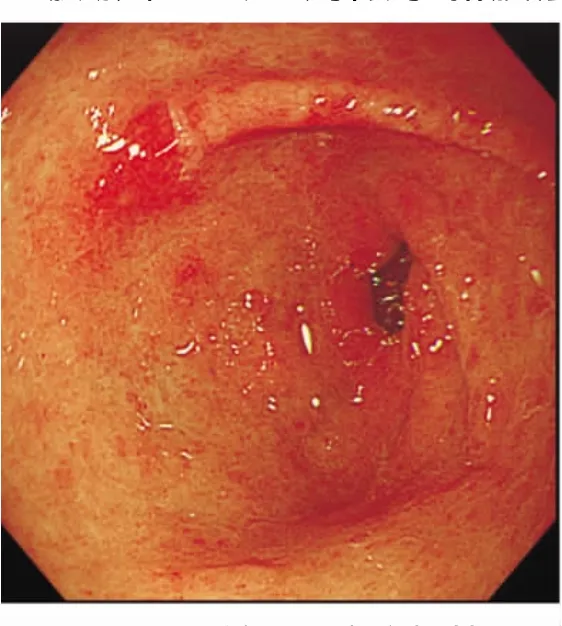
图7 胃镜示胃窦糜烂灶

图8 A:HE染色,×200,上皮下见小堆富含黏液的异型细胞;B:AB/PAS染色,×400,红色和蓝色为癌细胞
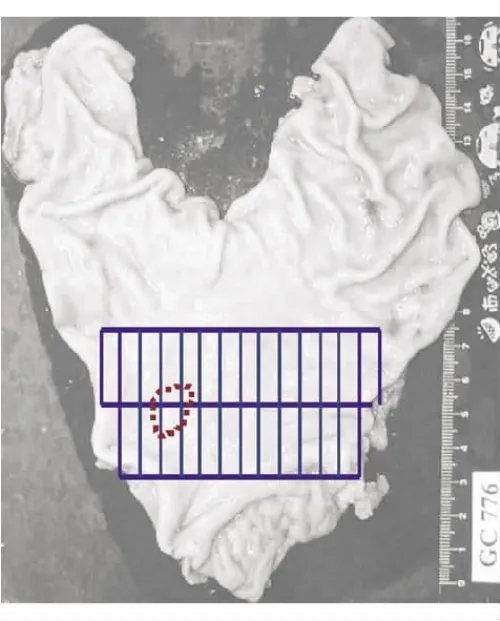
图9 远端胃大部切除标本
2.肠化生细胞的黏液改变先于形态改变,所以检查黏液是否改变,能发现常规染色不能显示的微小肠化生灶,并可进一步区分肠化生亚型:完全型还是不完全型肠化生,如再加作高铁双胺染色还能区分小肠型和大肠型。不完全型、大肠型肠化生与癌变关系较大。
3.上皮内中性黏液含量可反映溃疡愈合质量的高低,可推测溃疡复发的可能性,指导临床是否继续用药和用什么类型的药物。
4.反流性食管炎时,AB/PAS染色可发现是否有特殊类型上皮或隐性肠化生,协助诊断Barrett食管(见图10A、10B)。
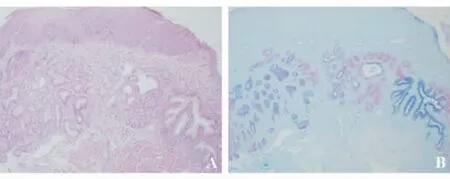
图10 食管黏膜固有腺体内出现酸性黏液(蓝色),提示隐性肠化生
5.对十二指肠球部隆起或凹陷病灶,AB/PAS染色可判断是否有胃上皮化生(见图11A、11B)。
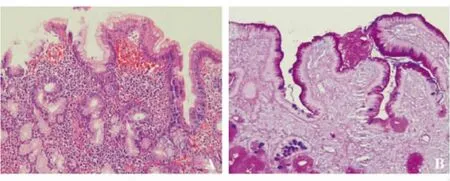
图11 十二指肠胃黏膜化生
6.AB/PAS染色可协助临床判断食管、十二指肠、小肠、直肠等部位的胃黏膜异位。
同样是辅助检查,AB/PAS染色与免疫酶标记检查相比,有费用少而报告快的优点,应提倡将其作为消化道活检标本病理检查的重要染色之一,列入常规工作。
内镜手术标本
一、标本的处理
内镜手术标本包括内镜黏膜切除术(EMR)和内镜黏膜下剥离术(ESD)的标本。
1.将切除组织黏膜面向上展平,避免过度伸展,用大头针将四周固定于软木板上,以4%甲醛溶液固定。
2.记录标本大小、肿瘤大小、肉眼类型等(可画图,如告之口侧端的应标注记号)。判断侧缘和底部断端阳性还是阴性。
3.确认病灶部和断端最狭窄部位,垂直于狭窄部平行取材,基本上间隔2 mm(见图12),记录取材数量。
二、组织学诊断内容
1.切除标本的大小(mm×mm)、所达深度。
2.肿瘤肉眼类型、大小(mm×mm)、组织学类型、浸润深度(M、SM1、SM2),有无溃疡、有无淋巴管和静脉浸润。可能时在图上标出癌的范围和浸润深度。
3.断端:周边断端(侧缘)和底部断端是否阳性。阴性时报告病灶到侧缘的距离(mm);阳性时报告阳性断端的切片数。
三、断端有癌的处理
1.黏膜层癌周边断端阳性:由于有烧灼效应,癌有可能不残留。可选择随访观察、再次EMR、微波或激光烧灼或胃部分切除。
2.浸润至SM1、无脉管侵犯:选择胃部分切除或补充说明情况后随访。
3.浸润至SM1、有脉管侵犯或浸润至SM2以下(底部断端阳性):追加胃手术切除,并清扫淋巴结。
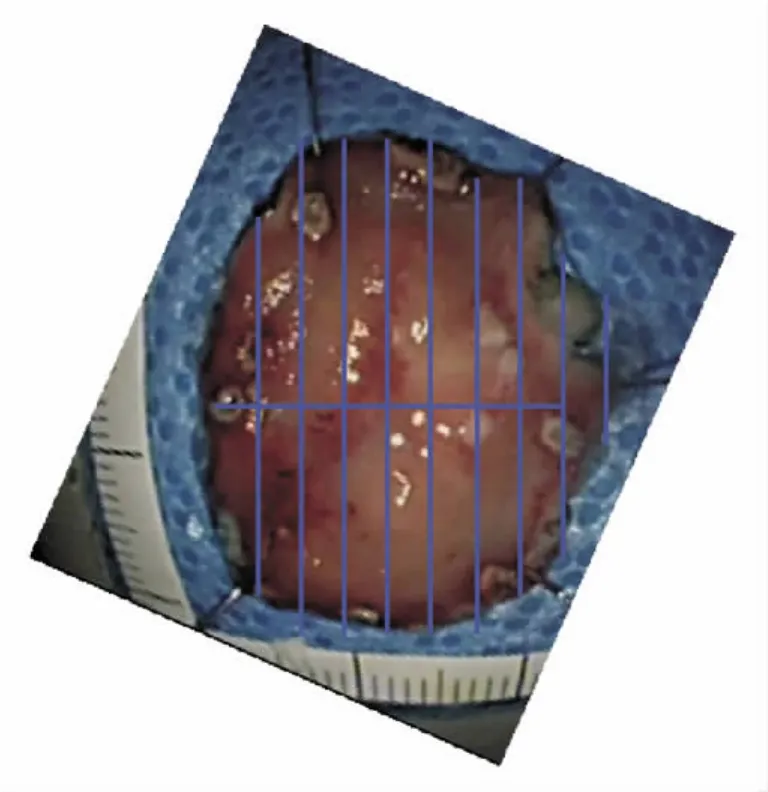
图12 内镜切除标本
四、断端阴性的随访
内镜随访最初1年内每3个月一次、第二年每6个月一次,2年后未复发者每年复查一次。国外资料显示,断端阴性病例随访中活检癌阳性率(复发率)为7%左右。
胃癌手术标本
一、标本检查和处理
基本原则:按一定顺序对整个切除胃作全面仔细的检查和记录,避免疏漏;取材部位、方法和数量应能够反映包括癌灶在内的胃的全部情况,代表性切面都能作组织学检查。
1.剪开和固定(见图13):①从浆膜面观察新鲜切除胃,明确癌有无浆膜(包括大网膜和小网膜)浸润。有浸润时测量并记录其位置、病灶边缘至两侧切除端的距离、浸润范围和性状。观察连同切下的组织器官(如胰腺和脾脏等)有无受累或黏连。②原则上沿大弯剪开,打开两侧闭锁线,完全暴露黏膜面。病灶在大弯侧的沿小弯剪开,切开线不得通过病灶重要部分(如浸润最深部)。③黏膜面向上展开,用大头针将其边缘固定于软木板上,以4%甲醛溶液固定。
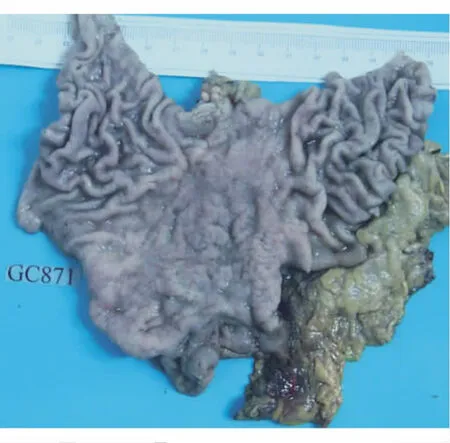
图13 示胃手术标本的检查和处理
2.取材:切除胃在固定前和(或)固定后加标尺照相,保存完整资料。①观察记录内容:大弯、小弯的长度以及两侧断端宽度,与食管、十二指肠相连者,记录长度和宽度。记录病灶位置、大小、厚度,病灶边缘到切除端的距离,与大小弯的关系。②原则上在小弯沿胃的长轴,从上切端到下切端取一长条全层组织,宽约0.5 cm,此基本上可代表切除胃的黏膜情况。③病灶取材:判断为早期癌时,应将肉眼能分辨的癌灶连续取材,直至离病灶边缘1.0 cm处。割开后对黏膜面再次照相,便于以后勾画出癌灶情况。进展期癌原则上在癌浸润最深处平行于小弯取材,根据需要也可垂直于小弯取材。④肉眼无明显病灶显示的标本,可能为Ⅱb型癌或微小癌,应对照影像学资料(内镜检查、X线摄片等),在对应部位广泛取材(见图9),可以只切取黏膜层和黏膜下层。报告一点癌的病例(即活检诊断癌而手术标本未检出癌),切取对应部的黏膜标本数不能少于30块(每块0.5 cm×2.0 cm)。⑤断端:与小弯垂直或平行切取离病灶最近处的两侧断端,0.5 cm以内发现癌者,为断端有癌。⑥残胃取材要考虑与缝合线、吻合线的位置关系。
3.淋巴结的检查和取材:①手术时根据解剖部位分离各组淋巴结,分瓶标记、固定。为免遗漏,病理医师对切除标本还需细致搜索大小弯侧网膜和软组织。希望检出15个以上淋巴结。②淋巴结取材应包含门部在内,从长轴方向取淋巴结,如无转移、认为有必要时可再从两侧各取1片。
二、胃癌的病理报告
应包括原发灶部位和大小、大体分型、组织学类型、有无淋巴管/静脉侵犯和淋巴结转移、上下切端有无累及、伴随病变等。必要时注明切除范围(见图9)。
1 Dixon MF,Genta RM,Yardley JH,et al.Classification and grading of gastritis.The updated Sydney System.International Workshop on the Histopathology of Gastritis,Houston 1994[J].Am J Surg Pathol,1996,20(10):1161-1181.
2 陈晓宇,施尧,刘文忠.胃炎的分类和分级-新悉尼系统[J].胃肠病学,1999,4(4):250-255.
3 陈晓宇.胃癌病理[J].胃肠病学,2002,7(3):170-171.
4 中华医学会消化病学分会.中国慢性胃炎共识意见(全国第二届慢性胃炎共识会议2006年9月14~16日上海)[J].胃肠病学,2006,11(11):674-684.
5 中华医学会消化病学分会.全国慢性胃炎研讨会共识意见[J].胃肠病学,2000,5(2):77-79.
6 陈晓宇.消化性溃疡的病理表现和诊断[J].胃肠病学,2004,9(1):34-35.
7 陈晓宇,施尧,彭延申,等.瑞巴派特可提高胃溃疡的组织学愈合质量[J].胃肠病学,2007,12(5):274-278.
8 陈晓宇,施尧,彭延申,等.幽门螺杆菌感染与十二指肠球部黏膜胃上皮化生的关系[J].中华消化杂志,2004,24(9):519-522.
9 刘彤华,夏求洁,刘复生,等.消化道疾病.见:白希清主编.病理学(下册).小肠[M].第2版.北京:科学技术出版社,1992:288-367.
10 吉田茂昭.胃癌治療—日本胃癌学会[J].日本内科学会雑誌,2002,91(2)特集:168-178.
11 陈晓宇,施尧.胃镜活组织检查和内镜下黏膜切除标本的病理检查规范[J].内科理论与实践,2010,5(3):252-255.

