抗坏血酸及抗坏血酸棕榈酸酯的稳定性研究
刘奕博,任国谱
(中南林业科技大学食品科学与工程学院,湖南长沙410004)
维生素C类添加剂在饮料、快餐食品、肉制品、乳制品等食品中应用十分广泛,抗坏血酸(AA)和抗坏血酸棕榈酸酯(AP)是GB2760-2011中允许添加的两种形式。抗坏血酸能为一系列生化反应提供还原力,它参与肉毒碱、组胺及其他肾上腺类固醇类激素的生物合成;通过为酶提供电子而使羟脯氨酸和赖氨酸羟基化,是胶原蛋白及结缔组织合成的必需物质[1]。在生物体液中它是具有保护作用的抗氧化剂,清除血浆中的自由基,保护细胞免遭活性氧损害[2]。流行病学数据显示,富含VC的食物能在一定程度上抑制喉癌、食道癌、胃癌等癌症[3-6]及冠心病、白内障等慢性疾病[7]。抗坏血酸棕榈酸酯保留了抗坏血酸的生理活性,并与抗坏血酸一同用作食品抗氧化剂,兼具营养性、无毒、高效、使用安全等优点[8]。丁健桦等[9]利用高效液相色谱较为全面的研究了存放时间、日照、氧化剂等对抗坏血酸稳定性的影响。P Špiclin 等[10]关注了溶剂类型、初始浓度、溶氧量、储藏条件对抗坏血酸棕榈酸酯的影响。本文系统对比研究两种添加剂在不同条件下的稳定性,旨在为生产加工中进一步合理应用提供理论指导。
1 材料与方法
1.1 材料与仪器
AA、AP Sigma-aldrich公司;无水乙醇、双氧水(30%)、氯化钠、氯化镁、氯化锰、氯化钙、氯化铁、氯化铜、盐酸、氢氧化钠、维生素E(VE)、葡萄糖、蔗糖。
电子分析天平、UV-1800紫外分光光度计 日本岛津公司;DELTA 320 pH计 梅特勒-托利多仪器(上海)有限公司;数显恒温水浴锅 北京永光明医疗器械公司。
1.2 实验方法
1.2.1 AA、AP溶液的制备 称取适量AA、AP,分别溶于蒸馏水、95%乙醇配成浓度约为2%的AA水溶液、AP乙醇溶液。
1.2.2 AA及AP的紫外光谱特性 将两种溶液用紫外可见分光光度计在200~300nm波长范围内扫描,测定其特征吸收光谱。
1.2.3 稳定性影响因素
1.2.3.1 光照的影响 将两种溶液分别在黑暗、日光灯、日光下放置不同时间,在最佳测定波长处测定吸光度。
1.2.3.2 温度的影响 将溶液于25、40、60℃恒温水浴锅中放置不同时间,在最佳测定波长处测定吸光度。
1.2.3.3 pH的影响 用适当浓度的盐酸和氢氧化钠溶液调节溶液的pH约为3、7、10。黑暗中放置不同时间,在最佳测定波长处测定吸光度。
1.2.3.4 氧化剂的影响 配制浓度分别为0.024%、0.048%、0.096%、0.24%、0.48%、0.96%的双氧水溶液,并分别与4%的AA水溶液、AP乙醇溶液以体积比1∶1混合均匀,黑暗中放置30min后在最佳测定波长处测定吸光度并扣除氧化剂本身的吸光度。
1.2.3.5 抗氧化剂的影响 将浓度为0.02%、0.04%、0.08%的VE乙醇溶液分别与4%的AA水溶液、AP乙醇溶液以体积比1∶1混合均匀,黑暗中放置不同时间,在最佳测定波长处测定吸光度并扣除VE本身的吸光度。
1.2.3.6 金属离子的影响 配制0.2%的Na+、Mg2+、Mn2+、Ca2+水溶液,0.002% 的 Cu2+、Fe3+水溶液,各金属离子溶液分别与4%的AA水溶液、AP乙醇溶液以体积比1∶1均匀混合,黑暗下放置不同时间,在最佳测定波长处测定吸光度并扣除金属离子本身的吸光度。
1.2.3.7 糖类的影响 配制浓度为1.0%、2.0%、4.0%、10.0%、20.0%的葡萄糖、蔗糖水溶液,分别与4%的AA水溶液、AP乙醇溶液以体积比1∶1均匀混合,黑暗下放置不同时间,在最佳测定波长处测定吸光度。
1.2.4 吸光度残留率的计算 吸光度残留率(%)=Abs2/Abs1×100,其中Abs2为不同时刻的吸光度,Abs1为初始吸光度。
实验过程中所有样品均盛放在具塞容器中,所有实验均重复三次,结果取平均值。稳定性以吸光度变化、吸光度残留率来描述。
2 结果与讨论
2.1 最佳测定波长的选择
由图1可知:200~300nm波长扫描范围内,AA水溶液、AP乙醇溶液的最大吸收峰波长分别为246.6、246.1nm,因此选择246nm为最佳测定吸收波长。
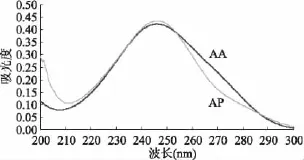
图1 AA和AP的紫外吸收光谱Fig.1 UV absorption curve of AA and AP
2.2 光照对AA和AP稳定性的影响
从图2可以看出,光会加速两种物质的破坏,AP的光稳定性强于AA。黑暗、日光灯下AA及AP较稳定,6h后的残留率分别在70%、85%以上。日光对AP的影响相对较小,6h后残留率在80%以上,但会造成AA显著的损失。光对维生素的破坏主要通过光氧化作用形成单线态氧,进一步作用于分子中的烯二醇结构生成多羰基化合物,吸收日光中的紫外线引发降解[11]。
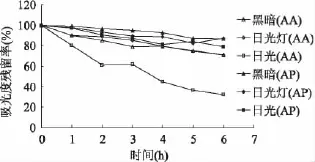
图2 光对AA和AP稳定性的影响Fig.2 Effect of light on stability of AA and AP
2.3 温度对AA和AP稳定性的影响
图3的结果表明,AA和AP的稳定性都随温度升高而降低。25℃、3h时AA、AP残留率为79.09%、95.60%,当温度上升至60℃时,AA及AP的残留率仅为13.05%和48.94%。但AP的热稳定性明显强于AA,常温下几乎不受影响。

图3 温度对AA和AP的影响Fig.3 Effect of temperature on stability of AA and AP
2.4 pH对AA和AP稳定性的影响
从图4可以看出,在pH3、pH7时,AA和AP差异不大。酸性环境下,两者都非常稳定;中性及碱性环境下,两者都有不同程度的损失。碱性条件可以促进氢离子的电离,从而加速AA、AP的损失,并且由图观察发现损失主要集中在30min内,可见破坏作用发生迅速,然而反应到一定程度后,残留率不会随时间增长而明显降低。

图4 pH对AA和AP稳定性的影响Fig.4 Effect of pH value on stability of AA and AP
2.5 氧化剂对AA和AP稳定性的影响
由图5得到,H2O2对AA影响较大。随浓度升高,AA残留率急剧下降,当浓度为0.48%,30min后AA损失约90%。相同条件下AP损失约为25%,说明H2O2对AP稳定性也会产生作用,但效果有限。
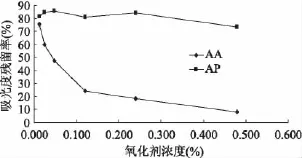
图5 H2O2对AA和AP稳定性的影响Fig.5 Effect of H2O2on stability of AA and AP
2.6 抗氧化剂对AA和AP稳定性的影响
从图6可以得到,对于AA,VE添加量越大,AA损失越快;反之,一定时间内AP则随着VE添加量增大,损失减少。从而推测:在水醇互溶的体系下,AA对VE起到保护作用;在醇溶液中,VE可以有效保护AP,从而降低其损失。
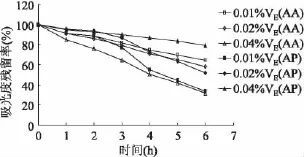
图6 VE对AA和AP稳定性的影响Fig.6 Effect of VEon stability of AA and AP
2.7 金属离子对AA和AP稳定性的影响
图7 结果显示,Na+、Mg2+、Ca2+、Fe3+对 AP 的稳定性几乎没有影响。Mn2+影响较显著,3h后残留率约为50%,可能与Mn2+外层电子构型为半充满有关[12]。相比 AP而言,金属离子对 AA的影响较明显。如图8所示,Na+、Ca2+影响较小,3h后残留率在70%以上;Mn2+、Fe3+对AA产生影响较大,3h后残留率只有50%;Mg2+在3h后造成AA约70%的损失,但原因有待进一步研究。
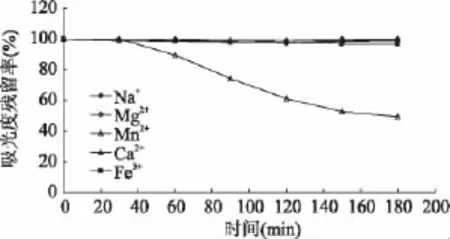
图7 金属离子对AP稳定性的影响Fig.7 Effect of metal ions on stability of AP
如表1所示,Cu2+对AA稳定性有很大影响,浓度为0.001%,10min后就基本上使 AA完全损失。AP则相对稳定很多,随时间增加只有微小的损失。
2.8 糖类对AA和AP稳定性的影响
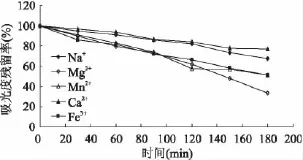
图8 金属离子对AA稳定性的影响Fig.8 Effect of metal ions on stability of AA
从表2~表3中得到,葡萄糖、蔗糖基本不会对AA、AP稳定性产生影响,但观察到随蔗糖浓度提高,AP吸光度值有轻微上升,可能与高浓度糖会降低氧气溶解度有关。

表1 铜离子对AA和AP稳定性的影响Table 1 Effect of Cu2+on stability of AA and AP
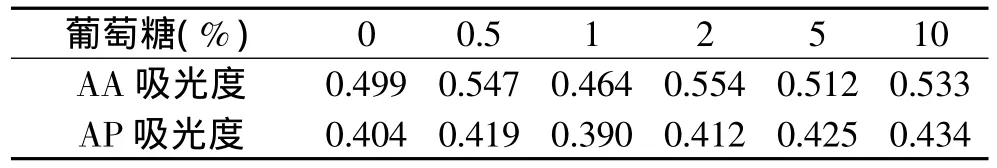
表2 葡萄糖对AA和AP稳定性的影响Table 2 Effect of glucose on stability of AA and AP

表3 蔗糖对AA和AP稳定性的影响Table 3 Effect of sucrose on stability of AA and AP
3 结论
3.1 日光、高温会加速AA及AP的破坏。AP的稳定性强于AA:日光下6h后残留率约是AA的2.5倍;AP稳定性常温下几乎不受影响,3h后的残留率达95.60%。
3.2 酸性环境中AA及AP都非常稳定,中性及碱性环境下,两者会有不同程度的损失。AA及AP在酸性、中性环境下表现差异不大,碱性环境下AA的稳定性较差。
3.3 过氧化氢对AA稳定性影响显著,对AP的影响不大。VE可以有效保护AP,但在水醇混合的体系中表现为AA保护VE。糖类基本不会对两者稳定性产生影响。
3.4 微量的铜离子就会引起AA较大的损失,铁离子、锰离子也会对AA稳定性造成一定影响。AP对常见金属离子均非常稳定,只有锰离子的影响较为显著,可能与其分子构型有关。
[1]Rosemary L S,Margaret D C,Earl S F,et al.Serum vitamin C and the prevalence of vitamin C deficiency in the United States:2003-2004 National Health and Nutrition Examination Survey(NHANES)[J].Am J Clin Nutr,2009,90:1252-1263.
[2]Carr A,Frei B.Does vitamin C act as a pro-oxidant underphysiological conditions?[J].FASEB J,1999,13:1007-1024.
[3]Block G.Vitamin C and cancer prevention:the epidemiologic evidence[J].Am J Clin Nutr,1991,53:270S-282S.
[4]Block G.Vitamin C status and cancer Epidemiologic evidence of reduced risk[J].Ann N Y Acad Sci,1992,669:280-290.
[5]Gonzalez CA,Pera G,Agudo A,et al.Fruit and vegetable intake and therisk of stomach and oesophagus adenocarcinoma in the European ProspectiveInvestigation into Cancer and Nutrition(EPIC-EURGAST)[J].Int J Cancer,2006,118:2559-2566.
[6]Bjelakovic G,Nikolova D,Simonetti RG,et al.Antioxidant supplementsfor prevention of gastrointestinal cancers:a systematic reviewand meta-analysis[J].Lancet,2004,364:1219-1228.
[7]Steffen LM,Jacobs DR Jr,Stevens J,et al.Associations of whole-grain,refined-grain,and fruit and vegetable consumption with risks of all-cause mortality and incident coronaryartery disease and ischemic stroke:the Atherosclerosis Risk in Communities(ARIC)Study[J].Am J Clin Nutr,2003,78:383-390.
[8]何松,林富强,陈永恒.L-抗坏血酸棕榈酸酯在煎炸油中应用研究[J].现代食品科技,2010,26(9):972-974.
[9]丁健桦,饶火瑜,王兴祥.HPLC法初步研究维生素C的稳定性[J].食品工业,2004(1):44-45.
[10]P Špiclin,M Gašperlin,V Kmetec.Stability of ascorbylpalmitate in topical microemulsions[J].International Journal of Pharmaceutics,2001,222(2):271-279.
[11]郑大贵,肖竹平,叶红德.VC硬脂酸酯和异VC硬脂酸酯乙醇溶液的稳定性研究[J].食品科学,2007,28(3):64-66.
[12]刘立红,刘立英.金属元素与VC关系的紫外吸收光谱研究[J].固原师专学报:自然科学版,2003,24(3):19-21.

