虎藻脂肝消胶囊对非酒精性脂肪性肝病大鼠脂质过氧化及胰岛素抵抗的影响*
苏娟萍 冯玛莉 靳桂春
山西省中医院脾胃病科 (山西太原,030012)
非酒精性脂肪性肝病 (non-alcoholic fatty liver disease,NAFLD)是指除外酒精和其他明确的损肝因素所致的,以弥漫性肝细胞大泡性脂肪变、伴或不伴炎症为主要特征的临床病理综合征。NAFLD虽通常被认为是一种良性及静止的病变,但可在较短期内发展为不可逆的肝损害,同时还可能是代谢综合征的原发疾病。近年来,NAFLD的发病率和检出率日渐增多,其肝纤维化的发生率高达25%,且约1.5% ~8%的患者可进展为肝硬化[1],在总人群中的患病率为15% ~30%左右,已成为一种全球性的疾病[2]。目前西药治疗以降脂及保肝药为主,但缺乏针对性治疗药物。虎藻脂肝消胶囊为笔者临床经验方,多年的临床应用显示其具有良好疗效。为进一步评价该药物治疗NAFLD的作用,为其临床用药提供依据,特对此复方制剂进行了实验研究。
1 材料与方法
1.1 材料
1.1.1 药物 虎藻脂肝消胶囊 (由虎杖、海藻、黄芪、决明子、黄柏、赤芍等药物组成),山西省中医药研究院制剂室提供。用时以蒸馏水分别配制成浓度为0.188g/ml、0.375g/ml、0.75g/ml的混悬液。多烯磷脂酰胆碱胶囊 (易善复),购自赛诺菲安万特 (北京)制药有限公司,批号D9098,用时以蒸馏水配制成浓度为11.4mg/ml的溶液。
1.1.2 试剂 花生油为市售,山东鲁花集团生产;脱氧胆酸钠、胆固醇购自天津大茂化学试剂厂 (批号:20090928、20100126);SOD、MDA试剂盒购自南京建成生物工程研究所,批号:20100302、20100302;葡糖糖试剂盒购自北京北化康泰临床试剂有限公司,批号:200910628;胰岛素试剂盒购自北京普尔伟业生物科技有限公司,批号:20100326。
1.1.3 动物 大鼠,SD种,清洁级,雌雄各半,体重 (200±10)g,山西省中医药研究院实验动物室提供,合格证号:SXCK(晋)-0002。
1.1.4 主要仪器 KDC-1044低速离心机 (科大创新股份有限公司中佳分公司);HH-W21电热恒温水箱 (上海医用恒温设备厂);BP310P电子天平 (德国赛多利斯公司生产);UV3000紫外可见光分光光度计 (日本岛津);DXC-800全自动生化分析仪 (美国贝克曼库尔特有限公司);XTL-2000光学显微镜 (上海宙山精密仪器厂)。
1.2 实验方法
1.2.1 动物分组及模型建立 取大鼠62只,适应性喂养1周后,随机分为正常对照组、模型对照组、阳性 (多烯磷脂酰胆碱)对照组、虎藻脂肝消胶囊低剂量组、中剂量组、高剂量组 (简称治疗低、中、高剂量组)共6组,除模型对照组12只外,其余每组10只。上述分组中正常对照组10只大鼠给予正常饲料,自由饮水。其余52只大鼠给予180g/L浓度的蔗糖水自由饮用,第1周每日以10ml/kg高脂乳剂灌胃,从第2周调整至20ml/kg,正常对照组大鼠每日以等量蒸馏水灌胃。高脂乳剂的制备参考文献报道[3],其主要成分质量分数为0.17的花生油、0.07的胆固醇、0.07的蔗糖、0.04的全脂奶粉及0.004的胆酸盐。持续12周后,随机取模型对照组大鼠两只行肝脏病理组织学检查,证实其发生轻~中度脂肪变性,造模完成。
1.2.2 给药 造模完成后,低、中、高剂量组大鼠每日分别以0.188g/ml、0.375g/ml、0.75g/ml浓度的虎藻脂肝消胶囊混悬液各20ml/kg灌胃。阳性对照组大鼠每日给予11.4mg/ml浓度多烯磷脂酰胆碱20ml/kg灌胃。模型对照组和正常对照组每日以等量蒸馏水灌胃。均自由饮用自来水,共持续6周。
1.2.3 指标检测 动物杀检前禁食12小时称体重,10%的乌拉坦溶液麻醉后腹主动脉取血,离心分离血清,-4℃保存用于生化指标检测。按照试剂盒说明书要求,采用TBA法测定MDA,氧化酶法测定SOD、FBG,放免法测FINS。以空腹血糖 (FBG) ×空腹胰岛素 (FINS)/22.5计算胰岛素抵抗指数 (HOMA-IR)[4]。
1.3 统计学方法 采用SPSS 11.5进行数据分析。计量资料采用t检验,等级资料采用秩和检验。以P<0.05为具有统计学意义。
2 结果
2.1 虎藻脂肝消胶囊对大鼠血清SOD、MDA的影响 模型组SOD较正常组显著降低而MDA显著升高 (P<0.01),提示模型组大鼠体内清除自由基的能力下降,且机体细胞受到自由基的攻击。中、高剂量组大鼠SOD与模型组相比显著升高,(P<0.05和P<0.01);而阳性对照组及低、高剂量组大鼠MDA与模型组相比显著降低 (P<0.05)。虎藻脂肝消胶囊对大鼠体内自由基的清除有显著改善作用。见表1。
表1 各组大鼠血清SOD、MDA检查结果比较(±s)
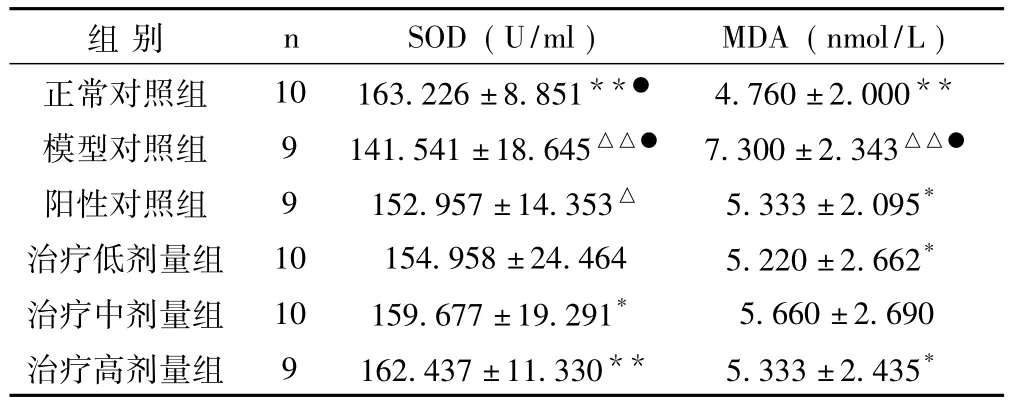
表1 各组大鼠血清SOD、MDA检查结果比较(±s)
与模型对照组比较,*P<0.05,**P<0.01;与正常对照组比较,△P <0.05,△△P <0.01; 与阳性对照组比较,●P <0.05
组别 n SOD(U/ml) MDA(nmol/L)正常对照组 10 163.226±8.851**● 4.760±2.000**模型对照组 9 141.541 ±18.645△△● 7.300 ±2.343△△●阳性对照组 9 152.957±14.353△ 5.333±2.095*治疗低剂量组 10 154.958 ±24.464 5.220 ±2.662*治疗中剂量组 10 159.677 ±19.291* 5.660 ±2.690治疗高剂量组 9 162.437±11.330** 5.333±2.435*
2.2 虎藻脂肝消胶囊对大鼠血糖、血清胰岛素及胰岛素抵抗指数的影响 模型组大鼠在FBG、FINS及HOMA-IR 3项指标上与正常对照组比较差异均有显著性意义 (P<0.01),提示存在胰岛素抵抗。低剂量组大鼠FBG与模型组比较显著降低 (P<0.05);FINS改善以阳性对照组及高剂量组明显 (P<0.01);而阳性对照组、低剂量组、高剂量组大鼠在HOMA-IR的改善上,与模型组比较差异具有显著性意义 (P<0.01),提示对模型大鼠的胰岛素抵抗有较好的改善作用。见表2。
表2 各组大鼠血清FBG、FINS、HOMA-IR检查结果比较(±s)
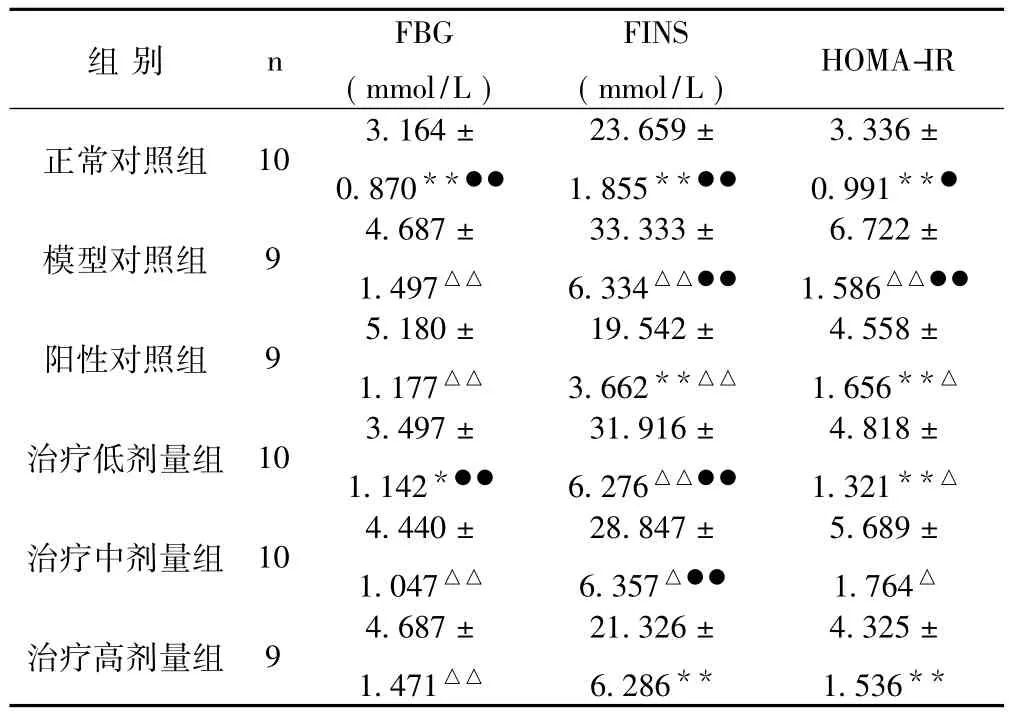
表2 各组大鼠血清FBG、FINS、HOMA-IR检查结果比较(±s)
与模型对照组比较,*P<0.05,**P<0.01;与正常对照组比较,△P<0.05,△△P <0.01; 与阳性对照组比较,●P <0.05,●●P <0.01
组别 n FBG(mmol/L)FINS(mmol/L)HOMA-IR正常对照组 10 3.164 ±0.870**●●23.659 ±1.855**●●3.336 ±0.991**●模型对照组 9 4.687 ±1.497△△33.333 ±6.334△△●●6.722 ±1.586△△●●阳性对照组 9 5.180 ±1.177△△19.542 ±3.662**△△4.558 ±1.656**△治疗低剂量组 10 3.497±1.142*●●31.916 ±6.276△△●●4.818 ±1.321**△治疗中剂量组 10 4.440±1.047△△28.847 ±6.357△●●5.689 ±1.764△治疗高剂量组 9 4.687±1.471△△21.326 ±6.286**4.325 ±1.536**
3 讨论
由于NAFLD影响因素众多,发病机制不明确,目前尚无治疗NAFLD的特效药物。1998年Day[5]提出了著名的“二次打击”学说,认为胰岛素抵抗 (IR)在NAFLD的发病机制中占有重要地位。研究提示,NAFLD可能是促炎和抑炎因子在IR初次打击的基础上触发或抑制氧化应激和肝内脂质过氧化不平衡,对细胞进行二次打击的结果[6]。
氧自由基有较强的生物学活性,能与生物膜上的多价不饱和脂肪酸作用,发生脂质过氧化反应,造成细胞及亚微结构的损害。自由基造成生物体系损伤的重要因素是产生脂质过氧化物,其中最主要的是MDA。脂质过氧化终产物MDA可形成蛋白加合物,刺激机体产生抗体,介导免疫损伤。SOD通过歧化作用清除体内氧自由基,减少脂质过氧化反应,维持生物膜的正常结构和功能,在自由基的产生与清除平衡中起着重要作用。
Mattews等[4]认为,基础状态下血糖和胰岛素的自我平衡是胰岛β细胞、肝脏、外周组织三者相互作用的结果,从而提出评估IR的数学模型-自我平衡模型分析法 (Homeostasis model assessment,HOMA):IR=(FBG × FINS)/22.5。有研究结果显示,其与公认的评价IR的“金指标”C-葡萄糖胰岛素钳夹技术 (glucose insulin clamp technique,CLAMP)相关性好[7]。
在前期的研究中,已证实虎藻脂肝消胶囊可降低大鼠血清中TG、TC、LDL-C水平,改善大鼠肝细胞脂肪变性程度,减轻脂肪对肝细胞造成的水肿以及炎症损害[8]。本实验提示其治疗NAFLD的作用可能与其减轻NAFLD患者胰岛素抵抗水平、增强机体氧自由基清除能力有关,但其具体机制尚需进一步深入研究。
[1]曾民德.脂肪肝[J].中华消化杂志,1999,19(2):120-122.
[2]石绣江,王晓忠,曾斌芳.非酒精性脂肪肝的研究进展 [J].新疆中医药,2010,28(2)73-75.
[3]张蕾,戴敏,陈礼明,等.高脂高糖诱导脂肪肝胰岛素抵抗大鼠模型的建立[J].中国药理学通报,2009,25(6):825-828.
[4]MATTEWS DR,HOSKER JP,RUDENSKI AS,et al.Homeostasis model assessment:insulin resistance and beta-cell function form fasting plasma.glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412-419.
[5]DAY C,JAMES O.Steatohepatitis:A tale of two “hits”? [J].Gastoenterology,1998,114(4):842-845.
[6]YCON D,LEE SH,PARK HS,et al.Hypoadipo-ncctincmia and insulin resistance arcassociated with nonalcoholic fatty liver disease[J].Korean Med Sci,2005,20(3):421-426.
[7]程莹,薛刚,胡晓莉,等.几种简易胰岛素抵抗检测方法的探讨[J].第三军医大学学报,2004,26(3):261-262.
[8]苏娟萍,冯玛莉,靳桂春,等.虎藻脂肝消胶囊对大鼠非酒精性脂肪肝的实验研究.山西中医,2011,27(11):45-48.

