猪脐静脉血管内皮细胞的分离及体外培养研究
余 乐,张思春,李 素,杨凡力,涂长春*
(1.吉林大学畜牧兽医学院,吉林长春 130062;2.军事医学科学院军事兽医研究所,吉林长春 130122)
血管内皮细胞为衬贴于血管内腔面的单层扁平细胞,它不仅在多种生理过程中发挥着重要的作用,而且在病原入侵时还是多种病毒如尼帕病毒、登革热病毒、埃博拉病毒等的靶细胞[1]。猪的血管内皮细胞是猪瘟病毒(Classical sw ine fever virus,CSFV)的主要靶细胞,其感染可引起严重的、特征性出血性病理变化[2]。原代细胞保持了细胞在生物体内时的大多数生理特征,与可在体外无限传代培养的细胞系相比,它们更真实地反映了正常生理条件下的细胞状态及功能。因此利用原代血管内皮细胞研究CSFV的致病机制具有重要意义。
虽然血管内皮细胞可以从主动脉、肺动脉、脐东脉等大血管以及多种微血管中分离获得[3-4],但从脐静脉中分离血管内皮细胞具有更多优点。首先是脐带取材容易,不需要宰杀动物;其次是数量丰富,采集的单根脐带长度可达20 cm以上,而从一窝新生小猪中可获得多根脐静脉血管。此外,脐静脉血管比脐动脉血管粗,内径大,柔韧性好,不会发生血管收缩,更容易操作。因此,对于需要大量制备猪原代血管内皮细胞来而言,从脐静脉分离是最佳选择。
血管内皮细胞的分离方法主要有组织块贴壁法、机械刮取法、灌注消化法和磁珠分离法。组织块贴壁法是将血管切成组织块后贴于培养皿中培养,让内皮细胞从组织块周围长出来。机械刮取法则是用消毒棉签或手术刀背等轻轻刮取血管的内膜面来获得内皮细胞。这两种方法一般可用于大血管的内皮细胞的分离。灌注消化法通过将消化液灌注入血管内腔,利用酶的消化作用使内皮细胞与血管组织分离[5]。磁珠分离法则是利用特异的介质(如表面有内皮细胞特异单克隆抗体的磁珠)从含多种细胞的悬液中将内皮细胞分离出来,多用于血管内皮细胞的进一步纯化[6]。
自Jaffe等建立灌注消化法以来,人脐静脉血管内皮细胞(Human umbilical vein endothelial cell,HUVEC)的分离培养已有近40年的历史[7]。灌注消化法也成为了获得脐静脉血管内皮细胞的最佳方法。可利用的消化酶有胶原酶、胰蛋白酶、中性蛋白酶(Dispase)[8]。胶原酶可分为Ⅰ型或Ⅱ型胶原酶。本研究在此基础上,对操作过程进行优化,以建立简单实用的猪脐静脉血管内皮细胞(Sw ine umbilical vein endothelial cell,SUVEC)分离及培养方法,为猪瘟病毒研究提供大量的原代血管内皮细胞。
1 材料和方法
1.1 脐带、细胞和病毒株 新生健康长白猪脐带采自长春市郊某猪场。PK-15细胞由本实验室保存;猪胎儿成纤维细胞(PEF)由吉林大学畜牧兽医学院欧阳红生教授提供。CSFV石门株血毒(105.33TCID50/0.1m L)由本实验室保存。
1.2 主要实验材料 Ⅰ型胶原酶、M 199培养基、肝素和FITC标记的兔抗猪IgG均购自Sigma公司;胎牛血清购自PAA公司;内皮细胞生长添加物(Endothelial cell growth supplement,ECGS)购自 BD Biosciences公司;Dil标记的乙酰化低密度脂蛋白(Dil-Acetylated Low Density Lipoprotein,Dil-Ac-LDL)购自Biomedical Technologies公司;兔抗人第VIII因子相关抗原多克隆抗体、羊抗兔IgG-Cy3抗体和正常山羊血清均购自武汉Boster公司。CSFV阳性血清由本实验室保存。
1.3 SUVEC的分离培养及传代 无菌采集新生仔猪脐带,每根长约15 cm~20 cm,2 h内分离血管内皮细胞。在生物安全柜内用止血钳取出并夹住脐带两端,放入75%乙醇中浸泡2 min后转入玻璃平皿内,剪去两端有夹痕的部分。纵向剥离脐带组织,分离出脐静脉血管(为脐带的3根血管中最粗的1根),用注射器灌注PBS冲洗血管内腔直到流出的液体清亮透明无血色为止。从血管一端灌注用M 199培养基配制的0.1%的Ⅰ型胶原酶溶液,下端有酶溶液开始漏出时用无菌细线结扎下端,继续注入酶溶液至血管微微膨胀,结扎注液端,放入含PBS的一次性细菌培养皿中,封口膜密封后37℃水浴消化10 min。剪去血管两端结扎处,用M 199培养基冲洗血管内腔,收集所有的细胞悬液于离心管中,1 000 r/m in离心5 Min,弃上清,加入SUVEC完全培养基(含20%FBS、75μg/mLECGS、2mmol/L谷氨酰胺、100μg/mL肝素、100μg/mL链霉素、100 IU/mL青霉素的M 199培养基)悬浮细胞后移入100 mm细胞培养皿,于37℃、5%CO2条件下培养,8 h后换液,以每2 d~3 d换液一次。将形成单层的内皮细胞,0.5 g/L胰蛋白酶-0.2 g/L EDTA消化分散细胞,按1∶2的比例传至新的细胞培养皿中进行传代。
1.4 SUVEC的鉴定
1.4.1 第Ⅷ因子相关抗原的鉴定将单层SUVEC细胞用4%多聚甲醛室温固定10 Min,0.2%Triton X-100 PBS处理10 Min,山羊血清室温封闭30 Min,兔抗人第Ⅷ因子相关抗原多克隆抗体4℃孵育过夜,二抗为羊抗兔IgG-Cy3抗体,37℃避光孵育30min,PBS洗涤后在荧光显微镜下观察。
1.4.2 细胞摄取Dil-Ac-LDL将SUVEC细胞、PK-15细胞(培养于含10%FBS、2 mmol/L谷氨酰胺的MEM培养液中)及PEF(培养于含20%FBS、1 mmol/L谷氨酰胺、0.1 mmol/L非必需氨基酸的DMEM培养基中)分别培养于96孔培养板中,培养36 h后弃培养液,每孔加入100μL含10μg/mL Dil-Ac-LDL的完全培养基,继续培养4 h后弃培养液,用PBS洗涤后在荧光显微镜下观察。
1.5 细胞生长曲线的绘制 将长满单层的第二代内皮细胞,胰酶消化后吹打成单细胞悬液并计数,用完全培养基稀释细胞至105个/mL,接种于24孔板,每孔500μL。每24 h分别取3孔细胞进行计数,取平均值,绘制生长曲线。
1.6 SUVEC对CSFV易感性试验 将第二代SUVEC消化后计数,以1×104/孔的数量接种96孔板,37℃、5%CO2培养24 h,接种CSFV石门株血毒,分别接种 2×103、1×103、5×102、2×102、102个TCID50/孔,每个梯度做3个重复,同时取PK-15细胞进行相同的处理。37℃吸附1 h后更换完全培养基继续培养48 h,进行间接免疫荧光(IFA)检测感染CSFV的细胞比例[9]。
2 结果
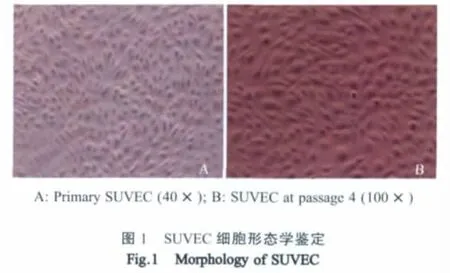
2.1 原代SUVEC的分离及培养 在相差显微镜下连续观察,原代血管内皮细胞在接种3 h~4 h后开始贴壁,多数细胞以团状形式存在,各团细胞的数目在几个至几十个不等,少数以单个细胞的形式存在。在培养8 h后换液时,细胞已完全贴壁,此时的细胞呈扁平圆形或短梭形,中央有卵圆形的核,折光性好。12 h后细胞开始迅速生长,在细胞团周围有大量细胞生长形成小岛状细胞集落,并能在2 d~4 d内形成细胞单层。单层的细胞呈典型的鹅卵石样镶嵌排列,形态均一、排列紧密(图1A)。
2.2 SUVEC的传代培养 将原代SUVEC进行连续传代培养,第2代~6代的细胞在接种于培养皿后贴壁和生长速度较快,接种后4 h大部分细胞已经贴壁,大约36 h长满单层(图1B)。第6代以后的SUVEC生长速度逐渐减慢,长满单层的时间延长,并且单层的细胞密度减小。细胞最多可培养至第10代,此时的细胞已不能长满单层,并且体积大、双核及多核的细胞较多,细胞表现出衰老细胞的典型特征,因此不能继续传代。体外培养的SUVEC存在接触抑制,当它们以单层状态再保持一定时间时,细胞彼此间接触更紧密,但并不表现出重叠或者堆积生长的趋势。
2.3 SUVEC的鉴定
2.3.1 内皮细胞第Ⅷ因子相关抗原检测第Ⅷ因子相关抗原是鉴定内皮细胞最常用的标志[10]。荧光显微镜下观察,在原代、第4代及第8代细胞的胞浆中可检测到大量第Ⅷ因子相关抗原特异性红色荧光,第Ⅷ因子相关抗原阳性率均接近100%(图2),而阴性对照无红色荧光,表明这些细胞表达内皮细胞特异性的第Ⅷ因子相关抗原。
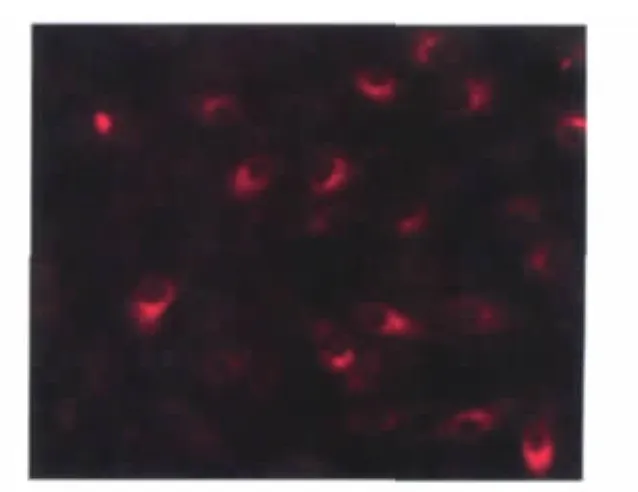
图2 SUVEC第4代第Ⅷ因子IFA检测(×100)Fig.2 Detection of vWF in SUVEC by indirect immunofluorescence at passage 4(100×)
2.3.2 内皮细胞摄取Dil-Ac-LDL鉴定只有内皮细胞和巨噬细胞可大量摄取Dil-Ac-LDL,因此Dil-Ac-LDL常用于鉴定和分离内皮细胞[11]。原代细胞、第3代、第8代细胞经Dil-Ac-LDL处理后,在荧光显微镜下观察核周可见大量明亮的红色荧光,阳性细胞率近100%(图3)。而对照的PEF和PK-15细胞呈阴性反应。
2.4 内皮细胞生长曲线的绘制 为了检测培养的内皮细胞的生长特性绘制了SUVEC生长曲线(图4)。图4结果显示,第3代内皮细胞在接种后延迟期小于1 d,细胞完成贴壁。第2 d开始生长速度加快,细胞数目呈指数增加,进入对数期,持续时间约为3 d。第5 d~6 d细胞数目稳定,处于平台期。第7 d细胞开始死亡脱落,细胞数目迅速减少。

2.5 CSFV感染SUVEC试验结果 相差显微镜下观察,CSFV感染内皮细胞不产生细胞病变,与感染PK-15细胞的特性完全一致。进一步用IFA方法检测内皮细胞和PK-15细胞接种病毒48 h后的感染情况。结果显示,接种102TCID50病毒量的内皮细胞感染率达50%左右,而接种相同量病毒的PK-15细胞感染率仅为25%左右。接种5×102TCID50病毒量的内皮细胞感染率已达80%以上,而PK-15细胞接种病毒量需达到103才能达到相同的感染率。在接毒量为2×103TCID50时,两种细胞的感染率均达到90%以上(图5)。
3 讨论

灌注消化法用于分离HUVEC已有近40年的历史[12],并逐渐成为分离HUVEC的最佳途径。我们借鉴分离培养HUVEVC的诸多经验[5,8],对灌注消化法进行一定的改进,使之更适合于SUVEC的分离培养。原有的灌注消化法直接在脐带中对静脉血管进行残留血液的冲洗、消化液的灌注及内皮细胞的收集。本方法则先分离出静脉血管,然后直接对静脉血管进行处理。与传统方法相比,本方法具有以下优点。首先,在处理多根脐带时,本方法既减小了操作对象的体积,所需的工具也更少更简单,可有效降低污染的风险。其次,直接对静脉血管进行各种液体的灌注比对整根脐带进行灌注更加方便。最终,可直观地观察血管内残血是否已洗尽,确保酶与细胞充分接触,使消化作用均匀有效。
灌注消化法分离血管内皮细胞时多使用胰蛋白酶、胶原酶,其中以Ⅰ型胶原酶最好。与胰蛋白酶相比,胶原酶具有作用温和、对细胞损伤小的优点,而且钙、镁离子和血清对胶原酶的活性没有影响。本实验以M 199培养基代替磷酸盐缓冲液配制胶原酶溶液,可进一步减小酶的消化作用对细胞的损伤。灌注胶原酶的静脉血管在37℃水浴中消化10 Min即可分离出大量的内皮细胞团块。消化更长时间可获得更多的细胞,但也增加了平滑肌细胞和PEF污染的机率,并且容易破坏血管壁,造成消化液外漏,也影响后续的细胞冲洗和收集。
内皮细胞对生长环境要求苛刻,体外培养困难,需要添加ECGS、肝素、胰岛素等[5]。ECGS含有多种细胞生长因子,如成纤维细胞生长因子、内皮细胞生长因子α和β[13]。肝素可以稳定ECGS多肽构象维持其的生物活性[14]。在培养基中加入ECGS和肝素可以明显地促进内皮细胞的生长及细胞活力,进而增加内皮细胞在体外的培养代数。采用本研究所配制的完全培养基进行原代培养时,细胞能在2 d~4 d内长满单层。而不添加ECGS和肝素时原代细胞一般需培养6 d~8 d才能长满单层[5]。前5代~6代的传代细胞生长迅速,每36 h左右就需要再次传代,此后细胞生长速度开始减慢,传代时间逐渐变长,直到细胞进入衰老状态而不能再进行分裂,总共可在体外培养10代左右。根据CSFV感染SUVEC结果显示,SUVEC比PK-15细胞对CSFV更敏感,有利于进行CSFV感染的蛋白质组学研究[15]。
内皮细胞体外培养的形态特征呈多角形,单层铺路石状排列,而可能污染的PEF和平滑肌细胞表现为细长状,平行排列,并能形成重叠层[12]。用于鉴定内皮细胞的特异性标志包括CD31、CD34、ICAM-1(Intercellular adhesion molecule-1)、VCAM-1(Vascular cell adhesion molecule-1)、第Ⅷ因子相关抗原等[11]。第VIII因子相关抗原,又称为Von Wellibrand因子,只表达于内皮细胞和巨核细胞中。此外,只有内皮细胞和巨噬细胞能够摄取Dil-Ac-LDL低密度脂蛋白,Dil-Ac-LDL被溶酶体降解后,其亲脂性的Dil分子聚集在溶酶体膜中,在549nm激发光下呈现红色荧光。本方法所分离培养的细胞在相差显微镜下呈典型的单层铺路石样排列,第Ⅷ因子相关抗原和Dil-Ac-LDL摄取均为阳性,阳性率均可高达100%,证明所获得的细胞为血管内皮细胞。
本方法具有良好的重复性,操作简便并且可有效防止细菌污染。本方法也可应用于其它动物脐静脉血管内皮细胞或其它类型血管内皮细胞的大量分离和体外培养,为以内皮细胞为材料的各种研究提供了一种可靠的操作方法及细胞鉴定方案。
[1]Valbuena G,Walker D H.The endothelium as a target for infections[J].Annu Rev Pathol,2006,1:171-198.
[2]Campos E,Revilla C,Chamorro S,et al.In vitroeffect of classical swine fever virus on a porcine aortic endothelial cell line[J].Vet Res,2004,35(6):625-633.
[3]Wu Zhen-hua,Hofman,Zlokovic B V.A simplemethod for isolation and characterization of mouse brain Microvascular endothelial cells[J].JNeurosciMeth,2003,130(1):53-63.
[4]Kajimoto K,Hossen MN,Hida K,et al.Isolation and culture of Microvascular endothelial cells from murine inguinal and epididymal adipose tissues[J].J Immunol Meth,2010,357(1-2):43-50.
[5]Baudin B,Bruneel A,Bosselut N,et al.A protocol for isolation and culture of human umbilical vein endothelial cells[J].Nat Protoc,2007,2(3):481-485.
[6]孙振朕,蔡在龙,朱科明,等.小鼠肺微血管内皮细胞磁珠分选法分离和原代培养[J].中国组织工程研究与临床康复,2010,14(50):9366-9369.
[7]Jaffe E A,Nachman R L,Becker C G,et al.Culture of human endothelial cells derived from umbilical veins.Identification by morphologic and immunologic criteria[J].J Clin Invest,1973,52(11):2745-2756.
[8]Mano Y,Sawasaki K,Takahashit,et al.Cultivation of arterial cells from human umbilical cord[J].Experientia,1983,39(10):1144-1146.
[9]徐兴然,郭焕成,史子学,等.通过基因组定量研究猪瘟病毒在细胞中的增殖特性[J].微生物学报,2007,47(5):800-804.
[10]Beekhuizen H,van Furth R.Grow th characteristics of cultured human macrovascular venous and arterial and microvascular endothelial cells[J].JVasc Res,1994,31(4):230-239.
[11]Voyta JC,Viad P,Butterfield C E,et al.Identification and isolation of endothelial cells based on their increased uptake of acetylated-low density lipoprotein[J].JCell Biol,1984,99(6):2034-2040.
[12]Nachman R L,Jaffe E A.Endothelial cell culture:beginnings of modern vascular biology[J].JClin Invest,2004,114(8):1037-1040.
[13]Maciag T,Cerundolo J,Ilsley S,et al.An endothelial cell growth factor from bovine hypothalamus:identification and partial characterization[J].Proc Natl Acad Sci USA,1979,76(11):5674-5678.
[14]Schreieber A B,Kenney J,KowalskiW J,et al.Interaction of endothelial cell growth factor w ith heparin:characterization by receptor and antibody recognition[J].Proc Natl Acad Sci USA,1985,82(18):6138-6142.
[15]Li Su,Qu Hui,Hao Jian-wei,et al.Proteomic analysis of primary porcine endothelial cells after infection by classical swine fever virus[J].Biochim Biophys Acta,2010,1804(9):1882-1888.

