新城疫病毒感染鸡肾脏组织蛋白质组学方法条件的优化
于德民,韩宗玺,邵昱浩,刘晓丽,孔宪刚,刘胜旺
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽传染病研究室,黑龙江哈尔滨 150001)
采用蛋白质组学方法研究病毒感染组织细胞后差异表达的蛋白质,能够更有效地发现直接或间接参与病原复制的细胞蛋白[1]。双向凝胶电泳(2-DE)技术结合质谱(MS)鉴定的差异蛋白质组学可以有效地分析病毒感染细胞的分子背景[2]。目前,2-DE结合MS方法在研究病毒与宿主组织细胞的相互作用关系中已得到广泛应用[3-6]。为分析新城疫病毒(Newcastle disease virus,NDV)感染鸡肾脏后,病毒诱导组织蛋白的表达变化情况,本实验对双向电泳条件进行一系列控制与优化,建立了鸡肾脏组织2-DE,并对2-DE图谱上的差异蛋白点进行了初步分析,并利用荧光定量PCR对其中的差异蛋白进行验证,为深入研究NDV的致病机理奠定了基础。
1 材料和方法
1.1 病毒株和实验动物 La Sota疫苗株由本实验室保存;30只SPF鸡由中国农业科学院哈尔滨兽医研究所实验动物中心提供。
1.2 主要试剂与仪器 固相化24 cm干胶条(pH4~pH 7、线性)、IPG 缓冲液(pH4~pH7)、2-D Quant kit、2-D Clean-up kit、Protease inhibitorM ix、Nuclease Mix、考马斯亮蓝 R350(PhastGel Blue R)均购自GE Health-care公司;High-Capacity cDNA Reverse Transcription Kits、SYBR Green PCR Master Mix均购自ABI公司;RNeasy Mini Kit购自Qiagen公司;Ettan IPGphorⅢ固相pH梯度等电聚焦仪、SE600 Ruby标准垂直电泳系统、Image ScannerⅢ图像扫描仪、ImageMaster 2D Platinum6.0图像分析软件均为GE Health-care公司产品。
1.3 组织样品的制备 将30只SPF鸡分为两组,每只鸡接种100μL(106EID50)病毒,分别在接种疫苗后的3 d、7 d、12 d和21 d采取鸡肾脏组织,液氮研磨,取100 mg样品加入1 ML裂解液(7 M尿素、2 M硫脲、4%CHAPS、40 mM DTT 2%IPG buffer pH3~pH10 or pH4~pH7、1%Nuclease Mix、1%蛋白酶抑制剂),室温放置3 h,每15 min震荡一次。15 000 r/min 4℃离心1 h。取上清,采用2-D Clean-up试剂盒对蛋白质进行纯化。
1.4 蛋白浓度的测定 采用蛋白定量试剂盒计算待测样品浓度,每个测试样品做3次重复,以3个重复值中最接近的两个值的平均值作为最终浓度。
1.5 双向凝胶电泳
1.5.1 第一向电泳根据计算所得的样品浓度及其所需上样量,计算样品所需体积,并且用水化液(7M尿素、2M硫脲、4%CHAPS、40 mM DTT 2%IPG buffer pH3~pH 10 or pH4~pH7)补足体积到450μL。13 000 r/min 20℃离心10 Min,取上清。将样品均匀加入胶条槽中,在每根胶条上覆盖1.5m L矿物油,按优化的等电聚焦参数进行胶条水化和等电聚焦过程,整个过程的温度设置为20℃,每根胶条限流50μA,结束后取出IPG胶条,除去胶条上的矿物油及多余样品,将胶面朝上转移到平衡管中,进行胶条平衡和第二向凝胶电泳。
1.5.2 胶条的平衡将胶条用平衡缓冲液Ⅰ(6mmol/L尿素、0.375 mmol/L Tris-HCl pH8.8、20%丙三醇、2%SDS、2%DTT;20m L/24 cm 胶条)平衡 15min;转入平衡缓冲液Ⅱ(6 mmol/L尿素、0.375 mmol/L Tris-HCl pH8.8、20%丙三醇、2%SDS、2.5%碘乙酰胺;20m L/24 cm胶条)中平衡15min。
1.5.3 第二向电泳同时灌制6块12%SDS-PAGE凝胶,将平衡的胶条置于凝胶上方,用0.5%低熔点琼脂糖凝胶溶液封闭胶条,待其凝胶凝固后进行第二向电泳。在16℃恒温循环水浴系统中进行电泳。电泳条件:1 W/胶条功率条件下电泳60 Min后,再以5W/胶条功率电泳约7 h,直至溴酚蓝指示剂离分离胶下缘约1 mm时停止电泳。
1.6 凝胶染色 电泳结束后取出凝胶于固定液中固定2 h,10%乙酸敏化15 min,染色液染色8 h或过夜,最后更换10%乙酸脱色液脱色至背景清楚。
1.7 凝胶扫描和图像分析 脱色的凝胶经ImageScanner扫描仪扫描,获得的凝胶图谱采用ImageMaster 2D Platinum 6.0进行图像对比度调节、蛋白质点检测、背景消减、蛋白点匹配,以及表达差异蛋白点的检测。表达点强度值在感染组和未感染组比值达到1.5倍以上为上调显著(ratio of infected/mock≥1.5,p≤0.05),表达点强度值在未感染组和感染组比值达到1.5倍以上为下调显著(ratio of mock/infected≥1.5,p≤0.05)。只有3个样本中均重复出现的差异点才可以被鉴定为差异表达蛋白。
1.8 胶内酶切及质谱鉴定 将表达的差异蛋白点由凝胶中切出置于EP管中,由上海中科新生命有限公司进行质谱鉴定。将肽质量指纹图(PMF)结合MS/MS串联质谱数据利用MASCOT检索NCBI nr数据库,种属选择为鸡,蛋白鉴定标准为:离子得分置信区间(C.I.%)≥95%。
1.9 组织RNA的提取及荧光定量PCR分析 肾脏组织总RNA的提取按照RNeasy Mini试剂盒说明书进行。根据相关基因设计引物,以18S RNA(FP:CGGACAGGATTGACAGATTGAG; RP: GCCAGA GTCTCGTTCGTTATC)为内参基因,对相关基因进行检测。反转录按照High-Capacity cDNA Reverse Transcription试剂盒说明书进行。荧光定量PCR参照SYBR Green PCR Master Mix试剂盒说明书进行。
2 结果
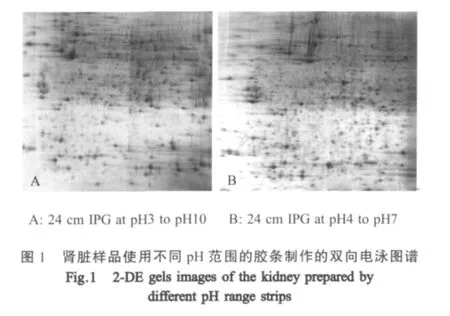
2.1 鸡肾脏组织双向凝胶电泳方法的建立 采用细胞裂解液处理法对肾脏组织进行总蛋白提取,在进行正式双向凝胶电泳分析之前,分别对胶条pH范围、水化条件、等电聚焦、胶条平衡、凝胶染色方法等变量进行控制与优化。不同pH胶条显示,采用pH3~pH10的IPG胶条进行电泳时,蛋白点主要集中在pH4~pH 8范围内(图1-A),选用pH4~pH 7的线性IPG胶条,蛋白点则均匀地分布在整块胶上并且形状比较规整(图1-B)。经上述条件优化表明:对于鸡肾脏组织而言,采用24 cm pH4~pH 7线性IPG胶条,以1.3mg的上样量在12%的SDS-PAGE凝胶中进行二向分离的效果较好。
2.2 NDV感染CEF电泳图谱分析 采用Image-Master6.0分析图像可以检测到1 400个左右的蛋白点,多数蛋白点集中在凝胶的中间区域。3次2-DE批内蛋白点在重复样品的匹配率达到90%以上,表明电泳图谱的分辨率高、重复性好,为分析NDV感染前后CEF总蛋白表达差异奠定了基础。共检测到29个蛋白点存在差异(图2),其中有15个蛋白点表达上调,有14个蛋白点表达下调。

图2 部分差异表达蛋白Fig.2 The 2-DE profiles of some differentially expressed proteins
2.3 差异蛋白点质谱鉴定结果 将4个差异表达蛋白(K5、I17、A11和A22)经胶内酶切后进行MALDI-TOF/TOF质谱分析,Mascot检索NCBInr数据库进行鉴定。参考UniProt Know ledgebase蛋白数据库注释信息进行鉴定(表1)。
2.4 差异表达蛋白基因的荧光定量PCR分析 将K5、I17、A11、A22 4个差异表达蛋白对应基因在转录组水平进行验证,以看家基因18S RNA为内参,进行相对定量。荧光定量PCR在mRNA水平的分析结果同双向电泳图像分析结果一致(图3)。
3 讨论
不同来源、不同组织样品的2-DE,一般都需要优化其最佳试验条件[7]。本研究分别优化了组织的清洗办法、鸡肾脏组织蛋白的裂解和纯化办法、一向的最佳上样量、一向电泳的最佳电压程序。由于肾脏组织包含比较多的血液,血液中蛋白不但干扰肾脏组织蛋白的分析,而且血液中的盐分干扰一向聚焦,进而影响到凝胶的重复性,因此在研磨和裂解蛋白前对肾脏组织的清洗是非常必要的。本研究通过4℃PBS将肾脏组织中的血液洗净,又通过短暂的低温条件下离心去除PBS,然后进行蛋白纯化,有效地降低一向聚焦电流(结果未列出),取得了较好的结果,TCA/丙酮沉淀法纯化蛋白的电泳图谱中虽然横竖条纹较少,但导致部分蛋白点的丢失(结果未列出)。通过使用2-D Clean up试剂盒可以获得比较好的纯化结果。
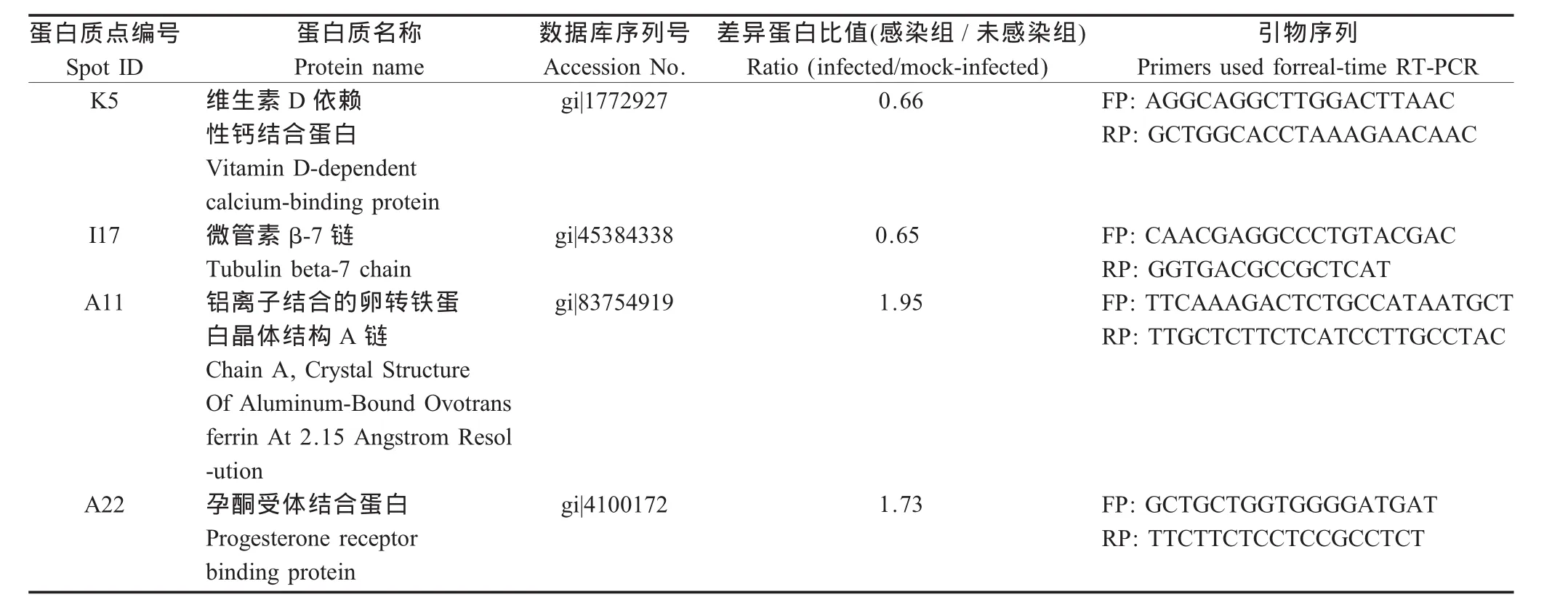
表1 4个差异表达蛋白的质谱鉴定结果和对应的引物Table 1 Summary of proteins differentially expressed in kindey tissues infected by NDV and the corresponding primers

选择合适的胶条型号是双向电泳条件优化的重要内容。为了首先得到该组织凝胶图的全貌,首先制作24 cm pH3~pH 10的凝胶,分析显示胶中蛋白点在其中pH4~pH 8范围内比较集中,形状规则,因此利用24 cm pH范围pH4~pH 7胶条制作凝胶,得到预期结果,24 cm pH4~pH7 IPG的胶条上样量通常为1.0 mg~1.4 mg,上样量低可以很好地分离蛋白点,而上样量高更利于低丰度蛋白的分析,因而通过实验摸索我们得出对于24 cm pH4~pH7 IPG胶条而言,使用1 300 ug的上样量,就本实验而言,可以取得良好的结果。
保证双向凝胶电泳结果的稳定性和重复性,是蛋白质组学研究的关键。本实验通过对每一个时间点对照和疫苗接种的6只鸡进行独立配对,分为3组,并对每一组进行独立的平行试验和分析,最终取在3组中共同存在的差异蛋白确认为最终的差异蛋白。减少了生物个体之间的差异,同时对每一组的两个样品相同条件下同时进行一向和二向的电泳以及后期凝胶分析,尽可能减少6张胶之间的技术差异,保证双向凝胶电泳结果的稳定性和重复性。
蛋白的翻译后修饰使得mRNA量不能与蛋白水平一致[8-10],但应用相对荧光定量技术验证双向电泳结果被广泛采用。本研究通过荧光定量PCR对7dpi的4种差异蛋白进行mRNA水平的检测,结果与双向结果保持一致。证明了本研究建立的以双向电泳为基础的蛋白质组学技术的可靠性和重复性。
本实验中检测到的差异表达蛋白有待于进行质谱鉴定,为NDV和宿主细胞的相互作用机制、揭示NDV的可能致病机制等提供有意义的信息。
[1]Tang Heng-li,Peng Tao,Flossie W S.Novel technologies for studying virus-host interaction and discovering new drug targets for HCV and HIV[J].Curr Opin Pharmacol,2002,2:541-547.
[2]Maxwell K L,Frappier L.Viral proteomics[J].M icrobiol Mol Biol Rev,2007,71:398-411.
[3]Alfonso P,Rivera J,Hernáez B,et al.Identification of cellular proteinsmodified in response to A frican swine fever virus infection by proteomics[J].Proteomics,2004,4(7):2037-2046.
[4]Hsiao-Ching S L,Erik JS,M ichael B G.A mass spectrometrybased proteom ic approach to study Marek's disease virus gene expression[J].JVirol Meth,2006,135:66-75.
[5]Zheng Xiao-juan,Hong Lian-lian,Shi Li-xue,et al.Proteomic analysis of host cells infected w ith infectious bursal disease virus[J].Mol Cell Prot,2008,7:1810-1823.
[6]Kathryn S L,Azam R,Paul D.Two-dimensional gel electrophoresis:recent advances in sample preparation,detection and quantitation[J].Electrophoresis,2001,22:906-918.
[7]Wang Sheng-bing,Hu Qiang,Sommerfeld M,et al.An optim ized protocol for isolation of soluble proteins from Microalgae for two-dimensional gel electrophoresis analysis[J].JApp Phyco,2003,15:485-496.
[8]Gygi S P,Rochon Y,Franza B R,et al.Correlation between protein and mRNA abundance in yeast[J].Mol Cell Biol,1999,9,1720-1730.
[9]Shackelford J,Pagano JS.Targeting of host-cell ubiquitin pathways by viruses[J].Essays Biochem,2005,41:139-156.
[10]Meredith D M,Lindsay JA,Halliburton IW,et al.Post-translational modification of the tegument proteins(VP13 and VP14)of herpes simplex virus type 1 by glycosylation and phosphorylation[J].JGen Virol,1991,72:2771-2775.

