两株鹅源H6N2亚型禽流感广东分离株的全序列分析及致病性研究
罗维玉,胡永浩,邓国华,施建忠,丁晴微,王明芳,张文亮,陈化兰*
(1.甘肃农业大学,甘肃兰州 730070;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/农业部动物流感重点实验室,黑龙江哈尔滨 150001)
禽流感是由A型流感病毒引起的一种禽类的感染/疾病综合征。禽流感病毒(Avian influenza virus,AIV)在野生水鸟、大多数家养水禽、海鸥、滨鸟中广泛存在[1-2]。AIV基因组由8个独立单股负链RNA节段组成,根据流感病毒血凝素(HA)和神经氨酸酶(NA)抗原性的差异,将A型流感病毒分为16种HA亚型和9种NA亚型[3]。由于其基因组的分节段性以及复制过程中RNA聚合酶缺乏矫正功能,导致AIV变异频繁,亚型组合众多[4]。高致病性AIV H5、H7对养禽业的严重危害性和公共卫生意义一直倍受关注。但低致病性AIV(LPAIV)同样给养禽业造成损失。有研究指出,北美与欧洲部分地区的鸭群中H3、H4及H6亚型流感病毒的分离率最高[5],近年在我国H6亚型出现的频率也越来越高,并且有证据显示已经在人体中检测到H6亚型AIV的抗体[6],因此H6亚型LPAIV的公共卫生学意义应予以重视。本实验对两株鹅源H6N2亚型AIV进行全基因组的序列测定和相关的动物致病性试验,并研究其相关的生物学特性。
1 材料和方法
1.1 病毒株及实验动物 所有病毒株均由国家禽流感参考实验室分离、纯化并保存;SPF鸡胚及SPF鸡均购自哈尔滨兽医研究所实验动物中心;BALB/c小鼠购自北京维通利华实验动物技术有限公司。
1.2 主要试剂TaqDNA聚合酶、dNTPs和分子量Marker均购自宝生物工程(大连)有限公司;反转录酶、LS TRIzol RNA提取试剂购自Invitrogen公司;胶回收试剂盒购自上海华舜生物工程公司;BigDye Term inator测序试剂盒3.1 version购自ABI公司;完全佐剂、β-丙内酯购自Sigma公司。
1.3 基因组分析
1.3.1 RNA的提取及RT-PCR扩增采用LS TRIzol试剂盒,按说明书方法提取病毒RNA,反转录后进行PCR扩增,产物采用胶回收试剂盒纯化。
1.3.2 序列测定与分析采用BigDye Terminator测序试剂盒3.1 version,按照说明书进行。利用DNAStar软件中Seqman拼接序列,应用MegAlign(By Clustal V Method)进行同源性比较和进化分析,MEGA5(Construct/Testmaximum likelihood tree)绘制各基因片段的进化树。
1.4 抗原分析
1.4.1 制备免疫血清将病毒接种SPF鸡胚48 h后,收取鸡胚尿囊液,浓缩至血凝价7log2~8log2后与弗氏不完全佐剂1∶1混合,乳化后于鸡肌肉多点注射免疫。一个月后采血分离血清。
1.4.2 交叉血凝抑制(HI)试验利用病毒及其特异性血清,按照OIE标准HI方法进行交叉HI试验。
1.4.3 抗原差异性分析抗原差异r值的计算方法按照《动物病毒学》第二版的方法进行。如果r值为1,表示两株病毒的抗原性相同;如果0.67≤r≤1.5,表示两株病毒间无明显差异;0.5≤r≤0.67,表示两株病毒间抗原性差异较小;r<0.5,表示两株病毒间差异显著;r值越小表示抗原性差异越大。以此为依据划分病毒抗原性分类。
1.5 动物感染试验
1.5.1 SPF鸡感染试验按照每只鸡106EID50/100μL的病毒量鼻腔接种13只SPF鸡,另外两只接种等体积PBS作为对照,于负压隔离器中饲养。感染后连续8 d采集泄殖腔和喉头拭子,并接种鸡胚进行病毒分离、滴度测定,分析其排毒规律。感染3 d后每株病毒采取3只鸡的组织脏器(脑、胸腺、气管、心、肝、脾、肺、肾、盲肠扁桃体、法氏囊)用于病毒分离滴定,感染21 d后采集血液,检测血清阳转情况。
1.5.2 BALB/c小鼠感染试验按照每只106EID50/50μL的病毒量鼻腔接种8只BALB/c小鼠,接种后第3 d剖杀3只,采集脑、鼻甲、脾、肾和肺用于病毒分离滴定;其余5只连续观察14 d,并记录体重变化情况。
2 结果
2.1 序列及进化分析
2.1.1 HA基因的序列及进化分析两株病毒的HA基因开放阅读框均为1 701 bp,编码566个氨基酸残基,均无碱基的插入和缺失,裂解位点339PQIETR↓GLFG348,具有典型的LPAIV的HA基因特征。存在8个潜在的糖基化位点(Asn-X-Ser或Thr),其中6个位于HA1第26位、27位、39位、182位、306位和311位,2个位于HA2第498位和557位[7]。受体结合位点Q226G228,(以H3亚型病毒为参照)表明病毒偏向与和α-2,3连接的唾液酸结合,为禽类易感病毒的特异性氨基酸。HA基因进化树分为两个大的分支,即欧亚系和北美系,两株病毒均与北美系代表病毒株A/ruddy turnstone/Delaware/105/1998(H6N8)处于不同的分支,并且两株病毒之间的亲缘关系也较远,分属于两个小的进化分支,核苷酸同源性仅为84.5%,而且与香港、台湾地区以及周边国家(韩国、日本)的分离株同源性均在90%以下,相差较大(图1)。
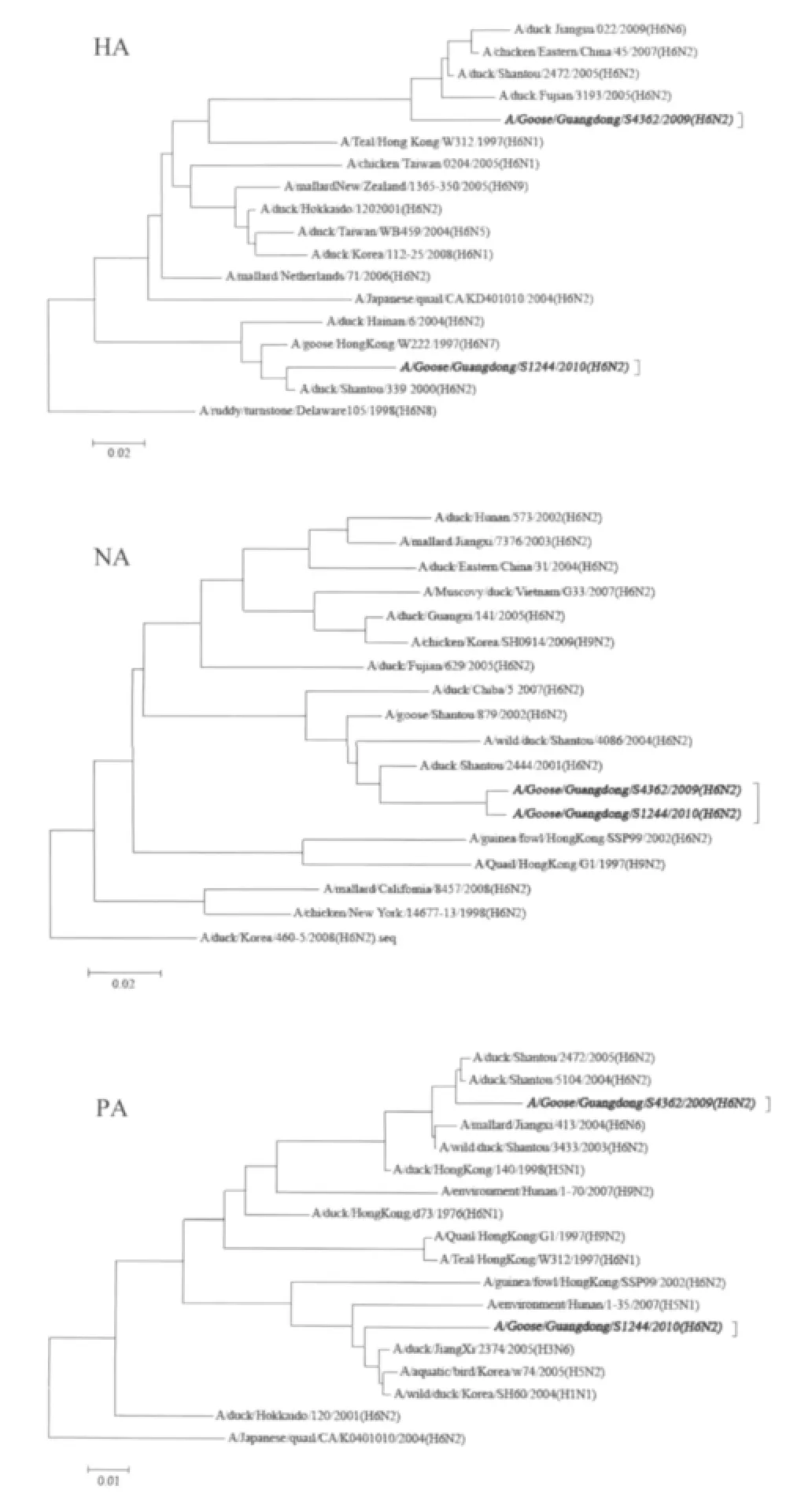

图1 GD/362/09和GD/244/10的基因进化树Fig.1 Phylogenetic tree based on GD/362/09 and GD/244/10
2.1.2 NA基因的序列及进化分析NA开放阅读框全长1 410 bp,编码469个氨基酸,均无颈部缺失。8个潜在糖基化位点分别位于61位、69位、70位、86位、146位、200位、234位和402位[8],氨基酸未发生H274K的突变,该位点的氨基酸对唾液酸苷酶抑制类药物(如磷酸奥司他韦)敏感。进化分析表明:两株病毒NA基因均属于欧亚系,核苷酸同源性为98.9%,表明具有共同的来源,除了与一株日本病毒株A/duck/Chiba/5/2007(H6N2)核苷酸同源性达到91.5%以外,与周边其余国家的病毒株亲缘关系均相差较远。
2.1.3 内部基因的序列及进化分析两株病毒间内部基因PB2、PB1、PA、NP、M、NS的核苷酸同源性分别为92.1%、92.6%、89.9%、91.6%、98.3%和93.3%。与GD/362/09株内部基因片段同源性最高的均为汕头H6N2分离株,而与GD/244/10的PA和M片段同源性最高的病毒株分别为A/aquatic bird/Korea/w74/2005(H5N2)和A/duck/Hong Kong/140/1998(H5N1),同源性分别达到96%和98.3%,其余片段同样与汕头分离株同源性最高(表1);但两株病毒的其他内部基因片段与A/duck/Hong Kong/140/1998(H5N1)也有很高的同源性(91.5%~97.7%),表明这两株病毒的内部基因来源复杂,可能由H5病毒株进化而来或与其拥有共同的来源。
2.2 病毒对SPF鸡的感染试验 SPF鸡感染两株病毒后均无明显临床症状,只有喉拭子检测到病毒。感染21 d后血清检测结果显示:接种GD/244/10病毒株的鸡血清转阳比例为5/8,接种GD/362/09血清转阳比例为1/8,而且同居对照组鸡血清均呈阴性反应。病毒滴定结果显示:接种GD/244/10病毒株的鸡群排毒期持续到第6 d,高峰期在第3 d;而接种GD/362/09病毒株的鸡群,排毒期只持续到第3 d。喉拭子滴定结果与血清检测结果一致,表明两株病毒均不能够在鸡群间发生有效传播,均只通过呼吸道排毒(表2)。脏器滴定结果表明,两株病毒在所有脏器内均不能复制。

表1 GD/362/09及GD/244/10各基因片段BLAST分析结果Table 1 The Blast analysis of genes of GD/362/09 and GD/244/10 influenza virus isolates

表2 病毒感染后的滴定结果Table 2 Virus titration after infection
2.3 病毒对BALB/c小鼠感染试验 106EID50鼻腔接种后,感染小鼠既无明显临床变化,也无明显的体重变化。脏器滴定结果显示:接种两株病毒的小鼠肺脏滴定结果均呈阳性,其中只有接种GD/244/10的小鼠鼻甲也能够分离到病毒,而在其他所有的脏器中则均未检测到病毒(图2)。
2.4 抗原分析结果 采用各自灭活疫苗免疫的特异性血清进行交叉血凝抑制试验,结果显示:GD/362/09病毒株分别与两株病毒的特异性血清的HI抑制价相差5 log2,GD/244/10病毒株分别与两株病毒特异性血清的HI抑制价相差4 log2。两株病毒之间的抗原性差异系数r值为0.59,表明两株病毒的抗原差异性较大。
3 讨论
本研究的两株H6亚型鹅源病毒GD/362/09和GD/244/10,HA裂解位点的序列具有典型的LPALV的分子特征,核苷酸同源性仅为84.5%,表明其来源各不相同;NA基因与最近10年汕头分离株同亚型的病毒株保持最高的同源性;PB2基因的627位和701位为病毒宿主范围和复制能力以及跨种传播的分子特征;PB1基因的198位和317位氨基酸与病毒在小鼠体内的致病性相关;PA片段的97位和515位氨基酸也影响病毒的毒力,M片段的31位氨基酸与病毒金刚烷胺抗药性密切相关,NS片段的92位和149位氨基酸的改变能够影响病毒拮抗干扰素生成的能力,而本实验的两株病毒各内部基因片段均未发生使病毒毒力增强的相关突变(PB2片段:E158G、E627K、D701N;PB1片段:K198I、I317K、Y436H;PA片段:T97I、T515A;M片段:V31N;NS片段:D92E、V149A)[9]。
基因进化关系显示:两株病毒的所有基因片段均属于欧亚系,并没有与北美系病毒株发生基因交换,与GD/244/10的PA和M片段同源性最高的均为H5 HPAIV,而且其他内部基因均与A/duck/Hong Kong/140/1998(H5N1)的同源性相当高,这与之前H6是H5亚型内部基因供体的研究结论一致,表明H6已与H5 HPAIV发生重组,并且其内部基因可能不停的在这两个亚型之间传递和进化[10]。水禽作为AIV的自然宿主,几乎所有的H6亚型病毒均来自鸭源,而这两株病毒均属鹅源病毒,表明病毒在禽类宿主鸭、鹅、鸡之间的跨种传播已很普遍。通过从时间、空间、宿主以及亚型几个方面的研究显示,由于频繁的活禽贸易往来以及全球范围内的候鸟迁徙等,使得不同地区、不同来源、不同生物学特性的病毒入侵的机会大大增加,H6亚型AIV已能够跨越种间屏障并与H5 HPAIV发生重组,但重组的原因以及其进化史仍需进一步的研究。多元化和复杂化已是AIV的进化趋势,使我们对疫情的控制更加困难。有研究表明:H6亚型AIV在北美和欧亚大陆的野生水禽中广泛流行,主要包括雁形目和鸻形目[11-13],在我国H6亚型也是禽流感流行病学调查过程中分离数量最多的亚型之一,占所有AIV亚型的17.8%。因此,我们必须在加强对HPAIV监测和研究的同时,增加对LPAIV生物遗传进化情况的研究。
[1]Ducatez MF,Webster R G,Webby R J.Animal influenza epidem iology[J].Vaccine,2008,26(4):67-69.
[2]Rachelle S,Robert G,Webster.The influenza virus enigma[J].Cell,2009,136(3):402-410.
[3]Webster R G,Bean W J,Gorman O T,et al.Evolution and ecology of influenza A viruses[J].M icrobiol Rev,1992,56:152-179.
[4]崔尚金.我国禽流感的流行病学调查[D].哈尔滨:中国农业科学院哈尔滨兽医研究所,2005.
[5]Olsen B,Munster V J,Wallensten A,et al.Global patterns of influenza a virus in wild birds[J].Science,2006,312(5772):384-388.
[6]Nam Jeong-hyun,Kim Eun-ha,Daesub Song,et al.Emergence of mammalian species-infectious and-pathogenic avian influenza H6N5 virus w ith No wvidence of adaptation[J].J Virol,2011,85(24):13271.
[7]丁晴微,邓国华,施建忠,等.两株鸭源H6N2亚型禽流感病毒的序列分析及对鸡的致病性研究[J].中国预防兽医学报,2011,4:270-275.
[8]Zhou Nan,Dennis A,Senne,et al.Genetic reassortment of avian,swine,and human in American pigs[J].J Virol,1999,73(10):8851-8856.
[9]Zhao Guo,Lu Xin-lun,Gu Xiao-bing,et al.Molecular evolution of the H6 subtype influenza A viruses from poultry in eastern China from 2002 to 2010[J].JVirol,2011,8:470.
[10]丁晴微,施建忠,邱伯根,等.湖南湖北两省H6亚型禽流感病毒表面基因的序列分析[J].基因组学与应用生物学,2011,6(3):282-287.
[11]Kaleta E F,Hergarten G,Yilmaz A.Avian influenza A viruses in birds-an ecological,ornithological and virological view[J].Dtsch TierarztlWochenschr,2005,112:448-456.
[12]Munster V J,et al.Spatial,temporal,and species variation in prevalence of influenza A viruses in w ild Migratory birds[J].PLoS Pathog,2007,3:e61.
[13]Woolcock P R,Suarez D L,Kuney D.Low-pathogenicity avian influenza virus(H6N2)in chickens in California,2000-02[J].Avian Dis,2003,47:872-881.

