高致病性猪繁殖与呼吸综合征病毒蛋白质组双向电泳方法的建立及优化
王隆柏,王晨燕,吴学敏,方勤美,车勇良,陈如敬,魏 宏,庄向生,周伦江*
(1.福建省农业科学院畜牧兽医研究所/福建省畜禽疫病防治工程技术研究中心,福建福州 350013;2.福建农林大学动物科学学院,福建福州 350002)
猪繁殖与呼吸综合征(Porcine reproductive and respiratory syndrome,PRRS)是 由 PRRS病 毒(PRRSV)引起的一种猪烈性传染病[1]。该病至1987年在美国发现以来,给养猪业造成严重的经济损失[2]。近年来,PRRSV致病力有所增强,尤其是2006年以来由高致病性PRRSV(HP-PRRSV)引起的高致病性PRRS[3-4],给我国养猪业造成了沉重的打击。
自1994年首次提出蛋白质组(Proteom ic)概念以来,该技术得到广泛应用[5]。在病毒蛋白质组研究方面,Chelius等用2DE LC-MS/MS分析了腺病毒蛋白质组,鉴定了11种病毒蛋白[6],Chertova等应用双向电泳技术(2-DE)分析了产生于单核巨嗜细胞(MDM)的HIV-1病毒粒子的蛋白,鉴定了253个宿主细胞相关蛋白[7]。然而,应用2-DE技术研究HP-PRRSV蛋白质组研究尚未见报道。为研究HP-PRRSV蛋白质组,本实验对影响HP-PRRSV蛋白质组的2-DE条件进行优化,建立了重复性好、分辨率高的HP-PRRSV 2-DE,为HP-PRRSV的病毒蛋白质组学及免疫蛋白质组学研究奠定基础。
1 材料和方法
1.1 病毒株和细胞 HP-PRRSV FJ06A株由本科室分离和保存;66代MARC-145细胞购自中国兽医药品监察所。
1.2 主要试剂 二硫苏糖醇(DTT)、尿素(Urea)、3-[3-(胆酰氨丙基)二甲氨基]丙磺酸内盐(CHAPS)、碘乙酰胺(Iodoacetam ide)、TEMED、IPG胶条(pH3-pH10)、IPG缓冲液、2-D clean-up Kit试剂盒均购自GEHealthcare Bio-Sciences公司;蛋白预染Marker购自Fermentas公司。
1.3 仪 器 Ettan IPGphorⅢ等电聚焦系统、Ettan IPGphor Manifold胶条槽、Ettan DALTsix大型垂直电泳系统、ImagescannerⅢ扫描仪、ImageMaster 2D Platinum 6.0分析软件及MultiTemp恒温控制仪均为GE Healthcare Bio-Sciences公司产品。
1.4 HP-PRRSV增殖及浓缩 将HP-PRRSV接种于Marc-145单层细胞,接毒量为0.5 ML(病毒毒价为5×106.5TCID50),按常规方法培养病毒,将细胞病毒液反复冻融3次后,经超声裂解15 Min,20 000 r/m in离心60m in,弃沉淀,取上清45000 r/min离心240m in,收获沉淀为浓缩病毒。
1.5 样品制备 浓缩的HP-PRRSV用0.1 mol/L Tril-HCl洗涤3次,吸干Tril-Hcl,置37℃恒温箱蒸发水分20 Min,加入适当裂解液,冰上涡旋溶解后置液氮2 Min取出解冻,反复冻融4次,将样品超声波处理15 Min,其中超声波裂解8 s,间歇8 s,处理后置冰浴中震荡1 h,于4℃10 000 r/m in离心1 h,取上清。按2-D clean-up Kit试剂盒方法纯化蛋白,用Brandford法检测蛋白浓度,分装至Eppendof管中保存于-70℃冰箱。
1.6 双向电泳的建立
1.6.1 第一向等电聚焦(IEF)采用7 cm IPG胶条pH3~10,样品用水化液[8 M尿素,2%(w/v)CHAPS,0.5%(v/v)IPG缓冲液,0.002%的1%溴酚蓝储备溶液]溶解,上样量为130μg,上样体积为125μL。置IPGphor等电仪器,在20℃环境温度下进行等电聚焦。其等电聚焦电压和时间依次为30 V 14 h、100 V 1 h、500 V 1 h、1 000 V 1 h、3 000 V 1 h、8 000 V 1 h、8 000 V 20 000 Vh、500 v 10 h。
1.6.2 平衡及第二向聚丙烯酰胺凝胶电泳(SDS-PAGE)按参考文献[8]进行。
1.6.3 染 色按参考文献[9]的方法进行,染色凝胶用Image Scanner扫描仪透射扫描,分辨率300 dpi保存图像。
1.6.4 凝胶图像分析凝胶图像进行扫描后,用软件Image Master 2-DE Platinum 6.0进行图像的处理,设置参数Smooth值为2,M inArea值为5,Saliency值为250。
1.7 双向电泳的优化
1.7.1 第一向等电聚焦样品上样量为200μg,硝酸银染色。试验设计2种一向等点聚焦程序,分别为程序Ⅰ和程序Ⅱ,程序Ⅰ的聚焦电压和时间依次为 30 V 14 h、500 V 1 h、1 000 V 1 h、3 000 V 1 h、5 000 V 1 h、5 000 V 20 000 Vh、500 v 10 h,程序Ⅱ的聚焦电压和时间依次为30 V 14 h、100 V 1 h、500 V 1 h、1 000 V 1 h、3 000 V 1 h、8 000 V 1 h、8 000 V 20 000 Vh、500 v 10 h,其他条件一致。
1.7.2 染色试剂采用一向等电聚焦上样量为160μg进行电泳,电泳结束后,比较经典考马斯亮兰和硝酸银染色效果。经典考马斯亮兰的染色步骤依次用20%三氯乙酸固定1 h,0.1%考马斯亮蓝、40%乙醇和10%乙酸染色2 h,40%乙醇和10%乙酸30m in脱色2次,1%乙酸强化过夜,去离子水清洗30m in;硝酸银染色方法见1.6.3,其他条件一致。
1.7.3 样品上样量采用相同样品,上样量分别为80μg、120μg、160μg和 200μg 4组进行电泳,采用硝酸银染色,其他条件一致。
1.7.4 显色时间样品上样量为200μg,硝酸银染色,加入显色液后分别进行了显色4 Min和6 Min,分析显色效果,其他条件一致。
1.8 HP-PRRSV培养物与MC-145细胞蛋白双向电泳 分别将HP-PRRSV培养物和MC-145细胞进行反复冻融3次后,经超声裂解15m in,20 000 r/min离心60min,弃沉淀,取上清45000 r/min离心240min,收获沉淀,沉淀物采用与HP-PRRSV样品相同的制备方法,通过建立的双向电泳方法进行电泳。
2 结果
2.1 双向电泳的建立 获得的电泳图谱蛋白聚焦效果良好,背景比较清晰,能检测到223个蛋白点(图1),但蛋白点数量较少,条件有待进一步优化。

2.2 一向等电聚焦程序优化 按程序Ⅰ聚焦获得的蛋白电泳图谱中蛋白聚焦效果不完全,不够清晰,数量明显偏少,有竖条纹较多,能检测到184个蛋白点,按程序Ⅱ聚焦获得的蛋白聚焦效果好,边界清晰分明,蛋白点较多,检测到365个蛋白点(图2)。
2.3 染色试剂优化 经典考马斯亮兰染色的电泳图谱中蛋白点少,能检测到75个蛋白点,而硝酸银染色的电泳图谱中蛋白点较多,蛋白点也比较清晰,能检测到296个蛋白点(图3)。
2.4 上样量优化 当上样量为80μg时,电泳图谱中蛋白点的数量明显偏少,蛋白点也不够清晰,能检测到88个蛋白点;上样量为120μg时,电泳图谱中蛋白点有所增多,边界比较分明,能检测到154个蛋白点;上样量为160μg时,电泳图谱中蛋白点较多和清晰、边界分明,能检测到305个蛋白点;当上样量为200μg时电泳图谱中蛋白点明显点增多,边界清晰,聚焦效果良好,能检测到386个蛋白点(图 4)。

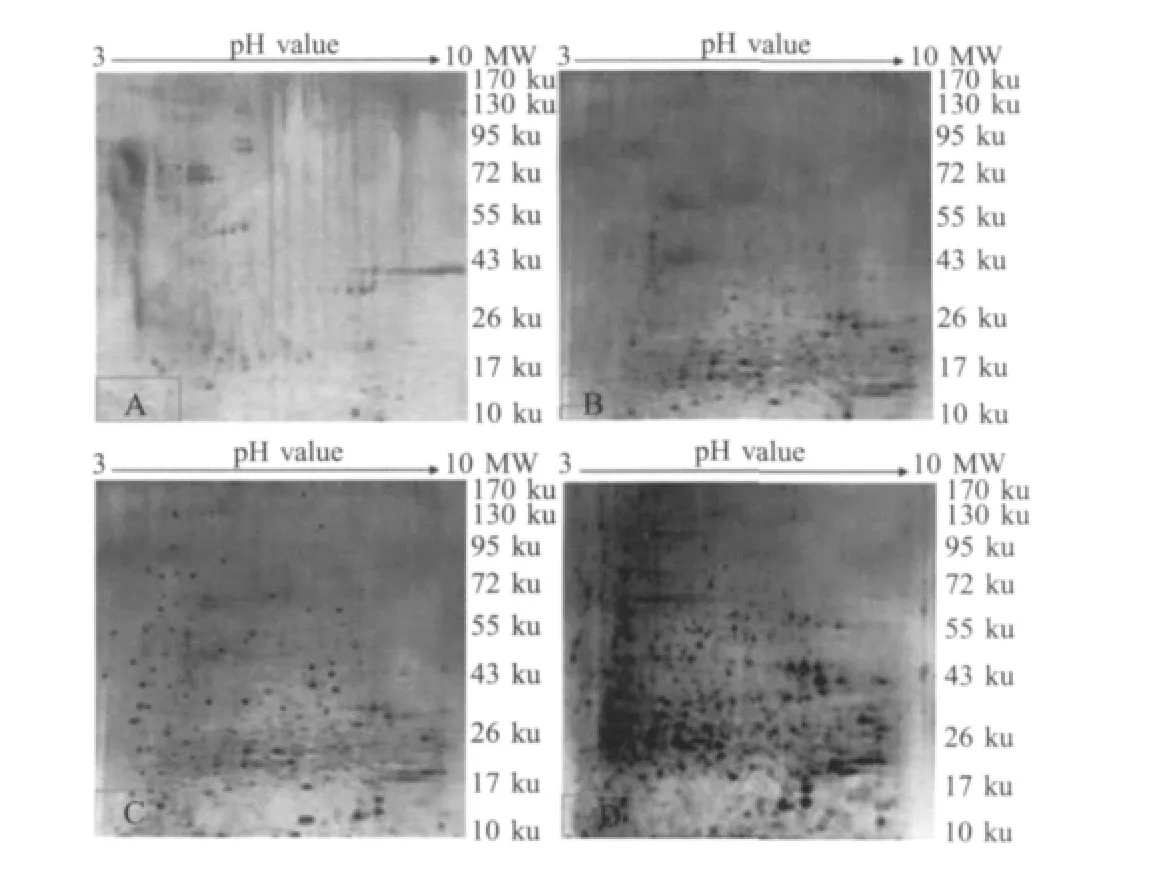
图4 不同上样量对2DE电泳图谱的影响Fig.4 Effects of different loaded protein on the 2-DEmaps of protein
2.5 显色时间优化 显色4min的蛋白电泳图谱中蛋白点较少,能检测到278个蛋白,而显色时间为6 Min的电泳图谱中蛋白点较多,蛋白点也比较清晰,能检测到375个蛋白点(图5)。

2.6 HP-PRRSV培养物与MC-145细胞蛋白双向电泳 HP-PRRSV-FJ06A培养物蛋白样品电泳图谱能检测到103个蛋白点(图6),MC-145细胞蛋白样品聚焦效果良好,能检测到89个蛋白点(图7)。
3 讨论
通过对HP-PRRSV大量培养、浓缩、样品处理、上样量、一向等电聚焦程序、染色试剂选择和显色时间等条件的优化,建立了一套适合HP-PRRSV蛋白质组分析的双向电泳技术方法,即以冻融-超声-裂解病毒法提取蛋白质样品,采用7 cm pH3-10的IPG胶条,上样品量为200μg,上样体积为125μL,等电聚集的电压为8 000 v,采用硝酸银,结合Na2CO3与甲醛显色6 min,能获得了高分辨率的电泳图谱,并将部分蛋白点进行了质谱分析,鉴定到有高致病性PRRSV-NSP2蛋白、PRRSV-GP2蛋白、PRRSV-M蛋白和PRRSV-N蛋白等特异性蛋白。同时,采用相同方法对HP-PRRSV的培养物和MC-145细胞蛋白进行双向电泳,并获得了蛋白电泳图谱,但聚焦蛋白点偏少,可能与蛋白样品的制备有关,因为采用相同的样品制备方法,HPPRRSV的培养物被高度浓缩后,其含有的离子和盐份等杂质较多,影响了等电聚焦,而MC-145细胞蛋白样品因经过高速离心去除了较多的可溶性蛋白,致聚焦蛋白点较少。经过重复试验表明,优化的双向电泳方法适用于HP-PRRSV,能获得分辨率高、重复性好的电泳图谱。
为提高HP-PRRSV的浓度和纯度,对培养的HP-PRRSV采用超速离心方法进行了浓缩。虽然大量培养病毒、浓缩病毒、裂解病毒颗粒相对复杂困难,但采用差速离心浓缩病毒,通过冻融-超声-裂解样品蛋白,破坏了病毒的囊膜和去除了核酸,结合2-D clean-up试剂盒纯化蛋白,进一步的去除了部分样品中糖类、脂质和盐份等杂质,提高了双向电泳的效果。一向等电聚焦是双向电泳中的关键步骤,聚焦效果的好坏将直接关系到蛋白分离的成败[10],采用长时间逐步升压方法有利于促进蛋白样品的溶解和除去盐离子对聚焦效果的影响,并且高压聚焦蛋白效果明显比低压更理想。样品上样量也是一个直接影响电泳比较重要的因素,若蛋白样品量太低,导致电泳图谱中有效蛋白点少,上样量过高,很可能在聚焦的过程中有部分蛋白在胶条槽中沉淀凝固下来,堵塞凝胶孔径,影响蛋白聚焦效果。染色试剂和显色时间对蛋白电泳图影响也较大,试验表明,硝酸银染色比经典考马斯亮兰染色敏感,这与邵锦震等报道的基本一致[11]。
本研究建立了HP-PRRSV蛋白质组学双向电泳方法,能够为HP-PRRSV蛋白质组学研究奠定基础,更为开展HP-PRRSV蛋白质组学和免疫蛋白质组学提供有力的技术支撑。
[1]Tian Ke-gong,Yu Xiu-ling,Zhao Tie-zhu,et al.Emergence of fatal PRRSV variants:unparalleled outbreaks of atypical PRRS in China and moleeular dissection of the unique hallmark[J].PLoSOne,2007,2(6):e526.
[2]De Lima M,Pattnaik A K,Flores E F,et al.Serologic marker candidates identified among B-cell linear epitopes of NSP2 and structural proteins of a North Ameriean strain of porcine reproductive and respiratory syndrome virus[J].Virology,2006,353(2):410-421
[3]童光志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合症病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,29(5):323-326.
[4]周伦江,王隆柏,王伟,等.变异猪繁殖与呼吸综合征病毒FJ06A的分离鉴定和致病性[J].福建农林大学学报,2011,40(6):618-623.
[5]Wilkins MR,Sanchez J C,Gooley A A,et al.Progress with proteome p rojects:why all proteins exp ressed by a genome should be identified and how to do it[J].Biotechnol Genet Eng Rev,1996,13:19-50.
[6]Chelius D,Hühmer A F,Shieh C H,et al.Analysis of the adenovirus type 5 proteome by liquid chromatography and tandem mass spectrometry methods[J].J Proteome Res,2002,1(6):501-513.
[7]Chertova E,Chertov O,Coren L V,et al.Proteomic and biochem ical analysis of purified human immunodeficiency virus type 1 produced from infectedmonocyte-derived macrophages[J].JVirol,2006,80(18):9039-9052.
[8]张爱玲,王兴龙,王英超,等.2型猪链球菌分泌组双向电泳样品制备方法的建立[J].中国预防兽医学报,2009,31(10):776-779.
[9]张娜娜,许勤,李风良,等.小菜蛾成虫蛋白质组双向电泳图谱的建立及条件优化[J].南京师大学报,2011,36(2):78-82.
[10]Nagalla S R,Canick J A,Jacob T,et al.Proteom ic analysis of maternal serum in down syndrome:identification of novel protein biomarkers[J].JProteome Res,2007,6(4):1245-1257.
[11]邵锦震,顾勇.水稻剑叶蛋白质的双向电泳分析[J].湖北师范学院学报,2006,26(1):1-5.

