微生物产3-羟基丙酸研究进展
程 嫚,罗 晖,常雁红,刘晓惠(.北京科技大学化学与生物工程学院,北京00083;.北京科技大学土木与环境工程学院,北京00083)
微生物产3-羟基丙酸研究进展
程 嫚1,2,罗 晖1,常雁红2,刘晓惠1
(1.北京科技大学化学与生物工程学院,北京100083;2.北京科技大学土木与环境工程学院,北京100083)
介绍了3-羟基丙酸的性质、用途以及研究历程,讨论了采用诱变法和基因工程法对产3-羟基丙酸菌种进行改造的机理以及产物分离纯化等方面的研究进展。
3-羟基丙酸;基因工程法;诱变法;分离纯化
3-羟基丙酸(3-Hydroxypropionic acid,3-HP),分子式C3H6O3,化学索引号503-66-2,为三碳无手性β-羟基羧酸,无色、无味,易溶于水、醇等有机溶剂[1]。3-HP和乳酸是同分异构体,由于羟基位置的不同,3-HP的化学性质更为活泼。3-HP是一种重要的功能性有机酸,利用已有的成熟催化技术,通过氧化、脱水、酯化反应等可以将其转化为多种重要的化学物质,如丙烯酸、丙二酸、聚3-HP等,3-HP还可以作为食品或饲料的添加剂和防腐剂。由于3-HP应用广泛,近年来已成为研究热点,美国能源部也将其列为12种最具开发潜力的化工产品之一[2]。
目前,3-HP的生产方法有化学法和微生物法,化学法使用不可再生资源、副产物多、分离困难、污染严重,而微生物法可以有效弥补这些缺点,因此,以微生物法生产3-HP成为大势所趋。作者在此综述了微生物产3-HP的研究进展。
1 微生物法产3-HP的研究历程
早在20世纪70年代,人们就发现了能够产3-HP的野生菌株,但普遍产率低、生产周期长,应用前景非常有限。随着基因重组技术的日益成熟,近年来人们开始研究构建基因工程菌来生产3-HP,微生物产3-HP的能力得到明显提高,部分研究状况见表1。
2 产3-HP菌种的选育与构建
微生物法生产3-HP的关键在于选育高产的菌种,现有的菌种改造方法主要有诱变法和基因工程法。其中诱变法主要是针对假丝酵母野生菌株,基因工程法主要是构建以葡萄糖或甘油为底物的重组菌株。
2.1 诱变法提高微生物产3-HP的能力
在一些自养微生物体内[6],3-HP作为一种中间代谢产物存在于某些代谢途径中,但一般不是微生物生长所必需的物质,所以在菌体中不能大量积累,其过度积累会破坏微生物细胞内的代谢平衡。为了提高菌株的3-HP积累量,需要对菌种进行改造,诱变法就是对产3-HP野生菌株进行改造的一种常规方法。
早在1982年,Hasegawa等[5]分离出一株能够产3-HP的皱褶假丝酵母,以亚硝基胍为诱变剂,采用以葡萄糖和丙酸分别为唯一碳源的筛选培养基,筛选不能同化丙酸的突变株,最终得到能够高产β-羟基异丁酸和3-HP的突变体,以葡萄糖和丙酸作为碳源进行发酵,3-HP产量达到40.0 g·L-1。
近年来,国内研究者开始关注能够产3-HP的野生菌株,主要以假丝酵母为主。朱建航等[13]分阶段控制皱褶假丝酵母突变株发酵过程的p H值及糖含量等参数,3-HP的最终产量达到20.0 g·L-1。范炜炜等[9]对皱褶假丝酵母进行诱变育种,3-HP产量达到8.88 g·L-1。诸葛斌等[19]对假丝酵母进行复合诱变,在优化的培养条件下,3-HP产量达到30.0 g· L-1。
Hasegawa等[5]提出了皱褶假丝酵母体内可能存在的产3-HP的途径,见图1。

表1 微生物产3-HP的部分研究状况Tab.1 Some research of 3-HP production by microorganisms
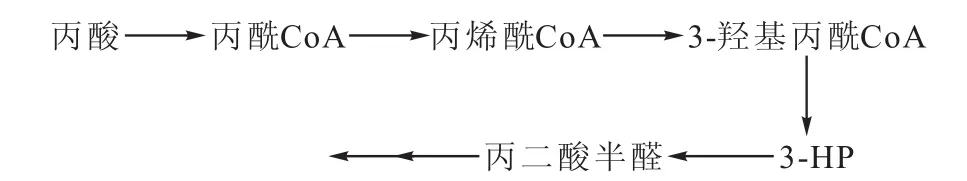
图1 皱褶假丝酵母体内产3-HP途径Fig.1 The pathway of producing 3-HP in Candida rugosa
2011年,Zhou等[21]根据酰基Co A脱氢酶保守序列将皱褶假丝酵母中的丙酰Co A脱氢酶克隆出来,并在Pichia pastoris GS115中表达出重组蛋白,分析了蛋白的生化性质,部分证实了在皱褶假丝酵母中存在如图1所示的3-HP合成途径。
在此途径中,为了提高3-HP的积累量,需要关注菌株的3-HP降解酶。一般认为,降解3-HP的酶为3-羟基丙酸脱氢酶。Hasegawa等[5]所筛选出来的高产3-HP的突变株,其3-羟基丙酸脱氢酶的酶活几乎为0。Yao等[22]从蜡状芽孢杆菌中获得β-羟基异丁酸脱氢酶基因,并在大肠杆菌中表达,发现该酶能够使3-HP脱氢,但是,对于皱褶假丝酵母中存在的β-羟基异丁酸脱氢酶是否也能使3-HP脱氢还需要进一步研究证实。
2.2 构建基因工程菌产3-HP
2.2.1 以葡萄糖为底物
葡萄糖是构成生物质的重要单元,开发以葡萄糖为底物的产3-HP菌株是以生物质为原料基础的现代生物炼制技术的重要发展方向。美国卡吉尔公司在研究由葡萄糖生产3-HP方面做了大量工作,在2002年申请的专利中提出了以葡萄糖为底物产3-HP的途径,并从不同微生物体内获得途径所需的酶基因,构建了基因工程菌,3-HP产量最高达到20.0 g·L-1[8]。
到目前为止,根据微生物体内的代谢途径,学者共提出了7条由葡萄糖到3-HP的途径[23](如图2所示),并分析了每条途径的能量代谢、辅酶再生等情况。由于产物的合成和输出细胞需要ATP,并且需要达到一定的平衡,而图2所示的各条途径生成和消耗的ATP的量不同,因此3-HP的生成量差别很大。其中乳酸途径的理论转化率很高。该途径涉及3个酶:丙酰Co A转移酶(PCT)、乳酰Co A脱水酶(LCD)和3-羟基丙酰Co A脱水酶(OS19)。在此途径中,由于LCD严格厌氧[24],所以构建的基因工程菌需要厌氧发酵。乳酸作为代谢中间产物和3-HP同时存在于发酵液中,由于它们性质相似而较难分离,因此,3-HP的 分离纯化是此途径需要解决的一个难题。

图2 以葡萄糖为底物产3-HP的代谢途径Fig.2 The metabolic pathways of producing 3-HP with glucose as substrate
2.2.2 以甘油为底物
21世纪初,由于生物柴油的大量生产,甘油作为一种廉价的副产物需要加以利用,因此近年来利用甘油生产3-HP的研究得到相当的重视。人们一般通过构建基因工程菌来代谢甘油产生3-HP,其主要机理是:甘油在微生物体内发生氧化还原反应,氧化反应为还原反应提供ATP和NAD+[25~27],如图3所示。

图3 由甘油产3-HP机理Fig.3 The mechanism of producing 3-HP from glycerol
由图3可知,甘油产3-HP需要两种酶:甘油脱水酶和醛脱氢酶。甘油脱水酶需要以VB12为辅酶催化甘油生成3-羟基丙醛,醛脱氢酶催化3-羟基丙醛(3-HPA)生成3-HP和NADH。甘油脱水酶在催化过程中很不稳定,是该途径的限速酶,甘油会抑制该酶的活性,从而降低3-HP的产量,解除该抑制作用,就可以有效提高3-HP产量。权国燕等[18]构建了重组大肠杆菌,以甘油脱水酶再激活因子对甘油脱水酶进行激活,3-HP产量提高了6.4倍。王凤寰等[28]构建了重组肺炎克雷伯杆菌转化甘油进行3-HP和1,3-丙二醇的共发酵,不但实现了NADH的循环再生,还有效地减少了有毒中间产物3-HPA的积累,3-HP最终产量为5 g·L-1,同时产生74.5 g·L-1的1,3-丙二醇。Rathnasingh等[14]构建了以甘油为底物的重组菌,其3-HP的产量非常可观,达到38.7 g·L-1,但是由于酶活丢失及氧化还原反应不平衡,转化率未能达到期望值。因此,还需要进一步研究NAD+再生系统以及提高酶活的方法。
由于构建基因工程菌涉及到多种基因,并且这些基因在宿主细胞中的稳定性、酶的活性表达以及细胞代谢流量调控等在实际生产中面临着巨大挑战,因此目前该技术尚未实现工业化生产,仍有许多技术问题有待解决。
3 3-HP的分离与纯化
由于发酵液成分复杂,因此3-HP的分离纯化是微生物法生产3-HP的一个难题,但迄今为止,其研究重点仍集中在菌株的构建与改造,很少有针对发酵液中3-HP分离的文献报道。Meng等[29]研究了3-HP和丙烯酸等有机酸的混合物的分离并申请了专利,以乙酸乙酯或其它有机物为萃取剂,以逆流萃取的方式分离纯化丙烯酸及3-HP,将萃取后的有机相蒸馏或者用水反萃取,实现了萃取剂的循环利用。Jump[30]采用电渗析方法对3-HP进行分离回收,在分离过程中将溶液中的3-羟基丙酸钠盐进行浓缩并转化为3-HP,该技术还可以有效地分离溶液中的3-HP和葡萄糖,显示了良好的应用前景。
4 结语
微生物法生产3-HP以其污染小、副产物少等特点优于化学法,而且构建的重组菌利用的是可再生资源,是未来的发展方向。但迄今为止,微生物发酵产3-HP的产量最高只有30~40 g·L-1,为了进一步提高产量,实现该方法的技术和经济可行性,必须解决微生物法存在的一些问题,如高产物浓度耐受菌株的选育[31]、基因工程菌代谢流的调控、菌株底物转化率的提高以及产物的高效低成本分离技术等,这也是科研人员下一步将要重点解决的问题。
[1] 张鸿达,刘成,高卫华,等.微生物发酵法生产3-羟基丙酸的研究进展[J].化工进展,2007,26(1):33-36.
[2] Werpy T,Petersen G.Top value added chemicals from biomass [C].Washington D.C.:Energy Efficiency and Renewable Energy,2004.
[3] Harada T,Hirabayashi T.Utilization of alcohols by Hansenula miso[J].Agricultural and Biological Chemistry,1968,32(9): 1175-1180.
[4] Miyoshi T,Harada T.Utilization of 2-butyne-1,4-diol by a strain of Fusarium merismoides[J].Journal of Fermentation Technology,1974,52(6):196-199.
[5] Hasegawa J,Ogura M,Kanema H,et al.Production ofβ-hydroxypropionic acid from propionic acid by a Candida rugosa mutant unable to assimilate propionic acid[J].Journal of Fermentation Technology, 1982,60(6):591-594.
[6] Holo H,Sirevag R.Autotrophic growth and CO2 fixation of Chloroflexus aurantiacus[J].Archives of Microbiology,1986,145(2): 173-180.
[7] Suthers P F,Cameron D C.Production of 3-hydroxypropionic acid in recombinant organisms[P].USP 6 852 517 B1,2001-01-19.
[8] Gokarn R R.3-Hydroxypropionic acid and other organic compounds [P].WO 02/42 418 A2,2002-05-30.
[9] 范炜炜,袁其朋.亚硝基胍、紫外诱变筛选高产3-羟基丙酸菌株[J].现代化工,2008,28(Z2):241-246.
[10] Raj S M,Rathnasingh C,Jo J E,et al.Production of 3-hydroxypropionic acid from glycerol by a novel recombinant Escherichia coli BL21 strain[J].Process Biochemistry,2008,43(12):1440-1446.
[11] 黄瑞.利用甘油发酵生产3-羟基丙酸基因工程菌的构建[D].无锡:江南大学,2008.
[12] Lee S H,Park S J,Park O J,et al.Production of 3-hydroxypropionic acid from acrylic acid by newly isolated Rhodococcus erythropolis LG12[J].Journal of Microbiology and Biotechnology, 2009,19(5):474-481.
[13] 朱建航,辜旭辉,刘寅.一种发酵生产3-羟基丙酸的方法[P].CN 101 457 239,2009-06-17.
[14] Rathnasingh C,Raj S M,Jo J E,et al.Development and evaluation of efficient recombinant Escherichia coli strains for the production of 3-hydroxypropionic acid from glycerol[J].Biotechnology and Bioengineering,2009,104(4):729-739.
[15] Zhu J G,Ji X J,Huang H,et al.Production of 3-hydroxypropionic acid by recombinant Klebsiella pneumoniae based on aeration and ORP controlled strategy[J].Korean Journal Chemical Engineering,2009,26(6):1679-1685.
[16] 李冰,裴疆森.3-羟基丙酸产生菌株的筛选及鉴定[J].食品与发酵工业,2010,36(4):28-31.
[17] Luo L H,Seo J W,Baek J O,et al.Identification and characterization of the propanediol utilization protein PduP of Lactobacillus reuteri for 3-hydroxypropionic acid production from glycerol [J].Appl Microbiol Biotechnol,2011,89(3):697-703.
[18] 权国燕,方慧英,诸葛斌,等.甘油脱水酶再激活因子提高重组大肠杆菌3-羟基丙酸合成能力[J].中国生物工程杂志,2011,31 (6):75-80.
[19] 诸葛斌,范俊英,方慧英,等.一种3-羟基丙酸高产菌株及其应用[P].CN 102 382 778A,2012-03-21.
[20] 胡南,缪鑫昕,谈曙明,等.重组大肠杆菌生物转化甘油生产3-羟基丙酸[J].生物技术,2012,22(1):72-75.
[21] Zhou F L,Zhang Y G,Zhang R B,et al.Expression and characterization of a novel propionyl-Co A dehydrogenase gene from Candida rugosa in Pichia pastoris[J].Appl Biochem Biotechnol,2011,165(7-8):1770-1778.
[22] Yao T R,Xu L,Ying H J,et al.The catalytic property of 3-hydroxyisobutyrate dehydrogenase from Bacillus cereus on 3-hydroxypropionate[J].Applied Biochemistry and Biotechnology, 2010,160(3):694-703.
[23] Jiang X L,Meng X,Xian M.Biosythetic pathways for 3-hydroxypropionic a cid production[J].Microbiol Biotechnol,2009,82(6):995-1003.
[24] Kuchta R D,Hanson G R,Holmquist B,et al.Fe-S Centers in lactyl-Co A dehydratase[J].Biochemistry,1986,25(23):7301-7307.
[25] Cecil W F.Production of 1,3-propanediol from glycerol by Clostridium[J].Applied Environmental Microbiology,1987,53(4): 639-643.
[26] Himmi E H,Bories A,Boussaid A,et al.Propionic acid fermentation of glycerol and glucose by Propionibacterium[J].Applied Microbiology Biotechnology,2000,53(4):435-440.
[27] Biebl H.Fermentation of glycerol to 1,3-propanediol and 2,3-butanediol[J].Applied Microbiol Biotechnology,1998,50(1):24-29.
[28] 王凤寰,杨建国,王晓楠,等.利用甘油发酵耦联生产3-羟基丙酸及1,3-丙二醇重组菌的构建及筛选[J].微生物学通报,2011,38 (11):1611-1617.
[29] Meng X S,Tsobanakis P,Malsam J,et al.Process for separating and recovering 3-hydroxypropionic acid and acrylic acid[P].USP 7 279 598,2006-09-13.
[30] Jump J.Process for separating and recovering 3-hydroxypropionic acid[P].WO 2011 002 892 A1,2011-01-06.
[31] Warnecke T E,Lynch M D,Lipscomb M L,et al.Identification of a 21 amino acid peptide conferring 3-hydroxypropionic acid stress-tolerance to Escherichia coli[J].Biotechnology and Bioengineering,2012,109(5):1347-1352.
Research Progress of Producing 3-Hydroxypropionic Acid by Microorganisms
CHENG Man1,2,LUO Hui1,CHANG Yan-hong2,LIU Xiao-hui1
(1.School of Chemistry and Biological Engineering,University of Science and Technology Beijing, Beijing 100083,China;2.School of Civil and Environmental Engineering,University of Science and Technology Beijing,Beijing 100083,China)
As a kind of important chemical intermediate,3-hydroxypropionic acid has gained more and more attention by researchers.In this paper,the properties,applications and developing process of 3-hydroxypropionic acid were introduced.The research progress of the mechanisms of the strains producing 3-hydroxypropionic acid by means of genetic engineering method and traditional mutagenesis method,and the product separation and purification were mainly reviewed.
3-hydroxypropionic acid;genetic engineering method;mutagenesis method;separation and purification
TQ 921.7 Q 819
A
1672-5425(2012)11-0009-004
10.3969/j.issn.1672-5425.2012.11.003
2012-07-15
程嫚(1986-),女,河南兰考人,硕士研究生,研究方向:生物化工,E-mail:chengman-123@163.com;通讯作者:罗晖,副教授,E-mail:luohui@ustb.edu.cn。

