LAMS对QGY7701细胞Rho C蛋白表达的影响
汤荣睿,龚雅利
(重庆市沙坪坝区人民医院检验科 400030)
Rho蛋白家族通过其调节子、效应子,影响肿瘤的发生、生长、浸润及转移[1],其各成员在肿瘤的发展进程中起着不同的作用。据此人们推测Rho蛋白及效应子可为抗瘤靶点,抑制其作用可为发现新的治疗靶点提供理论依据。作者介绍昆布多糖硫酸酯(laminarin sulphate,LAMS)对Rho C蛋白表达的影响及其效应,为进一步临床应用提供参考。
1 材料与方法
1.1 材料 鼠抗人Rho蛋白抗体(美国Santa cruz公司),电泳试剂盒(武汉博士得公司),发光试剂盒(美国GE公司),蛋白提取液(武汉博士得公司),Transwell侵袭小室(美国Costar公司),ECM胶(美国sigma公司),图像分析系统(美国BID-RAD公司 Chemi DOCXRS),QGY-7701细胞(中科院上海细胞所)。
1.2 方法
1.2.1 LAMS 由重庆市普外科重点实验室提供,多糖酯含量30%。用生理盐水稀释成120μg/mL,0.22μL孔径滤器过滤。
1.2.2 细胞培养 用含10%胎牛血清的1640培养液在37℃、5%CO2培养箱培养QGY-7701细胞,成对数生长后,实验组加入终浓度分别为12μg/mL及6μg/mL的LAMS,对照组加入20μL生理盐水,培养12h,换不含LAMS的培养液继续培养24h,取细胞用于下述实验(各组一式3份)。
1.2.3 Transwell小室侵袭实验 ECM胶包被小室底膜,紫外线消毒。小室置24孔培养板。取上述细胞,用含10%胎牛血清1640培养液配成1×105。小室内加600μL上述细胞液,小室外加600μL胚胎成纤维细胞培养上清液。37℃、5%CO2培养24h。用棉签擦去孔内细胞,无水乙醇固定,台盼蓝染色。显微镜下计数10个视野的细胞数。
1.2.4 测定Rho C蛋白表达 用细胞刮刮取上述的QGY-7701细胞,置微量离心管内,震荡混匀后置4℃、30min,取匀浆置离心管中12000r/min离心20min。取上清液测定蛋白含量,用蛋白提取液将蛋白浓度均调至3mg/mL。将该组织液经100g/L十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(SOSPAGE),电转于PVDS膜,50g/L脱脂奶粉的TBST溶液封闭,经一抗及二抗孵育后,化学发光法显色,图像分析系统拍摄并用Quantity One软件将特异条带灰度数字化。
1.3 统计学处理 实验数据采用SPSS13.0统计软件进行统计学处理,实验结果采用表示,采用t检验进行组间比较,P<0.05为差异有统计学意义。
2 结 果
2.1 穿过多孔膜膜细胞数目 对照组、LAMS终浓度6μg/mL、12μg/mL穿过多孔膜的细胞数分别为:220±16、82±6、31±5。LAMS终浓度为12μg/mL组较其他两组有显著降低(P<0.01)。LAMS终浓度为6μg/mL组亦较对照组有显著降低(P<0.01)。
2.2 Rho C蛋白表达 MTA1蛋白表达见图1,Rho C蛋白表达系数见表1(Rho C蛋白表达系数=Rho蛋白积分光密度/βactin蛋白积分光密度)。由图1及表1可见经LAMS处理后QGY7701细胞的Rho C蛋白表达显著降低(P<0.01)。
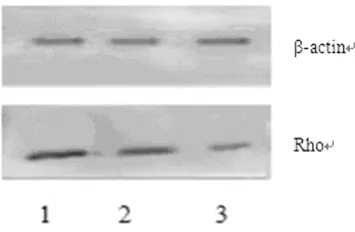
图1 Rho C蛋白表达
表1 Rho C蛋白表达系数()

表1 Rho C蛋白表达系数()
#:P<0.01,与LAMS 12μg比较;*:P<0.01,与 LAMS 12μg/mL组比较。
组别 Rho 蛋白表达对照组 1.72±0.22#*实验组LAMS 6μg/mL 111.00±0.17#LAMS 12μg/mL 0.43±0.26
3 讨 论
Rho家族蛋白是一类小分子G蛋白,现已发现十余种成员[2],该家族具有GTP酶活性,是细胞信号传导通路中的信号转换器[3]。研究发现肿瘤的浸润、转移所涉及的许多分子事件均有Rho蛋白家族成员参与。它们通过调节细胞运动[4]、与细胞黏附[5]、促进细胞间质降解[6]、促进肿瘤血管生成[7]等功能,参与肿瘤细胞的浸润和转移。深入研究Rho蛋白家族成员,具有潜在而重要的临床价值。Rho C蛋白属于Rho CTP酶家族成员,它通过参加细胞骨架的重组,基因转录调控以及细胞信号转导等生理过程,促进细胞癌变[8]。有文献指出Rho C在人类黑色素瘤细胞系中是迁移和转移的关键因子[9]。Wang等[10]应用 RT-PCR及 Western-blot法测定不同分化程度肝癌组织中Rho C的表达,发现Rho C在肝癌组织中的表达高于癌旁组织,在低分化肝癌组织中的表达高于高分化肝癌组织。Rho C的表达水平不但与癌组织的恶性程度有关,且与癌组织的侵袭转移密切相关,可作为肝癌诊断的标志物和治疗的靶点[10]。
本实验结果显示,LAMS可降低QGY7701细胞的Rho C蛋白表达及侵袭力,其效果与浓度呈正相关,有可能成为抗击肿瘤转移的药物。
[1]Lozano E,Betson M,Braga V.Tumor progression:Samll GTPases and loss of cell-cell adhesion[J].Bioessays,2003,25(5):452-467.
[2]Sah VP,Seasholtz TM,Sagil SA,et al.The rolo of Rho in G protein-couple receptor signal transduction[J].Annu Rew Pharmacol toxicol,2000,40(2):459-472.
[3]Lozano E,Betson M,Braga V.Tumor progression:Small GTPases and loss of cell-cell adhesion[J].Bioessays,2003,25(5):452-468.
[4]Mueller BK,Mack H,Teusch N.Rho kinase a promising drug target for neurological disorders[J].Nat Rev Drug Discov,2005,4(5):387-398.
[5]Shewan AN,Maddugoda M,Kraemer A,et al.Myosin 2is a key rho kinase target necessary for the local concentration of E-cadherin at cell-cell contacts[J].Mol Biol Cell,2005,16(10):4531-4542.
[6]Turner NA,O′Regan DJ,Ball SC,et al.Simvastatin inhibits MMP-9,secretion from human saphenous vein smooth muscle cells by inhibiting the RhoA/ROCK pathway and reducing MMP-9mRNA levels[J].FASEB J,2005,19(7):804-806.
[7]Van Colen KL,Bao LW,Pan Q,et al.Mitogen activated protein kinas pathway is involved in RhoC GTPase induced motility,invasion and angiogenesis in inflammatory breast cancer[J].Clin Exp Melastasis,2002,19(4):301-311.
[8]Burridge K,Wennerg K.Rho and Rac take center stage[J].Cell,2004,116(2):167-179.
[9]Clark EA,Golub TR,Lander ES,et al.Genomic analysis of metastasis an essential role for Rho[J].Nature,2000,406(3):532-556.
[10]Wang W,Yang LY,Huang GW,et al.Genomic analysis reveals RhoC as a protential marker in hepatocellular carcinoma with poor prognosis[J].Br J Cancer,2004,90(12):2349-2462.

