补髓生血颗粒对慢性再障患者骨髓单个核细胞内Ca2+水平及不同血液疾病间差别的影响
罗正凯,王金环,孙凤,雍延礼,孙伟正
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
再生障碍性贫血(AA)作为一种造血负调控亢进“模型”,是一种危害性极大的血液系统疑难病症。CAA病理机制主要有造血干细胞量和质异常、免疫异常、造血微环境损伤等三个学说。本课题组经过近40年的连续研究,了解和认识慢性再障肾虚病机以及补肾药物疗效机理和环节[1-2]。受体配体结合时引起的细胞内信号转导通路的变化可能为其重要机理之一。钙离子(Ca2+)通路作为重要的信号转导通路基本上可参与到CAA各个环节当中。本实验搜集CAA患者骨髓样本,采用流式细胞术(FCM)拟通过对患者骨髓单个核细胞内Ca2+浓度测定,以期进一步探讨补髓生血颗粒对慢性再障的治疗机制。同时观察不同血液疾病患者骨髓单个核细胞内Ca2+浓度水平,为血液疾病的诊断和治疗提供新的思路。
1 研究对象
本次观察研究对象共纳入CAA患者55例,均来源于黑龙江中医药大学附属第一医院血液内科2010年1月~2011年3月期间住院或门诊治疗的CAA患者,随机分为治疗组和对照组,治疗组55例,其中肾阳虚型30例,肾阴虚型25例;对照组53例。治疗组予以补髓生血颗粒治疗,对照组则予以再造生血片治疗。另选取30例健康体检志愿者作为正常对照组。
2 研究方法
依照文献[3]所述方法,使用淋巴细胞分离液分离骨髓单个核细胞。依照Fluo-3-AM(进口自美国intrigen公司)试剂盒所述方法对BMMC内Ca2+染色,将已分离完毕的BMMC分为A、B两管,在A管中加入D-PBS,B管中加入 Fluo-3AM荧光素,避光孵育1h。使用美国Becton Dickinson公司生产Facscalibour流式细胞仪检测,利用CELLQuelt功能软件进行参数的获取和数据分析,激发光为488nm,波长为526nm,以阴性细胞为对照,用横坐前向散射光和纵坐侧向散射光确定细胞群,开窗定标,计算窗内细胞1万个在FL1-H的直方图上,调整并确定电压及最大倍数,在此基础上计算被染上的Fluo-3的荧光强度。计量资料用(s)表示,组间均数比较采用方差分析,运用SPSS 11.0统计软件计算。
3 研究结果
3.1 补髓生血颗粒对CAA患者骨髓单个核细胞内Ca2+浓度的影响
CAA患者疗前各组骨髓单个核细胞内Ca2+浓度均高于正常对照组(P<0.05);经过治疗,患者骨髓单个核细胞内Ca2+浓度较疗前均有所下降(P<0.05),且治疗组下降程度优于对照组(P<0.05),但疗后两者的细胞内Ca2+浓度均未达正常组水平(P<0.05)。治疗前治疗组中肾阳虚型CAA患者BMMC内Ca2+浓度与肾阴虚型经较,无显著性差异(P>0.05);经治疗后,肾阳虚组细胞内Ca2+浓度低于肾阴虚组,但无统计学差异(P>0.05)。各组细胞内Ca2+浓度比较见表1。

表1 CAA患者骨髓单个核细胞内Ca2+浓度
3.2 不同血液疾病骨髓单个核细胞内Ca2+浓度差异比较 见表2。
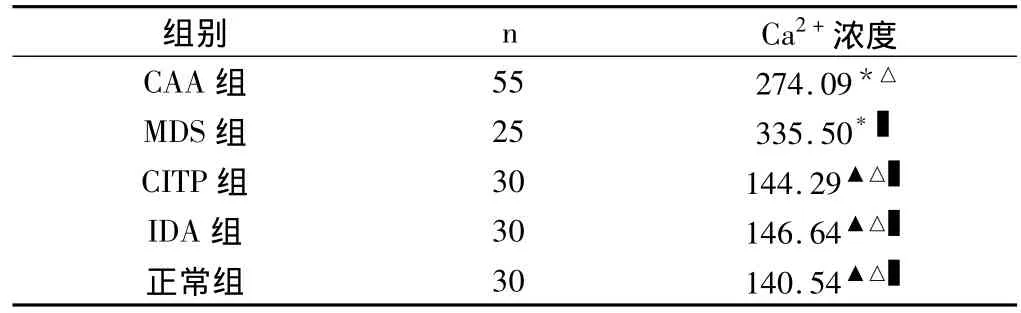
表2 不同血液疾病骨髓单个核细胞内Ca2+浓度比较
慢性再障组(CAA)、骨髓增生异常综合征组(MDS)骨髓单个和细胞内Ca2+浓度高于正常组(P<0.05);慢性血小板减少性紫癜组(CITP)、缺铁性贫血组(IDA)与正常组比较,无显著性差异。CAA患者明显低于MDS组(P<0.05)。CAA组与CITP组比较,无显著性差异。MDS组均明显高于IDA组与CITP组(P <0.05)。
4 结论
Ca2+在细胞的生命活动中具有重要作用,所有类型细胞的各种功能均不同程度地受Ca2+调控。细胞内钙不仅作为一种重要的第2信使广泛参与细胞的运动、分泌、代谢和分化等多种细胞功能活动的调节,而且胞内钙离子浓度的变化与调控对于参与维持存在于细胞质膜或细胞器膜两侧的跨膜梯度差,以及介导细胞对外界刺激的应答反应具有重要的调节作用[4]。对于静息和受刺激时胞内钙离子浓度的准确了解,是确定钙离子在刺激反应级联中作用的重要因素[5]。在大多数细胞,胞内钙离子浓度的瞬间增加有两种可能的来源:一是胞外Ca2+通过Ca2+通道的开启进入胞内;二是胞内钙库(如内质网等)向胞质释放出Ca2+。细胞内储存钙的释放是通过IP3和RyRs等受体操纵性钙通道完成的[6]。
钙离子作为细胞内的信息传递物质,具有调节细胞功能、参与信号跨膜传递以及介导细胞对外界刺激的应答反应等重要作用[7]。有学者研究表明,CAA患者其造血干细胞存在凋亡现象,是通过IFN-r、TNF-α作用靶细胞后触动靶细胞CD95表面蛋白受体,进而引起靶细胞内的连锁生化反应,包括Ca2+升高,从而使DNA降解而凋亡[8]。
近年来,信号转导通路逐渐成为研究的热点,有学者认为,PLA-IP3通路对于细胞内Ca2+的释放与调节起着重要作用,是形成细胞内生理变化的重要因素。本研究结果表明,再生障碍性贫血患者骨髓单个核细胞内Ca2+浓度明显高于正常组,经过药物干预,各组细胞内Ca2+水平下降。提示细胞内Ca2+的升高可能是骨髓造血功能异常的标志性指标之一,这为下一步通过干预PLA-IP3通路实现Ca2+水平改变而达到治疗再生障碍性贫血的目的提供了启发。
本课题组还使用流式细胞仪技术对不同种类血液疾病患者骨髓单个核细胞内Ca2+浓度进行了检测。表明缺铁性贫血(IDA)、特发性血小板减少性紫癜(ITP)与正常组无显著性差异,而骨髓增生异常综合征(MDS)患者则明显高于正常组。提示MDS等骨髓增殖类疾病与细胞内Ca2+的关系更为密切,而缺铁性贫血、特发性血小板减少性紫癜患者则与健康组无明显差异,此类疾病预后较好。不同种类血液疾病细胞内Ca2+浓度的观察,为今后各类疾病间的鉴别诊断提供了新的思路。
[1]王小东,孙劲晖,梁正贤,等.补髓生血颗粒对慢性再生障碍性贫血患者骨髓AKT磷酸化水平的影响[J].中医药学报,2011,39(2):41-43.
[2]施海涛,王金环,孙岸,等.补肾生血法对慢性再生障碍性贫血患者信号转导MAPK通路的影响[J].中医药学报,2011,39(4):49-52.
[3]刘娜.补肾生血法对慢性再生障碍性贫血骨髓造血粘附FAK/P13K通路及 RhoGTP酶的影响[D].哈尔滨:黑龙江中医药大学,2010.
[4]Loughrey CM,MacEachern KE,Cooper J,et al.Measurement of the dissociation constant of Fluo-3 for Ca2+in isolated rabbit cardiomyocytes using Ca2+wave characteristics[J].Cell Calcium,2003,34(1):1-9.
[5]Liu Y,Zhong Y,Pei J,et al.Inhibitory effect of leptin on growth hormone secretion of GH3 cells:involvement of cell proliferation,apoptosis and intracellular free Ca2+[J].Cytokine,2009,46(2):245 -250.
[6]Yanagida E,Shoji S,Hirayama Y,et al.Functional expression of Ca2+signaling pathways in mouse embryonic stem cells[J].Cell Calcium 2004,36(2):135 -146.
[7]Paredes RM,Etzler JC,Watts LT,et al.Chemical calcium indicators[J].Methods,2008,46(3):143 -151.
[8]王祥麒.CAA患者造血干细胞内Ca2+含量、CD95+表达水平及相关因素的研究[J].河南大学学报(医学版),2004,4(23):9-10.

