江南卷柏中的黄酮碳苷类成分研究Δ
朱田密,陈科力,黎莉(1.湖北中医药大学省部共建中药资源与中药复方教育部重点实验室,武汉430065;2.湖北省中医院药事部,武汉 430061;3.武汉工程大学化工与制药学院,武汉 430073)
江南卷柏(Selaginella moellendorffiiHieron.)是卷柏科卷柏属药用植物,多年生草本,具有清热利湿、止血之功效[1]。已知其化学成分有异茴芹素、银杏素等[2,3]。卷柏属含有丰富的双黄酮类化合物,而黄酮碳苷很少报道,史社坡[4]2003年首先从卷柏中得到了芹菜素-6,8-二-C-β-葡萄糖苷;笔者于2008年在硕士学位论文中报道在江南卷柏中发现了4种黄酮碳苷[5];申健2010年的硕士学位论文中亦报道从布朗卷柏中分离得到了芹菜素6,8-二-C-β-D-葡萄糖苷以及芹菜素6-C-β-D-葡萄糖-8-C-α-L-阿拉伯糖苷[6]。本文详细报道3种黄酮碳苷的提取分离方法和结构鉴定过程。
1 仪器与试药
INOVA600核磁共振仪(美国Varian公司);7.0T傅里叶变换离子回旋共振质谱仪(美国IonSpec公司);U-2001紫外分光光度计(日本Hitachi公司);5700FFIR红外分光光度计(美国Nicolet公司);P680高效液相色谱仪(美国Dionex公司)。
江南卷柏全草于2005年7月采自湖北恩施,由湖北中医药大学陈科力教授鉴定为江南卷柏Selaginella moellendorffiiHieron.,标本留存于湖北中医药大学中药标本中心。聚酰胺粉(60~100目,武汉药科新技术开发有限公司);Sephadex LH-20(瑞士Pharmacia公司);聚酰胺薄膜(20×20 cm,浙江台州路桥四青生化材料厂);薄层色谱硅胶G(青岛海洋化工厂);其他试剂均为分析纯。
2 提取与分离
江南卷柏干燥全草12 kg,切段,依次用15倍量95%、90%、80%乙醇各提取3 h,滤过,减压回收乙醇,浓缩成浸膏,用蒸馏水分散,依次用石油醚、乙酸乙酯、水饱和正丁醇萃取,得到正丁醇部位浸膏120 g。取正丁醇部位浸膏113 g,上样于聚酰胺柱(60~100目,86 cm×9 cm),以不同浓度的水-乙醇梯度洗脱,每500 mL为一流分,共收集279份流分,用硅胶G薄层和聚酰胺薄膜检识,合并相同流分,得28个部分(Fr1~Fr28)。取Fr6(纯水洗脱部分)、Fr7(5%乙醇洗脱部分)经Sephadex LH-20柱色谱(甲醇,60 cm×2.2 cm)纯化,流分结晶后得化合物Ⅰ(40 mg);采用相同方法,Fr9(10%~15%乙醇洗脱部分)纯化得复合结晶Ⅱ和Ⅲ(16 mg)。此外,Fr8(10%乙醇洗脱部分)和Fr10(15%乙醇洗脱部分)经过Sephadex LH-20柱色谱后,再用半制备高效液相色谱分离,亦得到复合结晶Ⅱ和Ⅲ(10mg)。
3 结构鉴定
化合物Ⅰ:淡黄色粉末(甲醇),UV(MeOH)λmax:272、333 nm;IR(KBr)νmax:3 383(br,OH)、2 927(CH2)、1 651(Ar-C=O)、1 626、1 574、1 511、1 481(芳环骨架振动)、829(苯环对位二取代)cm-1;HR ESI-MS(m/z595.1 657[M+H]+,计算值595.1 663)推断分子式为C27H30O15(Ω=13)。三氯化铁反应阳性,喷三氯化铝显色剂于紫外光灯下显黄色荧光,提示可能为黄酮类化合物;氨气熏后黄色荧光不变亮,为黄酮苷;常规酸水解条件下不能被水解,表明为碳苷。其核磁共振氢谱(1H-NMR,DMSO-d6,600 MHz)见表1;核磁共振碳谱(13C-NMR,DMSO-d6,150 MHz)见表2。δC低于140的碳原子数有6个,说明黄酮母核除C-2、C-4、C-9外,还有3个碳原子连有氧原子,这和1H-NMR中显示3个-OH信号相符。糖基碳原子δ低至81,是碳苷的表现。HSQC中δC73.9、73.2分别与δH4.81(1H,d,J=10.8 Hz)、4.76(1H,d,J=10.2 Hz)相关,是2个碳苷端基C、H信号。根据13C-NMR中的12个糖碳信号,DEPT谱δC59.7、61.2显示的2个CH2,1H-NMR中糖基所有氢原子的偶合常数JH-H值都大于5Hz以及2个端基氢的偶合常数(J=10.8 Hz,10.2 Hz),说明2个糖单元都为β-D-吡喃葡萄糖,并且各自连在母核上。HMBC中端基H-1″与母核C-5、C-6、C-7远程相关,端基H-1′″与母核C-7、C-8、C-9远程相关,表明2个糖基分别连在母核C-6和C-8位;另有远程相关信号确定了3个-OH取代位置在母核C-5、C-7、C-4′位。综合上述分析,并与文献对照[7],确定其为芹菜素-6,8-二-C-β-D-吡喃葡萄糖苷。
复合物Ⅱ和Ⅲ:黄色粒状结晶(甲醇),UV(MeOH)λmax:272、330 nm;三氯化铁反应阳性,三氯化铝反应紫外光灯下显黄色荧光,提示可能为黄酮类化合物;其1H-NMR(DMSO-d6,600 MHz)见表1;13C-NMR(DMSO-d6,150 MHz)见表2。糖基碳原子δC低至81,表明为碳苷。δC59~81有22个C信号(δC70.3为重叠),表明有4个糖基(2个六碳糖和2个五碳糖)。HMQC可确定4个端基C-H:δC75.2、73.6、74.9、73.9分别与δH5.02(1H,d,J=9.0 Hz)、4.74(1H,d,J=9.6 Hz)、4.65(1H,d,J=9.0 Hz)、4.55(1H,d,J=9.6 Hz)相关。4个端基碳都处于较高场δC73~75,说明4个糖基与母核以碳键相连,为碳苷。端基氢的偶合常数(J=9.0 Hz,9.6 Hz)说明4个糖基都是β构型;DEPT谱显示 4 个CH2:δC59.7、61.2、70.3(2个CH2叠加),1H-NMR(600 MHz)任意2个H的JH-H值都不小于3 Hz,以及表2数据表明4个糖基为2个β-D-吡喃葡萄糖和2个β-D-吡喃木糖[8~10]。母核碳信号个数为24(部分重叠),大于15,且多数信号成对出现,提示分子中可能含有2个黄酮单元,或者是2个化合物的复合物。据HMBC糖端基H与母核C-6、C-8位的远程相关,确定了4个糖基分别连在母核上的6,8位;结合HMQC,1H-NMR确定了C-5、C-7、C-4′位有-OH取代,C-3位有H。因所有位置均有归属,2个黄酮单元无处相连,判断其为一对同分异构体复合物。这个判断经质谱得到了证实:HR ESI-MS在300~1 300分子量范围内只显示一个准分子离子峰(m/z563.1 395[M-H]-,计算值563.1 401),证实了该晶体是一对分子式为C26H28O14(Ω=13)的同分异构体,确定其为芹菜素-6-C-β-D-吡喃葡萄糖-8-C-β-D-吡喃木糖苷和芹菜素-6-C-β-D-吡喃木糖-8-C-β-D-吡喃葡萄糖苷的复合物。化合物结构式及HMBC相关性表达见图1。

表 1化合物Ⅰ、Ⅱ、Ⅲ的 1H-NMR 数据(600 MHz,(J)HzDMSO-d6)Tab 1 1H-NMR data of compoundⅠ、Ⅱ、Ⅲ(600 MHz,(J)Hz,DMSO-d6)

表2 化合物Ⅰ、Ⅱ、Ⅲ的13C-NMR数据(150 MHz,DMSO-d6)Tab 2 13C-NMR data of compoundⅠ、Ⅱ、Ⅲ(150 MHz,DMSO-d6)
4 化合物抑制环氧化酶(COX-2)活性测试
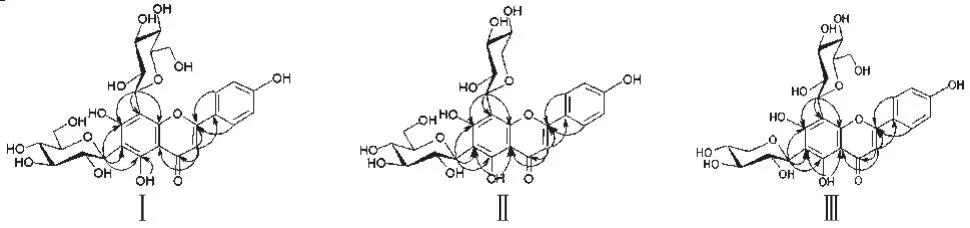
图1 化合物结构式及HMBC相关性表达Ⅰ.芹菜素-6,8-二-C-β-D-吡喃葡萄糖苷;Ⅱ.芹菜素-6-C-β-D-吡喃葡萄糖-8-C-β-D-吡喃木糖苷;Ⅲ.芹菜素-6-C-β-D-吡喃木糖-8-C-β-D-吡喃葡萄糖苷Fig 1 Structures and key correlations for compoundsⅠ.6,8-di-C-β-D-glucopyranosylapigenin;Ⅱ.6-C-β-D-glucopyranosyl-8-C-β-D-xylopyranosylapigenin;Ⅲ.6-C-β-D-xylopyranosyl-8-C-β-D-glucopyranosylapigenin
选择化合物Ⅰ进行抑制COX-2的活性测试。参照文献方法[11],将化合物Ⅰ作用于培养的人结肠癌细胞(HT-29),配成不同浓度的试验组(终浓度分别为12.5、25.0、50.0 μg·mL-1),同时设空白对照组、阳性对照姜黄素组(3.125 μg·mL-1)做对比,继续培养,提取总RNA。采用RT-PCR技术检测药物作用前、后HT-29细胞中COX-2 mRNA的表达,扩增产物的电泳结果见图2。以灰度值即COX-2 275bp电泳带与内参β-actin 234 bp电泳带的吸光度值的比值来反映COX-2 mRNA的相对含量(计算公式:COX-2 mRNA灰度值=COX-2 mRNA密度/β-actin mRNA密度)(见表3)。结果,样品组的灰度值与其浓度之间呈负相关,相关系数为-0.944,说明化合物Ⅰ可在mRNA水平抑制HT-29COX-2的表达。

图2 电泳图M.DL2000 DNA Marker;1.空白对照组;2.阳性对照姜黄素 3.125 μg·mL-1;3.化合物Ⅰ 12.5 μg·mL-1;4.化合物Ⅰ 25.0 μg·mL-1;5.化合物Ⅰ50.0 μg·mL-1Fig 2 ElectrophoretogramM.DL2000 DNA Marker;1.blank control group;2.curcumin positive control 3.125 μg·mL-1;3.compoundⅠ 12.5 μg·mL-1;4.compoundⅠ25.0 μg·mL-1;5.compoundⅠ 50.0 μg·mL-1

表3 灰度值测定结果Tab 3 Results of gray scale determination
5 讨论
除以上3种黄酮碳苷外,笔者还从江南卷柏正丁醇部位分离鉴定了一个新的黄酮氧苷:系由上述聚酰胺柱色谱40%乙醇洗脱部分,经Sephadex LH-20柱(甲醇)纯化、结晶而得(51 mg),经理化性质和波谱分析,鉴定为5-羧甲基-4′-羟基-黄酮-7-O-β-D-吡喃葡萄糖苷,是首次发现的5-羧甲基取代的黄酮类型,这一研究发表在Chinese Chemical Letters[12];之后,这一黄酮类型又有新发现:Cao Y[13]等2010年从江南卷柏、申健[6]从布朗卷柏中分别发现了新化合物:5-羧甲基-4′,7-二羟基黄酮,Cao Y等[13]还得到了它的乙酯和丁酯,也是2个新化合物并具抗乙型肝炎病毒活性。申健[6]还分离得到了与江南卷柏相同的成分:4′-羟基-5-羧甲基黄酮-7-O-β-D-葡萄糖苷。至此,卷柏属中已报道了4种5-羧甲基取代的黄酮类化合物。
[1]全国中草药汇编编写组.全国中草药汇编(上册)[M].北京:人民卫生出版社,1975:339
[2]陈德钊,余竞光.江南卷柏化学成分分析[J].中草药,1986,17(1):4.
[3]Sun CM,Syu WJ,Huang YT,et al.Selective cytotoxicity of ginkgetin fromSelaginella moellendorffii[J].J Nat Prod,1997,60(4):382.
[4]史社坡.卷柏化学成分研究[D].郑州:河南中医学院,2003.
[5]朱田密.江南卷柏的生药学研究Ⅱ-黄酮苷类成分的分离鉴定[D].武汉:湖北中医学院,2008.
[6]申 健.布朗卷柏化学成分研究[D].长沙:中南大学,2010.
[7]张嫚丽,李作平,贾湘曼.麻叶荨麻化学成分研究[J].天然产物研究与开发,2005,17(2):175.
[8]Rancon S,Chaboud A,Darbour N,et al.A new C-glycosyl xanthone isolated fromDavallia solida[J].Phytochemistry,1999,52(8):1 678.
[9]Feng J,Yang XW,Wang RF.Bio-assay guided isolation and identification ofα-glucosidase inhibitors from the leaves ofAquilaria sinensis[J].Phytochemistry,2011,72(2-3):244.
[10]李晓亮,汪 豪,刘 戈,等.广金钱草的化学成分研究[J].中药材,2007,30(7):802.
[11](美)萨姆布鲁克,(美)拉塞尔著.黄培堂译.分子克隆实验指南[M].第3版.北京:科学出版社,2002:676.
[12]Zhu TM,Chen KL,Zhou WB.A new flavone glycoside fromSelaginella moellendorffiiHieron.[J].Chin Chem Lett,2008,19(12):1 456.
[13]Cao Y,Tan NH,Chen JJ,et al.Bioactive flavones and biflavones fromSelaginella moellendorffiiHieron.[J].Fitoterapia,2010,81(4):253.

