PTHrP和BSP联合检测在前列腺癌骨转移诊断中的价值
朱开常,许小林,刘 峰,王 忠,陈 琳,沈建国,金建忠,王 悦,李 迅,徐 敏,李家栋
(上海交通大学附属第六人民医院奉贤分院,上海201400)
甲状旁腺激素相关蛋白(Parathyroid hormone related protein,PTHrP)是1987年从恶性高血钙肿瘤患者的肿瘤中提取纯化的,与细胞的增殖分化和钙转移有关。多种类型肿瘤组织中存在PTHrP过度表达,并已证实PTHrP为恶性肿瘤致体液性高血钙的原因[1]。人骨唾液蛋白(Human bone sialoprotein,hBSP)是细胞外基质中的一种酸性糖蛋白,参与信号识别、细胞黏附和转移,在破骨细胞和成骨细胞与骨小梁表面结合过程中发挥重要作用。BSP与恶性肿瘤及骨转移有相关性,且在众多前列腺癌骨转移标志中,显示出很高的灵敏性及特异性[2]。近期我们对2009年1月~2010年9月确诊的原发性前列腺癌患者检测了其前列腺癌组织中PTHrP和BSP表达,并探讨二者表达与术后骨转移的关系,旨在为前列腺癌骨转移的预防和治疗寻找新的药物靶点提供依据。
1 材料与方法
1.1 材料 89例前列腺癌患者癌组织石蜡包埋标本,患者年龄32~74(54.6±4.2)岁,中位年龄46岁。均经病理检查证实诊断,TNM分期Ⅰ期6例,Ⅱ期48例,Ⅲ期30例,Ⅳ期5例。根据核素骨显像结果分为骨转移组42例和无骨转移组47例,其中无骨转移组包括无转移患者26例,骨外转移患者21例。两组一般资料具有可比性。
1.2 PTHrP和BSP表达检测 采用常规ABC法对两组标本行PTHrP和BSP的免疫组织化学染色。PTHrP鼠抗人单克隆抗体购于美国Calbiochem公司,BSP鼠抗人单克隆抗体购自加拿大Bio-Wen公司,ABC免疫组化试剂盒和DAB染色盒购自北京中山试剂公司,按照试剂盒说明进行操作。以已知PTHrP和BSP的阳性切片作为对照,以磷酸盐缓冲液(PBS)代替一抗作为每次染色的阴性对照。PTHrP和BSP阳性细胞染色为棕黄或棕褐色,定位于胞质,连续计数>10个高倍视野,每个高倍视野计数100个腺上皮细胞,计算阳性细胞的平均百分率,阳性细胞数<25%为阴性,25%~80%为弱阳性(+),>80%为强阳性(++)。
1.3 随访 采用电话或信件方式对两组进行随访,随访截至2011年10月1日,共随访12个月,记录新发生的骨转移情况,随访终点为研究结束或患者死亡。对可能影响前列腺癌患者骨转移的临床因素采用Cox比例风险回归模型统计,患者生存预后情况采用Log-rank生存曲线分析。
1.4 统计学方法 应用SPSS13.0软件包进行数据处理,组间计数资料的比较采用χ2检验,检验水准α =0.05。
2 结果
2.1 两组PTHrP和BSP表达 PTHrP和BSP染色部位均位于癌细胞胞质,边缘正常前列腺上皮细胞和浸润淋巴细胞均无着色。PTHrP和BSP在骨转移组阳性表达均明显高于无骨转移组(χ2值分别为10.47 和8.48,P 均 <0.01),且强阳性表达亦均明显高于后者(χ2值分别为 11.04和 9.17,P 均 <0.05),见表1。无骨转移组中无转移及骨外转移者两指标阳性率无统计学差异。
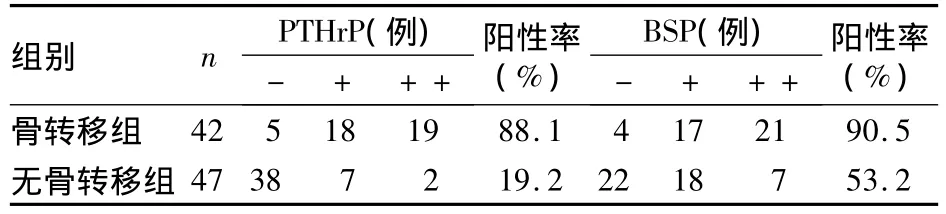
表1 两组前列腺癌组织PTHr P和BSP表达比较
2.2 随访 随访率100%。无骨转移组随访12个月,17例发生骨转移。Cox比例风险回归模型分析结果显示,前列腺癌组织中PTHrP和BSP高表达是骨转移的主要危险因素(P<0.01),其相对危险度分别为1.348和1.293(表2)。两组随访期间共有24例死亡,Log-rank生存曲线分析结果显示,随着观察时间延长,PTHrP和BSP高表达者累积生存概率均明显低于PTHrP和 BSP阴性表达者(P均<0.05)。
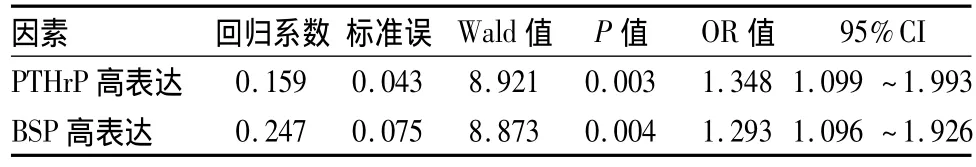
表2 PTHr P和BSP对前列腺癌骨转移的Cox比例风险回归模型分析
3 讨论
转移性骨肿瘤是晚期恶性肿瘤的常见并发症,据统计,发生率占全身转移性肿瘤的15%~20%,仅次于肺转移和肝转移[3]。肿瘤患者发生骨转移后常导致局部剧烈疼痛、病理性骨折、高钙血症、脊髓压迫等症状,不仅严重影响患者的生活质量,而且影响患者的生存期。临床约70%的乳腺癌、前列腺癌等亲骨性肿瘤患者在自然病程中发生骨转移,肺癌、胃癌、结直肠癌、肾癌、甲状腺癌等患者在病程发展中亦有15%~30%发生骨转移[3]。
PTHrP是1987年Burtis等从与高钙血症相关的恶性肿瘤组织中分离出一种具有全身作用的体液因子,其生物学作用多样,参与多种组织器官的生长发育,如骨骼、皮肤、牙齿、肾脏、胰腺等,还直接影响胎儿的骨骼矿化,对某些细胞的增殖和分化起促进作用[4,5]。PTHrP作为成骨细胞的一种自分泌和旁分泌因子调节骨形成和骨吸收[6,7]。在前列腺癌和乳腺癌的动物模型中,PTHrP具有促进骨转移的作用[5,8~10],但有关 PTHrP 在肿瘤骨转移中的具体作用与机制尚不清楚[1,11,12]。
BSP是细胞外基质中一个大的糖基化和磷酸化蛋白,其相对分子质量为70~80 kD,核心蛋白为33~34 kD,在破骨细胞、成骨细胞、滋养细胞、血小板中均发现有BSP和其mRNA表达,并且发现BSP在破骨细胞和成骨细胞与骨小梁表面结合过程中发挥重要作用。研究表明,许多肿瘤在发展过程中均伴随有BSP表达,而这些表达BSP的肿瘤亦更容易表现出侵袭、转移[13]。Waltregny 等[14]对乳腺癌和前列腺癌研究首次阐明BSP在肿瘤的骨转移中作用显著。Jain等[15]研究提示,血清BSP是诊断前列腺癌骨转移的重要参考指标,其水平的增高是骨转移的高危因素,BSP的高稳定表达可增加前列腺癌细胞的血管侵袭能力,提高前列腺癌细胞的骨骼黏附能力,对前列腺癌骨转移可能起促进作用。
本研究结果显示,PTHrP和BSP在骨转移组的阳性表达率均明显高于无骨转移组,且强阳性表达亦均明显高于后者,支持PTHrP和BSP高表达与前列腺癌骨转移密切相关的理论。PTHrP和BSP阳性表达率在无转移者和骨外转移者间比较差异无统计学意义,进一步证实PTHrP和BSP预测骨转移发生的优越性和靶向性。本研究对47例未发现骨转移患者随访12个月,结果17例发生骨转移。Cox比例风险回归模型分析发现,前列腺癌组织中PTHrP和BSP高表达是预测骨转移的主要危险因素,其相对危险度分别为1.348和1.293。同时,应用Log-rank生存曲线分析结果提示,随着观察时间延长,在前列腺癌患者中PTHrP和BSP高表达者的累积生存概率均明显低于PTHrP和BSP阴性表达者,提示PTHrP和BSP高表达患者的预后较差。PTHrP和BSP可作为评估前列腺癌患者预后的重要预测因子。
[1]Li J,Karaplis AC,Huang DC,et al.PTHrPdrives breast tumor initiation,progression,and metastasis in mice and is a potential therapy target[J].J Clin Invest,2011,121(12):4655-4669.
[2]Gordon JA,Sodek J,Hunter GK,et al.Bone Sialoprotein Stimulates Focal Adhesion-Related Signaling Pathways:Role in Migration and Survival of Breast and Prostate Cancer Cells[J].J Cell Biochem,2009,107(6):1118-1128.
[3]Berenson JR,Rajdev L,Broder M.Pathophysiology of bone metastases y[J].Cancer Biol Ther,2006,5(9):1078-1081.
[4]Mau E,Whetstone H,Yu C,et al.PTHrP regulates growth plate chondrocyte differentiation and proliferation in a Gli3 dependent manner utilizing hedgehog ligand dependent and independent mechanisms[J].Dev Biol,2007,305(1):28-39.
[5]Bhatia V,Mula RV,Falzon M.1,25-Dihydroxyvitamin D(3)regulates PTHrP expression via transcriptional,post-transcriptional and post-translational pathways[J].Mol Cell Endocrinol,2011,342(1-2):32-40.
[6]Juppner H,Abou-Samra AB,Freeman M,et al.A Gprotein-linked receptor for parathyroid hormone and parathyroid hormone-related peptide[J].Science,1991,254(5034):1024-1026.
[7]Uy HL,Guise TA,De La Mata J,et al.Effects of parathyroid hormone(PTH)-related protein and PTH on osteoclasts and osteoclast precursors in vivo[J].Endocrinology,1995,136(8):3207-3212.
[8]Deftos LJ,Barken I,Burton DW,et al.Direct evidence that PTHrP expression promotes prostate cancer progression in bone[J].Biochem Biophys Res Commun,2005,327(2):468-472.
[9]Guise TA,Yin JJ,Thomas RJ,et al.Parathyroid hormone-related protein(PTHrP)-(1-139)isoform is efficiently secreted in vitro and enhances breast cancer metastasis to bone in vivo[J].Bone,2002,30(5):670-676.
[10]Downs TM,Burton DW,Araiza FL,et al.PTHrPstimulates prostate cancer cell growth and upregulates aldo-keto reductase1C3[J].Cancer Lett,2011,306(1):52-59.
[11]Alonso V,Perez-Martinez FC,Calahorra FJ,et al.Phytoestrogen modulation of bone-related cytokines and its impact on cell viability in human prostate cancer cells[J].Life Sci,2009,85(11-12):421-430.
[12]DaSilva J,Gioeli D,Weber MJ,et al.The Neuroendocrine-Derived Peptide Parathyroid Hormone-Related Protein Promotes Prostate Cancer Cell Growth by Stabilizing the Androgen Receptor[J].Cancer Res,2009,69(18):7402-7411.
[13]Fedarko NS,Jain A,Karadag A,et al.Elevated serum bone sialoprotein and osteopontin in colon,breast,prostate,and lung cancer r[J].Clin Cancer Res,2001,7(12):4060-4066.
[14]Waltregny D,Bellahcene A,De Leval X,et al.Increased expression of bone sialoprotein in bone metastases compared with visceral metastases in human breast and prostate cancers r[J].JBone Miner Res,2000,15(5):834-843.
[15]Jain A,McKnight DA,Fisher LW,et al.Small Integrin-Binding Proteins as Serum Markers for Prostate Cancer Detection[J].Clin Cancer Res,2009,15(16):5199-5207.

