不同年龄女性脂肪组织11βHSD1 mRNA表达水平及临床意义
计晨琳 孙 斌 韩素萍 王 晶 张 丽 祝丽珺 李晓南
(南京医科大学儿科研究所,江苏 南京 210029)
11β羟基类固醇脱氢酶1型(11βHSD1)可介导组织局部无活性的可的松转化为活性的氢化可的松,促进脂肪细胞分化和脂质积聚。研究发现腹部脂肪组织11βHSD1的表达与腰围、体脂含量、腰臀比(WHR)〔1〕及体质指数(Body mass index,BMI)〔2〕密切相关,是内脏型肥胖连接代谢综合征的重要分子机制。但目前临床研究主要限于某一年龄阶段(如成年)或某一部位(如网膜组织)11βHSD1的表达,尚不清楚不同部位脂肪组织11βHSD1 mRNA表达水平是否随年龄增加和脂肪分布的变化发生改变,进而增加发生中心性肥胖和胰岛素抵抗的危险。基于脂肪组织增生和分布的明显的年龄特征性,本研究探讨脂肪组织11βHSD1 mRNA表达水平与年龄、部位、BMI及WHR的关系。
1 资料与方法
1.1 研究对象 选取腹部手术的女性患者35例,其中女童11例,育龄期妇女13例,绝经期妇女11例。绝经期妇女至少月经停止12个月以上。凡患有全身严重感染、代谢疾病、恶性肿瘤或糖尿病的患者均不作为研究对象,以排除疾病因素对基因表达的影响。本研究通过南京医科大学伦理委员会的审批,并征得患者知情同意。
1.2 临床资料及标本收集
1.2.1 临床资料 所有研究对象都由经过专业培训的医生进行测量与评估,并记录姓名、住院号、性别、年龄、身高、体重、腰围、臀围。测量均在手术前进行,应用体重秤测量体重,身高测量仪测量身高,卷尺测量腰围、臀围。被试者脱衣帽,仅着内衣,按标准方法测量身高、体重,精确至0.1 cm和0.1 kg;腰围测量经脐水平周径,臀围测量经股骨粗隆水平周径,均精确至0.1 cm,并计算BMI和WHR。
1.2.2 标本采集 研究对象于手术开始后30 min,取皮下及网膜脂肪组织约1 g,分别装入离心管内,-70℃保存,用于11βHSD1基因表达研究。
1.3 方法
1.3.1 脂肪组织11βHSD1 mRNA表达水平检测 按Trizol法抽提脂肪组织总 RNA,根据分光光度计测定 OD260 nm和OD280 nm值计算RNA含量和纯度。1%琼脂糖凝胶电泳验证RNA完整性。1 μg总 RNA 用反转录试剂盒(Promega,Madison,WI)合成cDNA,应用ABI PRISM 7500荧光定量PCR仪进行PCR扩增,反应条件:50℃,2 min;95℃,10 min;95℃ 15 s;60℃ 1 min;循环45次,4℃保存。
11βHSD1、β-actin 引物及探针均由美国 Applied Biosystems公司合成。11βHSD1和β-actin引物及探针序列见表1。
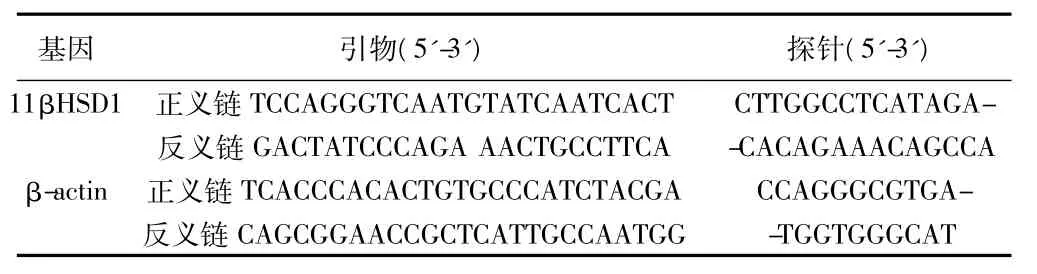
表1 实时定量PCR中11βHSD1及β-actin引物及探针
1.3.2 计算方法 采用相对定量法计算11βHSD1 mRNA表达水平,用管家基因校正样品初始量。计算公式为2-△△Ct。
1.4 统计学处理 应用SPSS 13.0软件进行数据整理和统计。首先进行正态性检验,正态分布资料的结果以±s表示,三组间均数比较采用方差分析F检验,进一步采用q检验进行两两比较,配对比较采用配对t检验。相关分析应用Pearson相关分析。
2 结果
2.1 女童组、育龄期组与绝经期组临床资料的比较 女童组、育龄期组与绝经期组妇女临床资料如表2所示,女童和育龄期妇女BMI均在正常范围。绝经期妇女腰围、BMI、WHR明显高于育龄期妇女(P<0.05)。
表2 三组临床测量指标(±s)
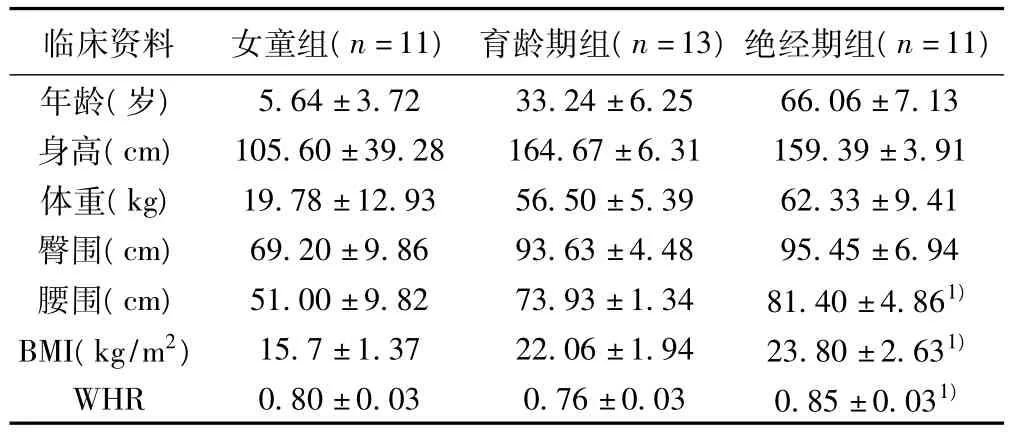
表2 三组临床测量指标(±s)
与育龄期组比较:1)P<0.05
临床资料 女童组(n=11) 育龄期组(n=13)绝经期组(n=11)年龄(岁)5.64±3.72 33.24±6.25 66.06±7.13身高(cm) 105.60±39.28 164.67±6.31 159.39±3.91体重(kg) 19.78±12.93 56.50±5.39 62.33±9.41臀围(cm) 69.20±9.86 93.63±4.48 95.45±6.94腰围(cm) 51.00±9.82 73.93±1.34 81.40±4.861)BMI(kg/m2) 15.7±1.37 22.06±1.94 23.80±2.631)WHR 0.80±0.03 0.76±0.03 0.85±0.031)
2.2 不同年龄组别脂肪组织11βHSD1 mRNA表达水平的比较 如表3所示,无论皮下还是网膜脂肪组织,女童、育龄期与绝经期三组间11βHSD1 mRNA表达水平均存在显著差异。女童脂肪组织11βHSD1 mRNA表达水平明显低于育龄期及绝经期妇女,育龄期妇女脂肪组织11βHSD1 mRNA表达水平明显低于绝经期妇女。对BMI进行校正后,这种差异仍存在。皮下和网膜配对比较显示,绝经期组网膜脂肪组织11βHSD1 mRNA表达水平明显高于皮下,而女童组与育龄期组脂肪组织11βHSD1 mRNA表达水平无明显部位差异。
表3 三组脂肪组织11βHSD1 mRNA的表达水平(±s)

表3 三组脂肪组织11βHSD1 mRNA的表达水平(±s)
与女童组比较:1)P<0.05;与育龄期组比较:2)P<0.05;与皮下脂肪组织比较:3)P<0.05
组别 皮下 网膜女童组(n=11)0.71±0.47 1.08±0.51育龄期组(n=13) 1.37±0.271) 1.69±0.481)绝经期组(n=11) 2.50±0.491)2) 3.21±0.701)2)3)
2.3 脂肪组织11βHSD1 mRNA表达水平与身体测量指标的相关分析 女童皮下及网膜脂肪组织11βHSD1 mRNA水平与腰围、臀围、BMI及WHR均无明显相关关系。将育龄期组和绝经期组合并后分析显示,成年妇女网膜11βHSD1 mRNA表达水平与 BMI(r=0.416;P<0.05)及 WHR(r=0.775,P<0.001)呈显著正相关,对BMI进行校正后,网膜11βHSD1 mRNA表达水平与WHR相关性依然存在。
3 讨论
11βHSD1是一种定位于内质网腔的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)依赖性酶,属短链脱氢/还原酶蛋白超家族,在体内许多组织均有表达,如肝脏、脑、脂肪组织、生殖腺、骨骼肌等〔3〕。研究表明,人类11βHSD1在组织中的表达与个体发育密切相关,胎儿期、围产期及婴儿期可在肺中检测到11βHSD1的活性,但儿童期以后活性下降;孕晚期可测到羊胎肾周脂肪组织中11βHSD1 mRNA表达,出生后随年龄增加,成年时11βHSD1 mRNA表达水平达高峰〔4〕。我们在前期研究中也证实0~14岁儿童网膜脂肪组织11βHSD1 mRNA表达与年龄正相关〔5〕。此次证实人类脂肪组织中11βHSD1 mRNA表达随着年龄的增长呈明显增加趋势。
业已知,脂肪组织增生包括前脂肪细胞和脂肪细胞数目的增加和(或)脂肪细胞体积增大。儿童时期尤其是婴儿期、5~6岁以及青春期是脂肪组织增长敏感时期,主要表现为前体脂肪细胞数目的增加,分化为体积较小的脂肪细胞,随着年龄的增加脂肪细胞增殖能力不断减弱,成年后脂肪细胞数目不再明显增加,而以脂肪细胞体积的增大为主〔6〕。11βHSD1能使组织中无活性的可的松转化为有活性的氢化可的松。氢化可的松可抑制前脂肪细胞的增殖,促进前体脂肪细胞向成熟脂肪细胞分化和脂质积聚〔7〕。氢化可的松亦可通过旁分泌作用促进脂肪组织11βHSD1的表达,形成正反馈调节,进一步放大组织局部糖皮质激素的作用。因此,随年龄增加的11βHSD1 mRNA表达水平可能间接反映脂肪细胞在儿童时期以数目增殖为主到成年后以分化为主的状态,11βHSD1通过放大组织局部糖皮质激素活性,促进脂肪组织的增长和脂质聚集。
人类脂肪组织的分布呈现年龄与性别依赖性。新生儿及幼儿的脂肪组织均匀连续地分布于皮下,内脏脂肪极为有限,随年龄增长,内脏脂肪组织逐步增加。青春期后,脂肪组织分布出现男女特征性改变:成年男性脂肪组织主要分布在腹部内脏;成年女性脂肪组织主要分布在胸、臀及股部皮下。进入绝经期以后,女性体重增加,尤其是体脂增加,脂肪组织重新分布(由外周转移至内脏)。腰围和WHR是临床上反映体脂分布的常用指标,与腹部皮下和内脏脂肪含量密切相关〔8,9〕。本研究发现,成年女性无论育龄期或绝经期妇女腹部皮下及网膜脂肪组织中11βHSD1 mRNA表达水平明显高于女童,且网膜脂肪组织11βHSD1 mRNA表达水平与WHR显著正相关,这与以往成人研究一致,提示11βHSD1可能参与体内脂肪组织的分布。尤其值得注意的是,绝经期妇女11βHSD1 mRNA表达出现了明显的部位差异性:网膜脂肪组织高于皮下,提示11βHSD1可能参与调控绝经期后体内脂肪组织由皮下向内脏再分布,而内脏脂肪组织的堆积是绝经期发生心血管疾病的高危因素。
本研究对不同时期女性脂肪组织11HSD1表达水平做了初步的探讨,由于年龄跨度较大,样本量较少,在一定程度上影响了11HSD1表达水平与临床测量指标的关系。此外,临床取材有限,尤其是儿童标本量较少,脂肪组织主要满足基因水平的测定。进一步扩大样本,深入研究不同年龄阶段脂肪组织的分化、分布和内分泌改变的生理病理机制,是未来临床肥胖研究的一个挑战。
1 Desbriere R,Vuaroqueaux V,Achard V,et al.11beta-hydroxysteroid dehydrogenase type 1 mRNA is increased in both visceral and subcutaneous adipose tissue of obese patients〔J〕.Obesity(Silver Spring),2006;14(5):794-8.
2 Rask E,Walker BR,Soderberg S,et al.Tissue-specific changes in peripheral cortisol metabolism in obese women:increased adipose 11betahydroxysteroid dehydrogenase type 1 activity〔J〕.J Clin Endocrinol Metab,2002;87(7):3330-6.
3 Grundy M,Jr Brewer HB,Cleeman JI,et al.Definition of metabolic syndrome:Report of the National Heart,Lung,and Blood Institute/American Heart Association conference on scientific issues related to definition〔J〕.Circulation,2004;109(3):433-8.
4 Gnanalingham MG,Mostyn A,Symonds ME,et al.Ontogeny and nutritional programming of adiposity in sheep:potential role of glucocorticoid action and uncoupling protein-2〔J〕.Am J Physiol Regul Integr Comp Physiol,2005;289(5):1407-15.
5 Li X,Lindquist S,Chen R,et al.Depot-specific messenger RNA expression of 11 beta-hydroxysteroid dehydrogenase type 1 and leptin in adipose tissue of children and adults〔J〕.Int J Obes(Lond),2007;31(5):820-8.
6 Spalding KL,Arner E,Westermark PO,et al.Dynamics of fat cell turnover in humans〔J〕.Nature,2008;453(7196):783-7.
7 Tomlinson JW,Walker EA,Bujalska IJ,et al.11beta-hydroxysteroid dehydrogenase type 1:a tissue-specific regulator of glucocorticoid response〔J〕.Endocr Rev,2004;25(5):831-66.
8 de Koning L,Merchant AT,Pogue J,et al.Waist circumference and waistto-hip ratio as predictors of cardiovascular events:meta-regression analysis of prospective studies〔J〕.Eur Heart J,2007;28(7):850-6.
9 Perez LM,Galvez JM,Miranda MP.Validation of alternative anthropometric indexes as cardiovascular risk markers〔J〕.Endocrinol Nutr,2009;56(9):439-46.

