SNCA和PARK16多态性与中国辽宁地区汉族帕金森病人的关联分析*
罗 莎,田小菲,周懿舒,李冯锐,朱兰卉,罗晓光,任 艳,庞 灏△
(1中国医科大学法医学院,辽宁 沈阳 110001;2东北师范大学生命科学学院,吉林 长春 130024;3河北北方学院基础医学院法医系,河北 张家口 075000;4中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
帕金森病(Parkinson disease,PD)是一种常见的中枢神经系统变性疾病,其中65岁以上人群PD患病率为1% ~2%[1]。PD在临床上表现为静止性震颤、肌强直、运动迟缓、步态异常等;病理改变主要包括中脑黑质多巴胺(dopamine,DA)能神经元缺失,残存的神经元变性,以及Lewy小体在胞浆内的出现。目前为止,PD的病因尚不明确,但众多的研究显示PD可能与氧化应激、线粒体功能紊乱、环境毒素及遗传因素等密切相关。
PD多为散发病例,其中仅有少数的患者为家族性。随着对PD相关易感基因的研究,越来越多的证据表明PD患者中存在着多种遗传危险因素。目前,在家族性PD中已经确定了约18个相关的基因,并分别命名为PARK1~18。控制共核蛋白(α-synuclein)表达的基因SNCA(也称为PARK1)是第一个被发现的与PD相关的致病基因,基因表达产物在PD发病过程中发挥着核心作用[2]。纤维状共核蛋白是PD患者Lewy小体的主要成分,而且SNCA基因的突变可能与PD病人黑质纹状体多巴胺能神经元的退行性变有关。PARK16基因是近来在日本和欧洲群体中进行的全基因组关联研究(genome-wide association study,GWAS)发现的一个新的PD易患相关区域[3],在这个位于人类染色体1q32的区域中包含SLC45A3、NUCKS1、RAB7L1、SLC41A1 和 PM20D1 等多个 PD候选基因。尽管来自上述2个PD易感基因中的部分单核苷酸多态性(single nucleotide polymorphisms,SNPs)在国内外已经有相关报道[3-5],但是这些易感因素与PD的相关性在中国辽宁地区群体中尚未有任何相关数据。因此,本研究借助多重PCR-限制性片段长度多态性(restriction fragment lenth polymorphism,RFLP)技术,同时调查了中国辽宁地区PD与正常匹配人群中PARK16基因的rs16856139和SNCA基因的rs3857059两个SNPs位点的遗传多态性,以期逐步建立中国辽宁地区PD人群中易感基因的相关遗传学数据。
材料和方法
1 对象
中国辽宁地区汉族人群散发性PD患者213例,其中男112例,女 101例,平均年龄(62.39 ± 10.60)岁(24~85岁),所有患者均由中国医科大学附属第一医院神经内科学专家依据英国脑库PD诊断标准进行诊断。对照组为随机选择的健康辽宁地区汉族个体,其中男128例,女86例,平均年龄(63.15±10.84)岁(34~84岁)。本研究得到我校伦理委员会批准,所有研究对象均签署了知情同意书。
2 方法
2.1 基因组DNA提取 抽取研究对象外周静脉血约3 mL,采用SDS-蛋白酶K-酚氯仿法提取基因组DNA,紫外分光光度计测定DNA浓度后,-20℃保存备用。
2.2 多重PCR引物 依据报道的SNCA和PARK16的基因组序列,经 http://blast.ncbi.nlm.nih.gov/Blast.cgi进行特异性比对,同时考虑接续的限制性内切酶Pvu II的识别序列特征,由上海生工合成,引物相关序列见表1。
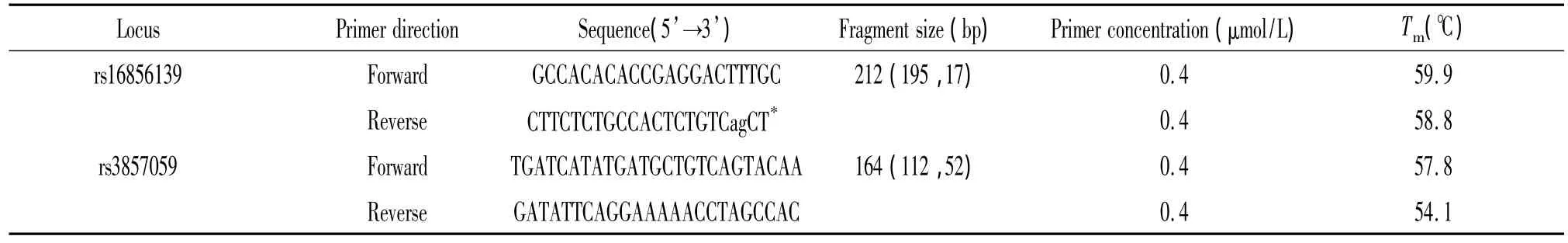
表1 rs16856139和rs3857059的引物序列及PCR扩增相关参数Table1.Primer sequences and parameters for PCR amplification on rs16856139 and rs3857059 loci
2.3 多重PCR-RFLP及产物检测 多重PCR是在一个20 μL的PCR反应体系中,包括1×Es Taq MasterMix(CWBIO,中国北京),引物浓度均为 0.4 μmol/L,见表 1,50 ~100 ng 的基因组DNA。反应条件为:95℃预变性2 min,95℃ 30 s,55℃ 30 s,72℃ 30 s,重复35个循环;最后72℃ 1 min。反应结束后,将2 μL PCR产物放入含有2.5 U Pvu II的限制性内切酶的反应体系中孵育2 h。酶切产物应用聚丙烯酰胺凝胶电泳分离(T=6%,C=5%),分离后的凝胶应用 10×genefinder(Bio-V,中国厦门)染色后,紫外灯下观察结果并照相保存。
3 统计学处理
采用统计分析软件SPSS 13.0和PLINK 1.07(http://pngu.mgh.harvard.edu/purcell/plink/)[6],对 PD 和正常人群组进行基因型的Hardy-Weinberg平衡吻合度检验,对两组基因频率和基因型频率进行χ2检验,同时对两组间数据的相关性进行统计学分析。
结 果
1 多重PCR-RFLP法对2个SNPs位点的基因型鉴定
PCR-RFLP进行基因型鉴定是一个简单的DNA水平分析SNP的方法,合理选择多个位点进行同步扩增,同时采用单一限制性内切酶进行消化及接续的片段长度分析,将是更为有效的SNPs分析手段。本研究选取2种PD易感基因中的2个SNPs位点为研究对象,其一的rs3857059位点如为rs3857059>G,可与其相邻碱基构成限制性内切酶Pvu II的识别序列;而另一个rs16856139位点的2种等位基因的碱基均不能与邻近碱基构成Pvu II的识别序列,但是本研究采用错配引物序列后可人为创建出Pvu II的识别序列。图1为本研究中采用PCR-RFLP法同步得出的2位点基因型分型图谱。rs16856139位点的PCR产物长度为212 bp,Pvu II酶切后仍然为212 bp的一个片段,为基因型TT;仅见一个195 bp的片段为CC基因型;同时见到215和195 bp的2个片段为CT基因型。rs3857059位点的PCR产物长度为164 bp,Pvu II酶切后仍然为164 bp的一个片段,为AA基因型;仅见一个112 bp的片段为GG基因型;同时见到164和112 bp的2个片段为AG基因型(片段大小如表1中所描述,但采用本研究的电泳条件,52 bp以下的片段从阳极侧泳出)。本研究的结果显示2个位点在所有样品中均可成功扩增和进行基因型判定。
2 rs3857059和rs16856139位点的基因型频率分布
应用上述分型方法,本研究对中国辽宁地区213例PD患者及214例正常个体的SNCA基因的rs3857059和PARK16基因的rs16856139位点的基因型频率分布进行了调查,相关数据结果见表2。统计学检验表明PD组与对照组基因型观察值与期望值符合Hardy-Weinberg平衡(P>0.05)。
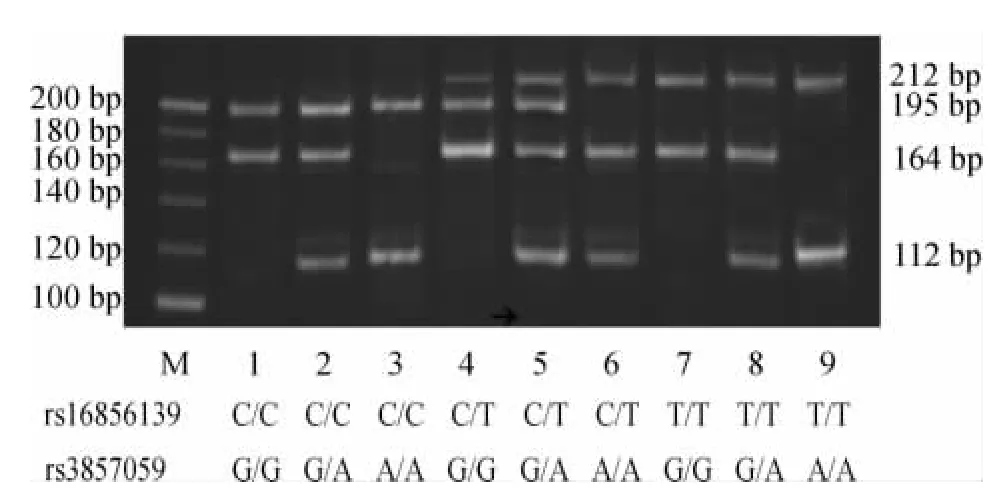
Figure1.The genotyping map of rs3857059 and rs16856139 loci determined by PCR -RFLP.图1 rs3857059和rs16856139位点PCR-RFLP的基因型分型图

表2 中国辽宁地区PD患者和正常人群中rs16856139和rs3857059位点基因型和等位基因频率的分布Table2.Distribution of genotypic and allelic frequencies of rs16856139 and rs3857059 loci in PD patients and control people in Liaoning area of China
比较2个位点在2个不同组中基因频率分布的数据显示,PD组在rs3857059位点上的G等位基因频率高于对照组(59.39%vs 49.77%),且差异具有统计学意义(χ2=7.592,P< 0.01,OR=0.677,95%CI 0.517 ~0.888);PD 组在rs16856139位点上的T等位基因频率明显低于对照组(4.69%vs 11.21%),差异有统计学意义(χ2=11.511,P <0.01,OR=0.390,95%CI 0.227 ~0.669),见表 2。此外,本研究也对rs3857059和rs16856139两个位点的多态性在性别上的差异进行了分析,相关遗传学数据见表3。从表中可以看出,在男性群体中的rs16856139和rs3857059的疾病相关性较强(P<0.01和 P<0.05,OR=0.365和 OR=0.723),但在女性群体中并不明显。
讨 论
目前为止已经发现的PD易感基因的SNPs超过数百个,这样,在不同PD人群中鉴定出密切相关的易感基因中的SNPs具有重要的临床意义。近来来自多个PD的GWAS研究显示,集中在SNCA、PARK16、LRRK2和BST14个基因中的SNPs与不同种族的PD患者发病危险性相关[3-4]。SNCA是第一个鉴定的与PD发病密切相关联的基因,基因定位在人类染色体4q21-q23上,由6个外显子和5个内含子组成。研究表明SNCA具有调节突触的可塑性、整合突触的前信号、调节突触处的多巴胺含量、热休克蛋白样作用及参与脂代谢调节等生理功能[7];病理上,SNCA基因表达的共核蛋白是Lewy小体的主要成分。这样,SNCA基因的突变不仅可以导致家族性PD病人黑质纹状体多巴胺能神经元的退行性变,异常的SNCA堆积也可引起痴呆、阿尔茨海默病、多系统萎缩及共济失调等神经系统疾病[8]。因此,其基因突变引起PD的研究备受关注。最早观察到的SNCA基因中的突变是A53T,之后在欧洲白种人PD家系中又发现了A30P和E46K,3个错义突变可解释部分白人群体中PD家系患病的原因。然而,在我国进行的A53T和A30P突变调查结果显示,其不是中国家族性帕金森病的突变热点,推测其在东方人群中是罕见的家族性帕金森病致病突变。2003年,苏敬敬等[9]选择SNCA基因的第3和第4外显子中A377T和C243G两个编码区的SNPs为研究靶点,在散发性的PD人群中进行了发病风险的调查,结果排除了SNCA基因A377T和C243G两个位点在散发性PD发病风险中的作用。Zhao等[10]首先在国内调查了共核蛋白基因启动子区微卫星多态性,发现了这个微卫星多态与晚发性散发性PD的发病风险有关。Chang等[11]的GWAS对中国PD人群SNCA基因的3个SNPs进行了调查,分别定位在SNCA基因5’侧翼区、3’侧翼区和内含子序列中SNPs的基因型数据显示,SNCA基因增加了PD患病的危险性。近来的GWAS在日本人群中的数据显示,SNCA基因区域中发现了7个与PD相关的SNPs,其中的rs3857059(P=5.68 ×10-16,OR=1.36)和 rs11931074(P=7.35 × 10-17,OR=1.37)两个位点与PD呈显著相关[3]。几乎同时发表的欧洲的 GWAS数据中,SNCA基因区域的 rs3857059、rs11931074及rs2736990构成白人群体中与PD显著性相关的前三位SNPs位点[4]。SNCA基因这些不同地区和种族表现出的相关性数据,进一步证明SNCA在所有群体中为主要的PD患病危险因子。比较2个群体中rs3857059位点的数据,可发现同为PD患病危险相关位点,但是群体之间的等位基因频率存在显著性差异,提示在PD中存在群体特异性遗传异质性。然而,目前对上述的GWAS水平发现的SNCA基因中的SNPs在其它群体内疾病-对照组相关性的研究报道甚少。本研究选择定位在 SNCA基因内含子4中的rs3857059位点进行基因多态性分析,首次在中国群体中发现G等位基因频率在PD患者组高于对照组,且差异具有统计学意义。这一结果符合日本群体中报导的数据,同时提示与PD发病遗传学上密切相关的SNCA基因,尽管在中国人群中的编码区未发现致病突变,但是非编码区可能存在一定的与PD发病相关联的SNP,本研究得到的数据也为进一步系统分析SNCA基因在中国PD人群中的作用提供了有意义的数据。

表3 不同性别中rs3857059和rs16856139的等位基因频率分布Table3.Allelic frequencies of rs16856139 and rs3857059 loci between different sexes
SLC45A3(solute carrier family 45,member 3)是 PARK16区域中包含的基因之一,最初发现其与前列腺癌发病相关,产物也称为前列腺相关蛋白6(PCANAP6)。基因的编码区长1662 bp,含有5个外显子。Satake等[3]鉴定的存在于PARK16与 PD相关的 7个 SNPs,仅 rs16856139存在于SLC45A3基因中,定位在内含子1序列内。自从GWAS中相关PARK16的研究显示日本人群中PD患者与该区域的部分SNPs密切相关后,以PARK16为靶点在不同地区和群体进行了广泛深入的研究。GWAS结果及不同方法的易感位点复制实验研究显示,在大部分欧洲起源的PD群体与PARK16呈弱相关[4];在英国和西班牙北部调查的频率数据显示与PD不相关[12-13];智利 PD患者中的基因型与 PARK16基因相关[14]。相关的研究近期也在众多的亚洲群体进行了报道。Chang等[11]调查了中国四川地区人群PARK16易感区域中的4个SNPs,发现包括rs16856139位点在内的3个次要基因与PD的低危险患病相关;来自中国浙江地区的rs16856139位点数据也显示,其次要等位基因频率在对照组明显高于PD组,暗示了次要基因的保护性作用[15];日本学者在PARK16区域发现的7个多态性位点中,认为其中的rs947211与PD相关性最强,但rs16856139也表现出为PD相关联的位点。然而,Tan等[16]报道的新加坡华人rs16856139位点数据与上述2个中国大陆地区的数据不同,频率数据在PD与对照组之间差距不显著。为了积攒更多的数据,同时也为了解PARK16基因SNPs在中国辽宁地区人群中分布的特征,本研究也对SLC45A3基因中的rs16856139位点进行了调查,结果显示中国辽宁地区群体中能够复制出日本、中国四川和浙江群体中观察到的结果,但是与上述群体中报道的数据比较(如表4所示),本研究的次要等位基因频率更低,提示该位点除了存在的高度种族差异性外,可能同样存在地域差异性。需要指出的是PD患者中PARK16的作用仍然是一个争论的焦点,种族起源的不同及样本大小可能导致了这些差异,但是进一步对SLC45A3基因其它相关SNPs位点的研究,以及对PARK16其它基因的SNPs研究将会为中国辽宁地区PD群体提供大量有意义的数据,也将会为系统分析这一基因对PD的作用提供帮助,同样也是对GWAS完成后的接续复制研究的进一步鉴定。
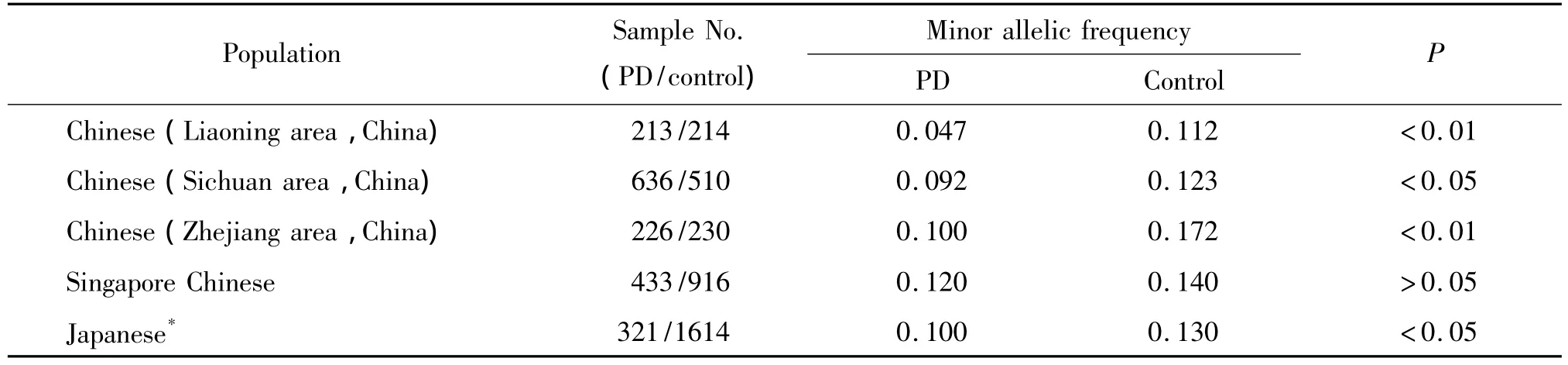
表4 SLC45A3基因rs16856139位点次要等位基因频率的比较Table4.Comparison of minor allelic frequencies of rs16856139 locus in SLC45A3 gene
综上所述,本研究成功应用多重PCR-RFLP技术同时检测了rs3857059和rs16856139的基因多态性;首次在中国辽宁地区群体中发现了这2个SNPs位点与PD患病的危险性相关。本研究将为探讨SNCA和PARK16基因在PD发病中的作用提供有用的数据。
[1]Chaudhri KR,Buxton-Tomas M,Dhawan V,et al.Long duration asymmetrical postural treor is likely to predict development of Parkinson’s disease and not essential tremor clinical follow up study of 13 cases[J].J Neurol Neurosurg Psychiatry,2005,76(1):115 -117.
[2]Farrer MJ.Genetics of Parkinson disease:paradigm shifts and future prospects[J].Nat Rev Genet,2006,7(4):306-318.
[3]Satake W,Nakabayashi Y,Mizuta I,et al.Genomewide association study identified common variants at four loci as genetic risk factors for Parkinson’s disease[J].Nat Genet,2009,41(12):1303 -1307.
[4]Simón - Sánchez J,Schulte C,Bras JM,et al.Genomewide association study reveals genetic risk underlying Parkinson’s disease[J].Nat Genet,2009,41(12):1308 -1312.
[5]李冬辉,王 进,毛成洁,等.PARK16与苏州地区汉族人帕金森病相关性研究[J].中华医学杂志,2011,91(5):296-300.
[6]Purcell S,Neale B,Todd - Brown K,et al.PLINK:a tool set for whole-genome association and populationbased linkage analyses[J].Am J Hum Genet,2007,81(3):559-575.
[7]熊中奎,胡雅儿.α-突触核蛋白的生物学功能及其在帕金森病中的作用[J].中国病理生理杂志,2010,26(9):1855-1858.
[8]张 兰,于 顺,邢 颖,等.APP转基因拟痴呆小鼠模型脑内α-synuclein的增龄改变[J].中国病理生理杂志,2007,23(12):2289 -2294.
[9]苏敬敬,谢惠君,赵武伟,等.散发性帕金森病患者γsynuclein基因的研究[J].中华医学遗传杂志,2003,20(5):444-446.
[10]Zhao XP,Zheng HM,Xie HJ,et al.The alpha-synuclein gene microsatellite polymorphism and late-onset sporadic Parkinson's disease susceptibility[J].Zhonghua Yi Xue Yi Chuan Xue Za Zhi,2004,21(4):339 -341.
[11]Chang XL,Mao XY,Li HH,et al.Association of GWAS loci with PD in China[J].Am J Med Genet,2011,156B(3):334-339.
[12]The UK Parkinson’s Disease Consortium and The Wellcome Trust Case Control Consortium 2.Dissection of the genetics of Parkinson’s disease identifies an additional association 5'of SNCA and multiple associated haplotypes at 17q21[J].Hum Mol Genet,2011,20(2):345 -353.
[13]Mata IF,Yearout D,Alvarez V,et al.Replication of MAPT and SNCA,but not PARK16-18,as susceptibility genes for Parkinson’s disease[J].Mov Disord,2011,26(5):819-823.
[14]Ramirez A,Ziegler A,Winkler S,et al.Association of Parkinson disease to PARK16 in a Chilean sample[J].Parkinsonism Relat Disord,2011,17(1):70-71.
[15]Yan YP,Mo XY,Tian J,et al.An association between the PARK16 locus and Parkinson’s disease in a cohort from eastern China[J].Parkinsonism Relat Disord,2011,17(10):737-739.
[16]Tan EK,Kwok HK,Tan LC,et al.Analysis of GWAS-linked loci in Parkinson disease reaffirms PARK16 as a susceptibiliy locus[J].Neurology,2010,75(6):508 -512.

