心肌细胞裂解液对P19细胞向心肌细胞分化的诱导效果观察
谢丹丹,张 雷,尹 青,冯 倩
(1河北医科大学,石家庄 050017;2河北医科大学第一附属医院)
P19细胞是一种小鼠的畸胎瘤细胞,通过条件培养可分化为包括心肌细胞在内的多种细胞。实验证明P19细胞向心肌细胞分化的过程中,其细胞发育相关基因的表达及电生理学特征基本模拟了正常小鼠心肌发育过程[1]。近年来研究发现,在向心肌细胞诱导分化过程中,心肌微环境比单纯化学诱导更为重要,提示心肌细胞裂解液有可能较好的诱导P19细胞向心肌细胞分化。2011年11月~2012年2月,我们观察了心肌细胞裂解液诱导P19细胞向心肌细胞定向分化的效果。现报告如下。
1 材料与方法
1.1 动物与试剂 新生1~3 d SD大鼠,小鼠P19细胞系(本实验室保存),胎牛血清(Clark公司),新生牛血清(PAA公司),鼠抗人心肌肌钙蛋白T单克隆抗体(cTnT,Abcam公司),兔抗人连接蛋白43多克隆抗体(Cx43,中杉金桥),β-actin(Stana Cruz公司)。
1.2 P19细胞分组及处理 将复苏后传代4代以上的P19细胞,以5×105/mL密度接种在铺有低熔点琼脂糖的6孔板中培养4 d,形成细胞聚集体。常规分离SD大鼠乳鼠心肌细胞,将生长较好的原代心肌细胞制成1×106/mL的细胞悬液,迅速置于-70℃冰箱内,4~5 h后取出融化,用吸管反复吹打细胞悬液,如此反复3次后,将细胞悬液离心,取上清液过滤即为心肌细胞裂解液。心肌细胞按4×105/mL接种于含10%FBS的完全培养基中,收集每日更换所得的培养基离心,DMEM高糖培养取上清液与培养基1∶1混合,即为心肌细胞条件培养液。将聚集4 d生长较好,形态规则、大小较一致的细胞聚集体吸出,以同等数量加入心肌细胞裂解液、心肌细胞条件培养液及完全培养基中,分别为A、B、C组。待细胞贴壁后,每天更换新鲜的诱导培养液。
1.3 定向诱导效果评价
1.3.1 细胞中cTnT的检测 采用免疫组化SP法。分别取各组7、10 d的细胞爬片,用4%多聚甲醛室温固定30 min,按免疫组化SP法进行染色。一抗为cTnT抗体。以PBS代替一抗为阴性对照。细胞质内有棕黄色丝状结构者为cTnT阳性细胞。
1.3.2 cTnT、Cx43的定量检测 分别取各组7、10 d的细胞进行总蛋白提取后定量,制成凝胶上样标本,经10%的SDS-PAGE凝胶电泳分离,PVDF膜转移,cTnT(1∶1 000)和 Cx43(1∶400)进行免疫反应,电化学法显色。底片经扫描仪透扫后,用Image J软件对Western blot条带进行定量分析,以β-actin作为内参,用目的蛋白的灰度值与β-actin灰度值的比值代表目的蛋白的相对表达量。
1.4 统计学方法 采用SPSS13.0统计软件。组间比较采用χ2检验和t检验。P≤0.05为差异有统计学意义。
2 结果
P19细胞悬浮培养4 d形成球形聚集体后贴壁培养并诱导分化。A组4 d后边缘有部分细胞爬出,7 d后边缘爬出细胞体积变大,细胞核增大。10 d后体积变大的细胞增多,细胞伸展,突起长。B组有少量细胞发生变化,C组细胞无明显改变。
A、B、C组 cTnT阳性细胞率分别为 5.0%、2.4%、0,A 组 >B 组>C 组(P均 <0.05)。三组培养7、10 d细胞cTnT、Cx43相对表达量比较见表1。
表1 三组培养7、10 d细胞cTnT、Cx43相对表达量比较( ±s)
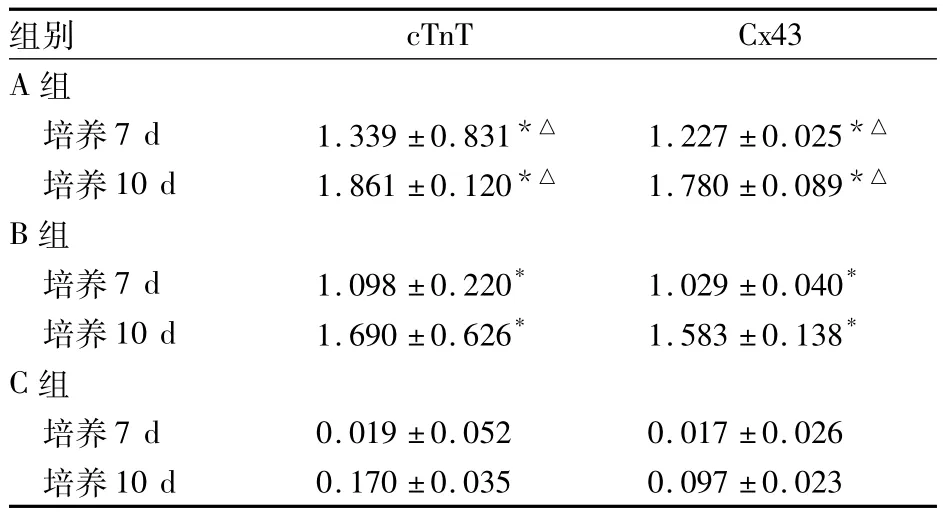
表1 三组培养7、10 d细胞cTnT、Cx43相对表达量比较( ±s)
注:与C组同一时间相比,*P<0.05;与B组同一时间相比,△P <0.05
组别cTnT Cx43 A 组培养7 d 1.339 ±0.831*△ 1.227 ±0.025*△培养10 d 1.861 ±0.120*△ 1.780 ±0.089*△B组培养7 d 1.098 ±0.220* 1.029 ±0.040*培养10 d 1.690 ±0.626* 1.583 ±0.138*C组培养7 d 0.019 ±0.052 0.017 ±0.026培养10 d 0.170 ±0.035 0.097 ±0.023
3 讨论
心肌环境对干细胞向心肌细胞的分化有重要作用。心肌环境包括体内心肌环境或体外“心肌样”环境[2]。有学者用心肌细胞裂解液和心肌细胞条件培养液分别对胚胎干细胞(ESCs)进行诱导[3],结果显示,两种方法均可在体外模拟心肌微环境[4,5],诱导ESCs向心肌样细胞分化。有学者使用催产素[6~9]联合乳鼠心肌细胞条件培养液诱导ESCs分化,结果表明,ESCs分化的心肌细胞与正常心肌细胞一样,在细胞膜上存在肾上腺素受体、胆碱能受体和Ca2+通道[10],分化的早期对异丙肾上腺素、乙酰胆碱和维拉帕米的反应性均显著高于其他实验组,分化晚期随着心肌细胞逐渐发育成熟,细胞对药物作用的反应性增强,提示心肌细胞的条件培养液可能有促进心肌细胞分化的作用[11]。本实验采用心肌细胞裂解液及心肌细胞条件培养液模拟体外心肌微环境,便于在体外对P19细胞向心肌细胞的分化进行直接而方便的实时、动态观察。
cTnT是仅存在于心肌细胞中的特异性调节蛋白,主要存在于心肌收缩单位中肌原纤维的细肌丝上。Cx43是心肌缝隙连接中的主要蛋白,Cx43阳性说明心肌细胞间具有形成闰盘结构的形态学基础[12~14]。
本实验结果显示,A组即心肌细胞裂解液组和B组即条件培养液组细胞中均有cTnT和Cx43的表达。同时,我们在实验中发现心肌细胞裂解液中P19细胞的cTnT和Cx43表达强于心肌细胞条件培养液中的细胞,提示通过反复冻融裂解所得到的心肌细胞裂解液含有一些具有诱导P19细胞向心肌细胞分化功能的物质,而这些物质在心肌细胞裂解液中的浓度比条件液中高;或是具有诱导作用的物质在正常的心肌细胞内,但不能被分泌到细胞外间隙,只有心肌细胞裂解后才能被释放[15]。实验中我们发现心肌细胞裂解液对P19细胞向心肌细胞分化具有明显的诱导作用,且实验操作性强,其诱导机制有待于进一步研究。
[1]van der Heyden MA,van Kempen MJ,Tsuji Y,et al.P19 embryonal carcinoma cells:a suitable model system for cardiac electrophysiological differentiation at the molecular and functional level[J].Cardiovasc Res,2003,58(2):410-422.
[2]欧东波,陈瑞,郑强荪.胚胎干细胞在体外模拟心肌生长环境中向心肌分化[J].现代生物医学进展,2009,9(4):622-626.
[3]李卫东,张晓刚,蒋芳萍.心肌细胞裂解液或心肌细胞对胚胎干细胞定向分化的诱导作用[J].中华心血管病杂志,2006,36(5):540.
[4]Graichen R,Xu X,Braam SR,et al.Enhanced cardiomyogenesis of human embryonic stem cells by a small molecular inhibitor of p38 MAPK[J].Differentiation,2008,76(4):357-370.
[5]Singla DK,Hacker TA,Ma L,et al.Transplantation of embryonic stem cells into the infarcted mouse heart:formation of multiple cell types[J].J Mol Cell Cardiol,2006,40(1):195-200.
[6]Jankowski M,Danalache B,Wang D,et al.Oxytocin in cardiac ontogeny[ J] .Proc Nat l Acad Sci USA,2004,101(35):130742-130791.
[7]Paquin J,Danalache BA,Jankowski M,et al.Oxytocin induces different iation of P19 emb ryon ic stem cel ls to card iom yocytes[J].Proc Natl Acad Sci USA,2002,99(14):9550-9555.
[8]Katsuhisa M,Toshio N,Nobuhiro N,et al.Adult cardiacscal-positive cells differentiate into beating cardiomyocytes[J].J Biol Chem,2004,279(12):11384-11391.
[9]陈炜,尹青,张雷.催产素诱导P19细胞分化为心肌细胞的作用[J].解剖学报,2008,4(39):611-613.
[10]Snir M,Kehat I,Gepstein A,et al.Assessm ent of the ultrastructural and proliferative properties of human embryonic stem cell derived cardiomyocytes[J].Am J Physiol Heart Circ Physiol,2003,285(6):2355-2363.
[11]滕继伟,郑强荪,欧东波.催产素联合乳鼠心肌细胞条件培养液诱导胚胎干细胞分化的作用[J].心脏杂志,2010,22(4):500-505.
[12]Jongsma HJ,Wilders R.Gap junction in cardiovascular disease[J].Circ Res,2000,86(12):1193-1197.
[13]Chen P,Huang GY,Chang C,et al.Spat io temporal expression of CX43 in the developing humanand mouse hearts[J].Acta Lab An Sci Sinica,2005,13(1):16-19.
[14]陈萍,黄国英,常才,等.Cx43基因在人类及小鼠胎心发育中的时空表达规律[J].中国实验动物学报,2005,13(1):16-19.
[15]袁岩,陈连凤,张抒扬.心肌微环境对骨髓间充质干细胞的诱导分化作用[J].中国介入心脏病学杂志,2005,13(5):315-318.

