多层螺旋CT检查在睾丸原发肿瘤诊断中的应用
(河北大学附属医院,河北保定 071000)
睾丸肿瘤在临床上相对少见,且大多数为恶性。多层螺旋CT扫描速度快,空间分辨率高,对发现睾丸肿瘤内部病变有一定价值。2008年1月~2012年2月,我们对25例睾丸肿瘤患者的CT资料进行回顾性分析,探讨多层螺旋CT检查在睾丸原发肿瘤诊断中的意义。
1 资料与方法
睾丸肿瘤患者25例,年龄10个月~73岁,平均32.3岁。均为单侧发病,其中2例有隐睾史。均为睾丸渐进性增大。6例伴有睾丸疼痛,4例由于腹膜后转移压迫输尿管而出现泌尿系梗阻肾脏积水表现,2例伴肺、纵隔等全身多发转移。查体睾丸肿大,呈圆形或类圆形,压痛不明显,病变边界较清,阴囊皮肤无溃疡及窦道形成。肿瘤位于左侧14例,右侧11例。其中精原细胞瘤13例,畸胎瘤4例(成熟畸胎瘤3例,未成熟畸胎瘤1例),混合性生殖细胞瘤3例,胚胎性癌2例,内胚窦瘤1例,含有生殖细胞和性索/性间质成分混合性肿瘤1例,间质细胞瘤1例;伴有鞘膜积液5例。血清学检查:甲胎蛋白(AFP)升高8例,人绒毛膜促性腺激素(β-HCG)升高9例,乳酸脱氢酶(LDH)升高4例。采用Simens Sensation 64排多层螺旋CT行下腹及盆腔扫描。其中行CT平扫和动态增强扫描21例,仅平扫4例。增强扫描时采用非离子型对比剂行动脉期(20~30 s)及静脉期(60~70 s)扫描,多方位、多平面重组(MPR)。
2 结果分析
13例睾丸精原细胞瘤患者年龄23~73岁,平均年龄38.7岁,其中1例有隐睾史。左侧6例,右侧7例,肿瘤直径3.5~9 cm。CT平扫表现为阴囊内类圆形或椭圆形软组织密度肿块,边界清楚,呈等或略低密度影。7例平扫密度较均匀(见图1),6例密度不均(见图2),均未见钙化影,其中3例伴有鞘膜积液;增强扫描示12例病变呈轻度强化(见图1、2),CT值增加8~22 HU,4例呈分隔样强化,6例病变内坏死区无强化,1例肿块内见明显迂曲强化的血管影;5例有腹膜后或盆腔淋巴结转移,其中2例腹膜后淋巴结转移压迫输尿管致肾脏积水(见图3)。2例β-HCG升高,2例LDH升高,1例两者同时升高。
4例睾丸畸胎瘤患者年龄10个月~25岁,其中2例为儿童。良性3例,恶性1例;左侧3例,右侧1例。肿瘤直径为2.5~7 cm。CT平扫为高低混杂密度影,3例良性畸胎瘤病变内均可见点状或弧形钙化(见图4),其中1例成熟型畸胎瘤病变内见脂肪密度影,2例病变内见囊性成分为主的混杂密度,其内有分隔;1例恶性畸胎瘤呈不均匀等低密度类圆形肿块,内有囊变坏死区,未见钙化,且伴有鞘膜积液。2例良性畸胎瘤增强扫描示囊壁、分隔及实性成分呈轻度强化。
3例混合性生殖细胞瘤患者年龄分别为19、27、56岁。肿瘤位于左侧2例,右侧1例,最大者直径约5 cm。CT平扫为类圆形混杂密度肿块,内见多发小囊状改变,其中1例有点状钙化。增强扫描肿块实性成分不均匀较明显强化,囊壁呈环状强化,囊内无强化(见图5)。1例胸腹部CT检查示双肺、纵隔、腹膜后多发转移。3例AFP及β-HCG升高,其中2例两项同时升高,1例LDH升高。
2例左侧睾丸胚胎癌患者中,1例有隐睾史,患者年龄分别为17、41岁。肿瘤最大直径约4.5 cm。CT平扫为混杂密度囊实性肿块,1例伴有鞘膜积液。增强扫描后实性成分呈斑片状明显强化(见图6),1例颈胸腹部及盆腔CT检查示颈部、双肺、纵隔、肾上腺转移、腹膜后、腹股沟等多发转移。2例AFP及β-HCG同时升高,其中1例LDH升高。
1例右侧睾丸内胚窦瘤患者40岁,肿块直径9 cm,边界清楚,平扫呈囊实性椭圆形肿块,可见多发大小不等的囊状低密度区,增强扫描呈不均匀强化,可见点状及斑片状明显强化,囊壁环状强化,囊内无强化,伴鞘膜积液(见图7)。AFP水平升高。
1例右侧睾丸间质瘤患者40岁,平扫睾丸内见直径约1.9 cm的略高密度结节,边界较清楚,内有多发点状钙化灶,增强扫描肿块内结节呈明显强化(见图8)。血清AFP及β-HCG水平均未见异常。
1例左侧含有生殖细胞和性索/性间质成分混合性肿瘤患儿1岁,病变直径约3.5 cm,伴有阴囊皮下组织转移,CT平扫表现为均匀等密度类圆形肿块(见图9),血清学AFP及β-HCG均同时升高。

图1 右睾丸精原细胞瘤

图2 右睾丸精原细胞瘤
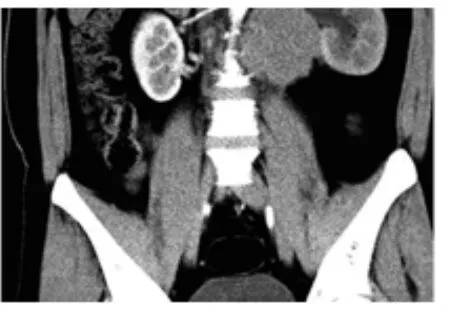
图3 左睾丸精原细胞瘤腹膜后淋巴结转移、肾脏积水
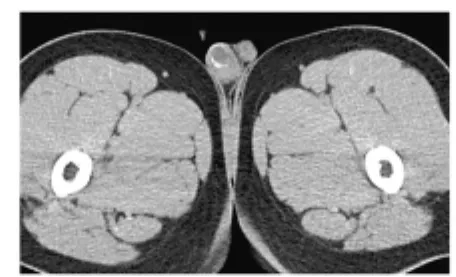
图4 右睾丸畸胎瘤
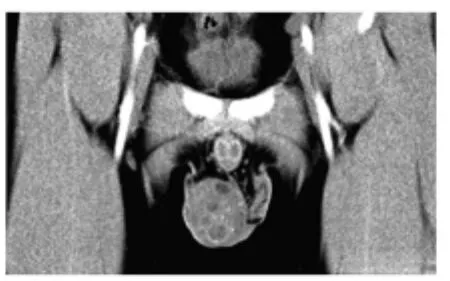
图5 右睾丸混合性生殖细胞肿瘤

图6 左睾丸胚胎癌

图7 右睾丸卵黄囊瘤
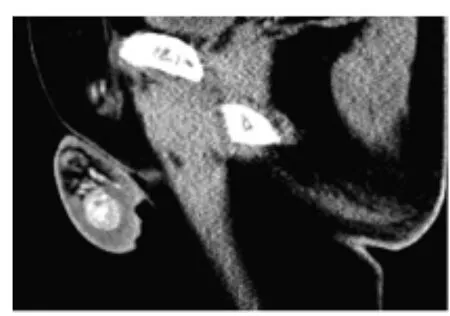
图8 右睾丸间质细胞瘤

图9 左侧含有生殖细胞和性索/性间质成分混合性肿瘤
3 讨论
睾丸肿瘤组织学上分为生殖细胞源性肿瘤和非生殖细胞源性肿瘤两大类[1]。90%以上的原发性睾丸肿瘤来源于生殖细胞肿瘤[2],非生殖细胞源性肿瘤包括起源于睾丸肿瘤性索和性间质的肿瘤、淋巴瘤、睾丸胚胎性横纹肌肉瘤和转移瘤等少见。睾丸肿瘤临床上常用的肿瘤标记物有AFP、β-HCG、LDH。其中血清AFP升高多见于混合性生殖细胞肿瘤和内胚窦瘤;β-HCG增高常见于绒毛膜上皮癌、精原细胞瘤等;LDH增高往往提示病情进展或治疗后复发[3]。
精原细胞瘤是最常见的睾丸生殖细胞源性肿瘤之一[4]。本组精原细胞瘤共13例(52%)。其 CT表现为平扫呈等低密度软组织肿块,边界较清楚,大部分病变密度相对均匀,少部分肿瘤内中心或边缘可见囊变坏死。少数病例可见钙化[5],增强扫描呈轻中度强化,分隔样强化有一定影像学特征[6]。本组13例精原细胞瘤中,6例肿瘤内见囊变坏死,按肿瘤生长一般规律,肿瘤越大,发生坏死的可能性越大。囊变坏死区位于肿瘤中心或边缘,占据肿瘤的范围相对较小。精原细胞瘤易经淋巴系统转移,以腹膜后及盆腔多见,本组5例有腹膜后或盆腔淋巴结转移。少数患者血清β-HCG升高。
睾丸畸胎瘤多见于儿童,且大多数为良性。其典型CT表现为密度不均匀的囊实性肿块影,囊壁厚薄不均,可见弧形钙化及分隔,脂肪成分CT值呈负值,肿瘤CT表现呈不规则钙化。增强扫描肿块囊壁、分隔及实性成分呈轻度强化,囊内液体及脂肪成分无强化。恶性畸胎瘤体积往往较大,CT显示以实性成分为主的软组织密度肿块,内见低密度坏死区,伴或不伴有钙化,出现远处转移提示恶性。本组3例良性畸胎瘤均有点状或弧形钙化,其中1例见脂肪密度,故肿块内见到钙化及脂肪成分常被认为是畸胎瘤的特征性表现。
胚胎癌及内胚窦瘤均为少见的高度恶性的生殖细胞源性睾丸肿瘤。早期即可经淋巴结或血道转移。前者常发生于25~35岁男性[7],肿瘤体积往往较精原细胞瘤小,易直接侵犯白膜、附睾及精索,肿瘤内可有出血坏死。后者又称卵黄囊瘤,多见于青春期前儿童,儿童及成人均可发病。胚胎癌及内胚窦瘤CT平扫均可表现为混杂密度囊实性肿块,内有囊变坏死,胚胎癌增强扫描示肿块实性成分呈斑片状或结节状明显强化,其中内胚窦瘤平扫密度多表现为不均匀,增强扫描肿块内实性成分及囊壁均呈不均匀较明显强化,囊内无强化,伴或不伴有鞘膜积液。二者血供丰富,故强化程度高,患者血清AFP及β-HCG一项或两项升高。
睾丸混合性生殖细胞肿瘤的发生率仅次于精原细胞瘤[2,7],常发生于青壮年男性,肿瘤内囊变、坏死及出血常见[8]。CT平扫表现为一侧阴囊内类圆形囊实性肿块,密度多不均匀,增强后实性成分及囊壁强化,实性成分呈明显结节状及斑片状强化,囊变坏死区无强化。
睾丸间质瘤是睾丸性索/性间质肿瘤的一种相对常见的组织类型,可单独发生,亦可与生殖细胞肿瘤或其他性索间质肿瘤混合存在,儿童与成人均可发病,大多数为良性[9],10% ~ 20% 为恶性[10]。患者多因不育或睾丸肿大而就诊,儿童可出现性早熟,成人可有乳房发育或性欲低下,亦可无任何症状。AFP及β-HCG无异常。有学者报道[9]睾丸间质瘤CT影像学表现肿瘤为高密度、边界清楚的结节或肿块,小体积的肿瘤密度可均匀,体积较大的肿瘤密度可不均匀,伴或不伴有灶状钙化,增强扫描均有强化。本组1例睾丸间质瘤CT表现与文献报道相符。含有生殖细胞和性索/性间质成分混合性肿瘤极少见,多种单纯的生殖细胞瘤,CT表现不完全相同,且睾丸性索/性间质类肿瘤与生殖细胞瘤影像表现亦有区别。本组1例CT平扫呈密度均匀的略高密度影,由于患儿年龄小,未做增强扫描,有待以后收集更多的病例来总结。
不同类型睾丸原发肿瘤的鉴别诊断:睾丸精原细胞瘤与非精原细胞瘤CT表现有所不同,前者多为边界清楚,密度均匀或不均匀的软组织密度肿块,极少有钙化,不均匀者其内见囊变坏死,囊变区域相对局限,增强扫描呈不均匀轻度强化或强化不明显。后者中畸胎瘤肿瘤内常见到脂肪成分或钙化影,且强化程度较轻,但对于无脂肪成分及钙化的畸胎瘤,表现为密度均匀或不均匀,与其他类型肿瘤较难区分。内胚窦瘤、胚胎癌及混合性生殖细胞瘤均可表现为边界清楚、密度不均匀的软组织肿块,平扫密度多表现为不均匀,其中内胚窦瘤的囊变坏死区较精原细胞瘤更多、更广泛,三者增强扫描肿块均可见结节状或斑片状明显不均匀强化,且在血清学检测中,往往AFP及β-HCG一项升高或两项同时升高。笔者认为鉴别诊断可结合患者年龄及血清学检查:如为青春期前儿童,肿瘤内见脂肪成分或钙化影,则考虑畸胎瘤;如儿童睾丸肿瘤内密度多不均匀,增强后明显不均匀强化,且AFP升高,则内胚窦瘤可能性大;如为中青年患者,肿瘤密度相对均匀,则精原细胞瘤可能性大;若肿瘤平扫密度多表现不均匀,增强呈明显不均匀强化,且血清AFP及β-HCG一项或两项升高,非精原细胞瘤可能性大,胚胎细胞癌、卵黄囊瘤或恶性混合性生殖细胞肿瘤等均有可能;如成年男性为女性型乳房,伴性欲低下,CT发现睾丸内高密度结节或肿块,且明显强化,AFP及β-HCG不高,不排除睾丸间质细胞瘤的可能。
综上所述,不同类型睾丸肿瘤CT征象存在相似和重叠现象,诊断需结合多种影像学检查及血清学检测,确诊需病理证实。多层螺旋CT能显示睾丸肿瘤本身的影像学特征,亦可显示淋巴结及远处转移情况,有助于诊断和鉴别诊断,可为肿瘤分期、临床制定治疗方案提供参考。
[1]Nichols CR.Testicular cancer[J].Curr Probl Cancer,1998,22(4):187-274.
[2]Bahrami A,Ro JY,Ayala AG.An overview of testicular germ cell tumors[J].Arch Pathol Lab Med,2007,131(8):1267-1280.
[3]Pohl HG,Shukla AR,Metcalf PD,et al.Prepubertal testis tumors:actual prevalence rate of histological types[J].J Urop,2004,172(6):2370-2372.
[4]Woodward PJ,Sohaey R,O'Donoghue MJ,et al.From the archive of the AFIP:tumors and tumorlike lesions of the testis:radiologicpathologic correlation.[J].Radiographics,2002,22(1):189-216.
[5]文戈,郁冰冰,李颖嘉,等.睾丸肿瘤的CT诊断价值[J].临床放射性杂志,2009,28(8):1105-1108.
[6]董丽卿,陈伟建,孔祥泉,等.睾丸精原细胞瘤的MSCT诊断[J].放射学实践,2006,21(7):702-705.
[7]郭永梅,刘真,江新青,等.睾丸非精原类生殖细胞瘤的MSCT表现与组织病理对照[J].放射学实践,2011,26(9):978-980.
[8]陈建,杜双存,郭瑞峰,等.睾丸混合性生殖细胞肿瘤1例[J].中华病理学杂志,2003,32(5):488.
[9]韩苏军,李长岭.睾丸Leydig细胞瘤5例报告并文献复习[J].现代泌尿生殖肿瘤杂志,2011,3(2):86-88.
[10]Jou P,Maclennan GT.Leydig cell tumors of the testis[J].J Urop,2009,181(5):2299-2300.

