阿伐他汀联合还原型谷胱甘肽对高血压大鼠肾损害的影响
(辽宁医学院附属第一医院,辽宁锦州 121001)
肾脏是高血压病的重要靶器官之一,目前研究表明高血压与动脉粥样硬化共同导致炎症的病理生理过程是高血压肾损害的主要原因[1]。他汀类药物具有肯定的降脂作用,还原型谷胱甘肽具有明显的抗炎作用,而其对高血压肾损害的治疗作用尚无报道[2,3]。1990年9月 ~ 2012年4月,本研究采用阿伐他汀联合还原型谷胱甘肽干预自发性高血压(SHR)大鼠,观察其对大鼠肾损害的治疗效果并探讨其机制。现报告如下。
1 材料与方法
1.1 实验动物及试剂 SPF级8周龄SHR雄性大鼠32只,体质量 250~300 g,8只 Wistar-Kyoto(WKY)大鼠作为对照组,体质量250~300 g,均由辽宁医学院实验动物中心赠予。Trizol试剂购自Sigma-Aldich公司;Trizol试剂、RT-PCR试剂盒、Marker等均购自TaKaRa公司,抗体购自美国Santa Cruz公司;过氧化物酶增殖物激活受体γ(PPARγ)引物正链5'-GAGATGCCATTCTGCCCCACCAACTTCGG-3',负 链 5'-TATCATAAATAAGCTTCAATCGGATGGTTC-3';转化生长因子(TGF)-β1引物正链5'-TGGCGTTACCTTGGTAACC-3',负链 5'-GGTGTTGAGCCCTTTCCAG-3',由TaKaRa公司设计。超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒购于南京建成生物工程研究所;PCR扩增仪购自德国Biometra公司;GIS凝胶图像分析系统(上海天能科技有限公司);酶标仪Spectra Max190(美国Molecular Devices公司);分光光度计UV-1700(日本Shimadzu公司)。其他试剂为国产分析纯。
1.2 实验动物分组及处理 将32只SHR大鼠随机分为联合组、阿伐他汀组、谷胱甘肽组、模型组,各8只,以8只同周龄的WKY大鼠为对照组。将两种药物溶于蒸馏水中灌胃给药,阿伐他汀组、谷胱甘肽组分别给予阿伐他汀20 mg/mL、还原型谷胱甘肽200 mg/(kg·d)灌胃,联合组两药合用。模型组及对照组大鼠每日按10 mL/kg蒸馏水灌胃,于给药6周后腹腔注射40 mg/kg戊巴比妥钠麻醉,颈椎脱臼处死,取出肾脏组织液氮速冻后-80℃保存。
1.3 大鼠肾脏组织中SOD、MDA的检测 各组取大鼠冻存肾脏组织约100 mg,采用黄嘌呤氧化酶法测定SOD,用分光光度计测550 nm处的吸光度;采用硫代巴比妥酸法测定MDA,用分光光度计测532 nm处吸光度。
1.4 大鼠肾脏组织中 PPARγ、TGF-β1 mRNA的检测 采用RT-PCR法。取各组大鼠冻存肾脏组织约100 mg,按Trizol试剂使用说明提取总 RNA。PCR反应条件为:95℃预变性10 min,94℃变性1 min,60℃退火1 min,72℃延伸2 min,30个循环之后,72℃延伸8 min。PCR产物在琼脂糖凝胶中电泳分离,紫外分析仪观察后摄片。Lab Works软件进行凝胶成像分析,测定阳性电泳条带的平均灰度值,计算各样本目的基因与β-actin电泳条带的平均灰度值比,作为其相对表达量。
1.5 统计学方法 采用SPSS17.0统计学软件。计量资料以±s表示,组间比较采用t检验,多组比较采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 各组大鼠肾脏SOD活性、MDA水平比较 见表1。与模型组相比,联合组、阿伐他汀组及谷胱甘肽组MDA水平明显减少、联合组最低(P均<0.05)。与模型组相比,联合组、阿伐他汀组及谷胱甘肽组SOD活性明显升高、联合组最高(P均<0.05)。
表1 各组大鼠肾脏SOD活性、MDA水平比较(±s)

表1 各组大鼠肾脏SOD活性、MDA水平比较(±s)
注:与模型组相比,*P <0.05;与联合组相比,▲P <0.05
组别 MDA(nmol/mg) SOD(U/mg)联合组 9.337 ±0.254* 292.561 ±15.063*阿伐他汀组 13.824±0.457*▲ 264.259± 9.226*▲谷胱甘肽组 14.296±0.394*▲ 271.167±10.851*▲模型组 21.876 ±0.597 193.110 ± 7.545对照组 15.130 ±0.210* 299.910 ±14.582*
2.2 各组肾脏组织中PPARγ、TGF-β1 mRNA表达比较 见表2、图1。模型组PPARγ mRNA表达量接近对照组,差异无统计学意义(P>0.05)。与模型组相比,联合组PPARγ mRNA表达量上调(P均<0.05),阿伐他汀组与谷胱甘肽组相近(P>0.05)。模型组TGF-β1 mRNA表达量明显高于对照组(P<0.05),联合组 TGF-β1 mRNA 表达量低于对照组外的各组(P均<0.05)。
表2 各组肾脏组织中PPARγ、TGF-β1 mRNA相对表达量比较(±s)
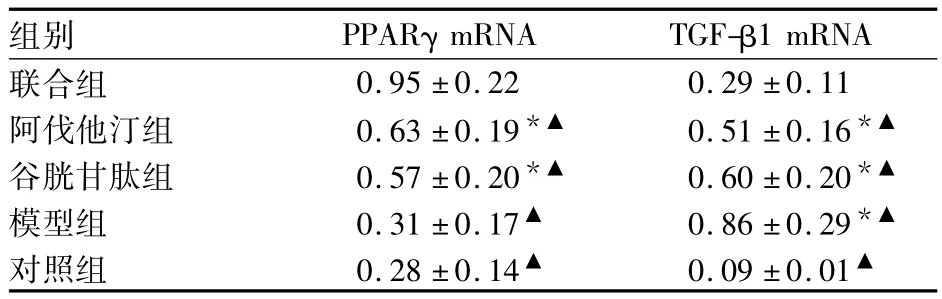
表2 各组肾脏组织中PPARγ、TGF-β1 mRNA相对表达量比较(±s)
注:与联合组相比,▲P <0.05;与对照组相比,*P <0.05
组别 PPARγ mRNA TGF-β1 mRNA联合组0.95 ±0.22 0.29 ±0.11阿伐他汀组 0.63±0.19*▲ 0.51±0.16*▲谷胱甘肽组 0.57±0.20*▲ 0.60±0.20*▲模型组 0.31±0.17▲ 0.86±0.29*▲对照组 0.28±0.14▲ 0.09±0.01▲

图1 各组肾脏组织中PPARγ、TGF-β1 mRNA的相对表达量
3 讨论
高血压对肾脏的损害主要是由动脉粥样硬化引起的肾小球及肾小管病理改变,表现为尿微量白蛋白、血肌酐及尿素氮水平升高,进一步发展为尿毒症[4]。还原型谷胱甘肽是重要的小分子抗氧化和自由基清除剂,它可提供活性巯基,中和氧自由基,避免ROS和氧自由基产生过氧化脂质,减轻自由基对肾脏组织的损害。阿伐他汀目前被用为降脂药物,具有调脂及抗炎作用[5]。
炎症是高血压和动脉硬化共同的病理生理机制,其中TGF-β1是与动脉粥样硬化发生、发展有关的促炎因子[6]。TGF-β1可刺激单核巨噬细胞、成纤维细胞和肾血管上皮合成胶原及蛋白多糖,促进纤溶酶原激活物因子和金属蛋白酶组织抑制因子的表达,促进整合素表达进而增强细胞质相互作用,导致肾小球和肾小管细胞外基质进行性沉积[7]。TGF-β1可反映高血压肾病的严重程度,可作为其疾病进展标记物[8]。研究表明,PPARγ可在炎症反应中起到重要的保护作用。PPARγ能与氧化配体结合,减少细胞内反应性氧化产物产生[9]。
多项研究发现,SOD属于机体内对抗自由基的酶促体系,生理状态下SOD可有效清除超氧自由基的内源性金属离子,通过其他抗氧化物质的协同作用,保护细胞膜和大分子不受氧自由基的攻击[10]。SOD活性间接反映运动中自由基的平衡状态与体内的物质代谢情况。而MDA是机体脂质过氧化反应中的代谢产物之一,其水平可反映机体脂质过氧化程度,间接反映细胞的损伤情况[11,12]。
他汀类药物的降脂作用早已在大量的实验研究和临床实践中得到了公认,而且不断有学者发现他汀类药物还有很多独立于其降脂作用的效果,即“他汀类药物的多效性”,包括改善内皮功能、稳定动脉硬化斑块、抑制细胞迁移和增生、减轻炎症和氧化应激等作用[13,14]。还原型谷胱甘肽可抑制炎症细胞因子如DTNF、IL-6、IL-8、巨噬细胞炎症蛋白(MIP)-2、单核细胞趋化蛋白(MCP)-1的产生与合成;不但能有效地控制氧化应激状态,还能通过抑制多种炎症因子的活化产生抗炎效应;还原型谷胱甘肽及其前体还可作为自由基清除剂,减少TNF-α介导的细胞过氧化损伤,减轻对内皮细胞通透性损害[15,16]。
本研究结果显示,与模型组相比,联合组、阿伐他汀组及谷胱甘肽组大鼠肾脏组织SOD活性明显升高,且联合组明显高于两个单药组;联合组、阿伐他汀组及谷胱甘肽组MDA水平低于模型组,且联合组明显低于两个单药组;联合组肾脏组织中PPARγ mRNA 的表达量高于、TGF-β1 mRNA 表达量低于两个单药组及模型组,说明阿伐他汀联合还原型谷胱甘肽干预治疗能够有效抑制高血压对SHR大鼠肾脏的损害作用,较单独用药效果显著,这可能是通过上调PPARγ mRNA表达、下调TGF-β1 mRNA表达来实现的。
[1]Moon JY.ACE2 and Angiotensin-(1-7)in hypertensive renal disease[J].Electrolyte Blood Press,2011,9(2):41-44.
[2]Yamaleyeva LM,Gilliam-Davis S,Almeida I,et al.Differential regulation of circulating and renal ACE2 and ACE in hypertensive.lewis rats with early onset diabetes[J].Am J Physiol Renal Physiol,2012,302(11):1374-1384.
[3] Subramanian V,Golledge J,Heywood EB,et al.Regulation of peroxisome proliferator-activated receptor-γ by angiotensin II via transforming growth factor-β1-activated p38 mitogen-activated protein kinase in aortic smooth muscle cells[J].Arterioscler Thromb Vasc Biol,2012,32(2):397-405.
[4]Zhang T,Wang F,Xu HX,et al.Activation of nuclear factor erythroid 2-related factor 2 and PPARγ plays a role in the genisteinmediated attenuation of oxidative stress-induced endothelial cell injury[J].Br J Nutr,2012,3(2):1-13.
[5]Wang J,Xu J,Zhou C,et al.Improvement of arterial stiffness by reducing oxidative stress damage in elderly months of atorvastatin therapy.hypertensive patients after 6 months of atorvastain therapy[J].J Clin Hypertens(Greenwich),2012,14(4):245-249.
[6]Lee BJ,Lee HS,Kim CD,et al.The Effects of combined treatment with an HMG-CoA reductase inhibitor and PPARγ agonist on the activation of rat pancreatic stellate cells[J].Gut Liver,2012 ,6(2):262-269.
[7]Tanigai T,Ueki S,Kihara J,et al.Docosahexaenoic acid exerts anti-Inflammatory action on human eosinophils through peroxisome proliferator-activated receptor-independent mechanisms[J].Int Arch Allergy Immunol,2012,158(4):375-386.
[8]Kuwashiro S,Terai S,Oishi T,et al.Telmisartan improves nonalcoholic steatohepatitis in medaka(Oryzias latipes)by reducing macrophage infiltration and fat accumulation[J].Cell Tissue Res,2011,344(1):125-134.
[9]Shi L,Mao C,Xu Z,et al.Angiotensin-converting enzymes and drug discovery in cardiovascular diseases[J].Drug Discov Today,2010,15(9-10):332-341.
[10]Zhao Q,Hixson JE,Rao DC,et al.Genetic variants in the apelin system and blood pressure responses to dietary sodium interventions:a family-based association study[J].J Hypertens,2010,28(4):756-763.
[11]Senador D,Key M,Brosnihan KB,et al.Cardiovascular interactions between losartan and fructose in mice[J].J Cardiovasc Pharmacol Ther,2010,15(1):68-77.
[12]沈健,智睿,杨素萍.还原型谷胱甘肽对高血压脑出血患者肾功能的影响[J].中国现代药物应用,2008,4(2):34-35.
[13]Wysocki J,Ye M,Rodriguez E,et al.Targeting the degradation of angiotensin II with recombinant angiotensin-converting enzyme 2:prevention of angiotensin II-dependent hypertension[J].Hypertension,2010 ,55(1):90-98.
[14]Varagic J,Ahmad S,Brosnihan KB,et al.Decreased cardiac Ang(1-7)is associated with salt-induced cardiac remodeling and dysfunction[J].Ther Adv Cardiovasc Dis,2010,4(1):17-25.
[15]Zulli A,Burrell LM,Buxton BF,et al.ACE2 and AT4R are present in diseased human blood vessels[J].Eur J Histochem,2008 ,52(1):39-44.
[16]Igase M,Kohara K,Nagai T,et al.Increased expression of angiotensin converting enzyme 2 in conjunction with reduction of neointima by angiotensin Ⅱ type 1 receptor blockade[J].Hypertens Res,2008,31(3):553-559.

