虾青素抗肝肿瘤生长的实验研究
陈立武 曾维铨
1.福建省第二人民医院普外科,福建 福州 350002;2.福建省第二人民医院二化分院外科,福建 福州 350003
近年来,在环境及社会因素的影响下,恶性肿瘤的发病率越来越高,如何降低恶性肿瘤的发病率及致死率,仍然是人类面临的重大课题。随着对抗肿瘤药物研究的深入,类胡萝卜素类化合物的天然抗氧化、抗肿瘤活性越来越引起人们的广泛关注[1]。虾青素是一种最早发现于藻类、甲壳类动物及鱼等海洋生物体内的一种叶黄素类胡萝卜素[2],是迄今为止人类发现的自然界最强的抗氧化剂之一,其清除自由基的能力是天然维生素E的1 000倍,是天然β-胡萝卜素的10倍,是番茄红素的7倍。虾青素是唯一能通过血脑屏障的类胡萝卜素[3]。虾青素有许多强大的药理功能,如抗氧化、抗炎及增强机体免疫活性等,而上述药理作用都可能产生抑制恶性肿瘤生长的功效。本研究旨在探讨虾青素抗肝肿瘤生长的作用及其可能的作用机制,以期为今后虾青素的临床抗肿瘤应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 选择6~8周雌性体重为18~24 g的C57BL/6(H-2b)小鼠24只,购自北京维通利华公司(动物合格证号为 SCXK(京):2006-0010)。
1.1.2 试剂 台盼蓝购于美国Sigma公司,LDH试剂盒购于瑞士罗氏公司,DMEM培养基购于美国Gibco公司,1640培养基购于美国Gibco公司。
1.2 方法
1.2.1 种植肿瘤、分组及肿瘤大小测定 将Hepa 1-6肝癌细胞(2×106个)接种于C57BL/6小鼠右腋皮下,将24只小鼠随机分为4组,即对照组、虾青素低剂量组(10 mg/kg)、虾青素中剂量组(30 mg/kg)和虾青素高剂量组(60 mg/kg),每组各6只,肿瘤生长至第5天时,按照分组剂量腹腔注射虾青素,对照组注射同体积的生理盐水。种瘤后,每3天观察小鼠肿瘤的生长情况,用游标卡尺测量小鼠肿瘤的长径和短径,并计算肿瘤体积。肿瘤体积(V)=肿瘤长径×肿瘤短径/2。
1.2.2 淋巴细胞数测定 给药后1、7、15 d麻醉处死各组小鼠,每组5只,75%酒精浸泡5 min,超净台内取小鼠脾脏,制成单细胞悬液,加入红细胞裂解液溶解红细胞,1 000 r/min离心10 min,去上清,再用PBS重悬细胞,洗涤3遍,沉淀为脾淋巴细胞,用PBS重新悬浮细胞,台盼蓝染色,计数细胞。
1.2.3 淋巴细胞杀伤能力测定 给药7 d后,制备小鼠脾细胞悬液作为效应细胞(E)备用。Hepa 1-6细胞经30 Gy照射后,作为靶细胞(T)备用。效应细胞∶靶细胞(E∶T)分别按照 15∶1、30∶1 及 60∶1 混合, 按 100 μL/孔加入培养板的相应孔内,无靶细胞组加入100 μL含有10%FBS的1640培养基。LDH法检测各组小鼠淋巴细胞的杀伤能力。特异性杀伤率按以下公式计算:特异性杀伤率(%)=[(实验组释放-实验组自发释放-靶细胞自发释放)/(靶细胞最大释放-靶细胞自发释放)]×100%。
1.3 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,组间差异比较采用单因素方差分析,两两比较采用Tukey post-hoc检验,以双尾P<0.05为差异有统计学意义。
2 结果
2.1 不同剂量虾青素对肿瘤生长的抑制情况
C57BL/6小鼠接种Hepa 1-6细胞3~4 d后,肿瘤开始长出,全部小鼠腋下均可触及肿瘤,成瘤率为100%,肿瘤生长速度较均匀。四组小鼠中,对照组肿瘤生长速度最快,在接种Hepa 1-6肿瘤细胞第20天,对照组、虾青素低、中、高剂量组的肿瘤平均体积均明显增大,且对照组与低、中、高组比较,差异均有统计学意义(P<0.05或P<0.01);虾青素中、高剂量组间差异无统计学意义。见图1。
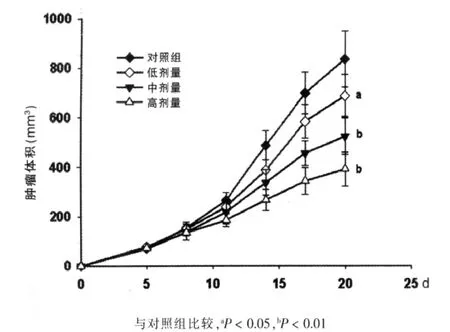
图1 荷瘤小鼠肿瘤体积变化情况
2.2 不同剂量虾青素对小鼠体内脾细胞数量的影响
种植肿瘤后,随着肿瘤的生长,对照组小鼠脾细胞数量呈下降趋势,而不同剂量虾青素组均可以抑制脾细胞数量的减少,且虾青素中、高剂量组对淋巴细胞减少的抑制作用更为显著,可抑制小鼠免疫状态的降低,在给药后第15天,与对照组比较,虾青素中、高剂量组脾细胞数显著升高,差异有统计学意义(P<0.05)。见图2。
2.3 不同剂量虾青素对淋巴细胞杀伤能力的影响
将C57BL/6来源的淋巴细胞和肿瘤细胞进行混合培养(MLTC)后,采用LDH法检测给药后第10天各组小鼠淋巴细胞对Hepa 1-6肝癌细胞的杀伤活性。结果显示,输注虾青素后,可以提高淋巴细胞对肿瘤细胞的杀伤活性,且呈剂量依赖趋势,并且在不同的E∶T情况下,均可以观察到该现象,见图3。

图2 荷瘤小鼠小鼠体内脾细胞数变化情况
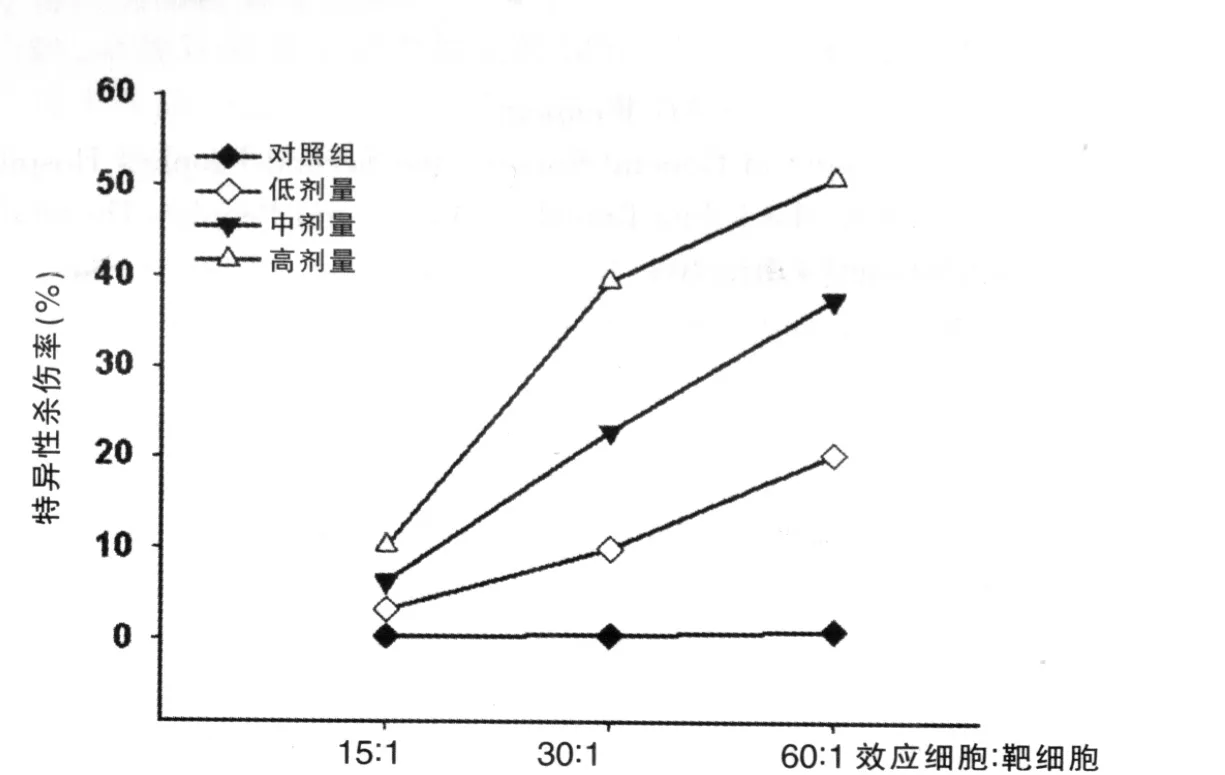
图3 不同剂量虾青素对淋巴细胞杀伤能力的影响
3 讨论
本研究通过构建Hepa 1-6肝肿瘤小鼠模型,观察虾青素对肿瘤生长的抑制作用,并探讨相应机制。研究结果显示,腹腔注射虾青素能够显著降低肝肿瘤的体积,同时,虾青素能够显著增加荷瘤小鼠的脾细胞数量,并明显增强荷瘤小鼠的淋巴细胞对肿瘤细胞的杀伤活性。
近年来,随着虾青素消费市场的不断扩展,围绕其预防及治疗疾病的效应及潜在机理的探索性研究正在不断深入。为了观察虾青素对肝肿瘤生长的抑制作用,笔者采用小鼠肝癌细胞株Hepa 1-6来构建荷瘤小鼠模型。Hepa 1-6是国内外肿瘤研究中最常用的稳定细胞株之一[4]。本研究将Hepa 1-6细胞接种于CB6F1小鼠皮下后,观察到Hepa 1-6细胞在CB6F1小鼠体内生长迅速,且各组肿瘤生长速度基本一致,证明模型构建成功。
模型构建成功后,笔者观察了虾青素对肝细胞肿瘤生长的抑制作用,结果显示,在应用虾青素第20天时,虾青素能够剂量依赖性的抑制肝肿瘤的生长。在国内外同类研究中也有类似发现,如Zhang等[5]发现,虾青素能够显著抑制K562肿瘤细胞的增殖;而裴凌鹏[6]研究发现,虾青素能够显著抑制S180肉瘤荷瘤小鼠的肿瘤生长。上述研究与本研究结果一致,均证明虾青素具有显著的抑制肿瘤生长的作用。
笔者进一步探讨了虾青素抑制肝肿瘤细胞生长的相关机制。研究结果显示,虾青素能够剂量依赖性的增加荷瘤小鼠的脾细胞数量,并能够显著增强宿主淋巴细胞对肿瘤细胞的杀伤作用。该结果提示,虾青素可以显著提高荷瘤小鼠的免疫水平,进而发挥杀伤肿瘤的作用。虾青素提高宿主免疫水平的作用可能与其强大的抗氧化功能有关。虾青素的抗氧化作用能够保持机体的自稳态,从而保证细胞间隙的连接通讯正常发挥作用,进而促进淋巴细胞间的相互作用并分泌有免疫活性的细胞因子,最终表现为机体免疫能力的增强[7]。然而,虾青素抗肿瘤及增强免疫功能的详细机制仍有待于进一步研究。
综上所述,虾青素能够剂量依赖性地抑制小鼠肝肿瘤的生长,并促进宿主淋巴细胞的增殖和增强淋巴细胞对肿瘤的杀伤能力。虾青素作为新型的抗肿瘤药物的临床应用价值值得进一步探讨。
[1]RaoAV,RaoLG.Carotenoidsandhumanhealth[J].PharmacolRes,2007,55(3):207-216.
[2]Campoio TR,Oliveira FA,Otton R.Oxidative stress in human lymphocytes treated with fatty acid mixture:role of carotenoid astaxanthin[J].Toxicol In Vitro,2011,25(7):1448-1456.
[3]Zhao ZW,Cai W,Lin YL,et al.Ameliorative effect of astaxanthin on endothelial dysfunction in streptozotocin-induced diabetes in male rats[J].Arzneimittelforschung,2011,61(4):239-246.
[4]Xu M,Wang X,Cai Y,et al.An engineered superantigen SEC2 exhibits promising antitumor activity and low toxicity [J].Cancer Immunol Immunother,2011,60(5):705-713.
[5]Zhang X,Zhao WE,Hu L,et al.Carotenoids inhibit proliferation and regulate expression of peroxisome proliferators-activated receptor gamma(PPARγ)in K562 cancer cells [J].Arch Biochem Biophys,2011,512(1):96-106.
[6]裴凌鹏.虾青素体内抗肿瘤及其免疫调节作用的实验研究[J].上海中医药杂志,2009,43(6):68-69.
[7]Bertram JS,Vine AL.Cancer prevention by retinoids and carotenoids:independentactiononacommontarget[J].BiochimBiophysActa,2005,1740(2):170-178.

