BAPTA-AM对MDCK细胞的保护作用及其机制
施水娟,宋必卫
(浙江工业大学药学院,浙江杭州 310014)
肝功能衰竭(hepatic failure,HF)是一种涉及多器官的临床综合征,由大面积的肝细胞死亡引起,很快发生多脏器功能衰竭,死亡率高达60% ~90%。目前临床无有效治疗药物。肝肾综合征(hepatorenal syndrome,HRS)是在严重肝病时发生的急性肾功能衰竭,是HF的重要并发症与死亡原因。HRS加重病情,使治疗更复杂。理论上,一个药物对肝、肾细胞均有强力保护作用,则用于治疗HF更佳:既治疗原发病,又能改善并发症。我们发现进入细胞后活化的高效钙络合剂 BAPTA-AM[1,2-bis(2-aminophenoxy)ethane-N,N,N'N'-tetraacetic acid]对肝细胞有很强的保护作用,有望开发成肝衰的治疗药[1-2]。
D-氨基半乳糖(D-galactosmine,D-GalN)诱导急性肝损伤模型是目前公认最好的模拟病毒性肝炎病理变化的实验模型[3]。本文以D-GalN攻击肾小管细胞(MDCK细胞)以模拟肝肾综合症时的肾细胞损伤,通过测定细胞活力,线粒体膜电位(△Ψm),凋亡通路关键酶 Caspase-8、Caspase-9的激活等指标评价D-GalN对肾细胞的毒性和BAPTA-AM的对肾细胞的保护作用及其作用机制,探讨其对肝肾综合症的有益影响,进一步论证BAPTAAM的治疗学价值。
1 材料与方法
1.1 材料
1.1.1 试剂 MDCK细胞株购自 American tissue culture center(ATCC);D-GalN购自重庆医科大学;BAPTA-AM 购自 Gibco公司;Rhodamine123、MTT、A23187、Fura-2/AM购自Sigma公司;Annexin V-EGFP、Hoechst33342/PI购自南京凯基生物技术有限公司;Caspase-8、Caspase-9活性检测试剂盒购自海门市碧云天生物技术研究所;MEM培养液、胎牛血清、0.25%胰蛋白酶、PBS购自上海吉诺医药生物技术有限公司。
1.1.2 仪器 垂直流超净台(ESCO);CO2培养箱(Forma 3111);倒置荧光显微镜(Leica Devices);酶标仪(Molecular Devices,Spectramax M2e);离心机(Heraeus,LDZ5-2)。
1.2 方法
1.2.1 D-GalN诱导MDCK细胞损伤模型的建立将MDCK细胞以104/孔接种于96孔板,MEM培养液,5%CO2,37℃培养至细胞生长到70% ~80%孔面积。每组设6个复孔,实验重复3次。正常对照组不作处理。模型组加入不同浓度D-GalN,再培养6 h。各孔均加入终浓度0.5 g·L-1的MTT,37℃孵育4 h后DMSO溶解,用酶标仪(λ=570 nm)测吸光度,选择适当浓度造模。
1.2.2 BAPTA-AM 对 D-GalN诱导 MDCK细胞损伤的影响 细胞分5组,每组6个复孔。正常对照组不作处理;D-GalN模型组加入D-GalN(20 mmol·L-1),用药各组在D-GalN攻击前30 min时加入相应浓度的BAPTA-AM。继续培养6 h后MTT法检测细胞活力。
1.2.3 Annexin V-EGFP/PI、Hoechst33342/PI 染色[4]以5×104/孔接种细胞于24孔板,分组处理同“1.2.2”。D-GalN攻击6 h后弃培养液并用PBS清洗细胞两遍,分别加入Annexin V-EGFP、PI,室温避光反应5 min,或hoechst33342、PI(终浓度均为1 mg·L-1)室温避光反应30 min,荧光显微镜观察。
1.2.4 △Ψm 的检测[5-6]Rh 123 为膜电位敏感的荧光染料,能选择性地在活细胞线粒体内聚集,发出黄绿色荧光,其强度可间接反映△Ψm水平。细胞分组与处理同“1.2.2”,每组设3个复孔。弃培养液,PBS清洗两次,加含10 mg·L-1Rh 123的无血清培养基中37℃孵育30 min后移弃Rh 123,PBS清洗多次至背景较浅,荧光显微镜观察。
1.2.5 细胞内 Caspase-8、Caspase-9 活性检测[7]基于Caspase-8、Caspase-9分别特异性催化底物Ac-IETD-pNA、Ac-LEHD-pNA产生黄色的pNA,通过于405 nm测定pNA吸光度检测Caspase-8、Caspase-9的活性。接种于细胞6孔板中,分组与处理同上,收集细胞按照每200万细胞加入100 μl的比例加入裂解液,重悬沉淀,冰浴下裂解15 min,4℃离心(15 000 r·min-1)15 min,取上清液按试剂盒说明检测。
1.2.6 A23187/CaCl2拮抗实验[8]Ca2+载体A23187促进Ca2+进入胞内形成Ca2+超载损伤。以104/孔接种细胞于96孔板,分组同“1.2.2”。用药各组分别加入相应浓度的BAPTA-AM培养30 min后,模型组和BAPTA-AM各组分别加入CaCl20.4 g·L-1和不同浓度的 A23187(0.01 ~ 100 μmol·L-1),继续培养4 h,MTT法测细胞活力。
1.2.7 [Ca2+]i的测定 分组及 D-GalN攻击同上。用无血清无酚红的MEM培养液清洗细胞3次。加入终浓度为 5 μmol·L-1的 Fura-2/AM,37℃避光温育30 min,用无血清无酚红的MEM培养液清洗3次以去除多余的Fura-2/AM。设定激发波长340 nm,发射波长510 nm,测定荧光强度。再加入0.4%的Triton X-100及5 mmol·L-1CaCl2后测定最大荧光强度值Fmax,在Fmax的基础上加入10 mmol·L-1EGTA后所测定最小荧光强度值Fmin。按以下公式计算[Ca2+]i:Kd(F-Fmin)/(Fmax-F);Fura-2 与 Ca2+的解离常数 Kd=224 nmol·L-1。
1.2.8 统计处理 用GraphPad Prism软件处理,数据用±s表示。
2 结果
2.1 D-GalN诱导MDCK细胞损伤模型的建立D-GalN攻击6 h,细胞活力随着D-GalN浓度升高呈指数衰减(Fig 1)。当D-GalN浓度为20 mmol·L-1时,细胞活力降低至50.9%,故以该浓度D-GalN攻击6 h制备MDCK细胞损伤模型。

Fig 1 Inhabitory effect of D-GalN on viabilities of MDCK cells detected with MTT method(±s,n=6)
2.2 BAPTA-AM明显提高MDCK细胞活力 结果见Fig 2。BAPTA-AM浓度依赖性地减轻细胞损伤,在 5 nmol·L-1时作用最佳(活力为 84.6%),再增大剂量则作用减弱,提示用药不可过量。
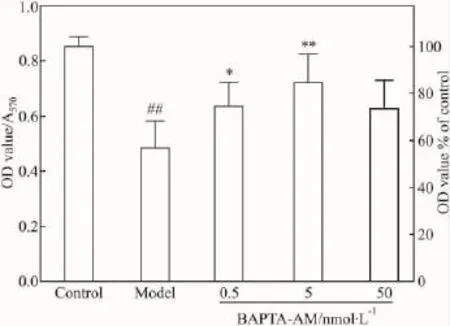
Fig 2 BAPTA-AM protected MDCK cells from D-GalN induced injury(±s,n=6)
2.3 BAPTA-AM抗细胞凋亡作用 膜磷酯酰丝氨酸(phosphatidylserine,PS)外翻、染色质凝集是细胞凋亡重要特征。Annexin V-EGFP选择性结合外翻的PS,使凋亡细胞绿染。碘化丙啶(Propidium Io-dide,PI)可进入凋亡中晚期或坏死细胞使细胞核红染,两者配合使用可将处于不同凋亡时期的细胞区分开。Hoechst 33342是一种可穿透细胞膜的核荧光染料,活细胞核呈弥散均匀蓝色荧光,凋亡细胞核则呈致密荧光。
现有研究从宏观、中观和微观不同视角对金融结构影响产业结构升级的机理进行了深入分析,而在各不同传导途径中技术进步都扮演着非常重要的角色。主要表现为以下三个方面:(1)在合理高效的金融结构下,资金向着收益率高的部门流动,资金集聚与导向提供激励,促进技术进步,从而产业结构得以优化提升;(2)国际技术转移尤其是技术引进推动了我国经济结构的调整,其中金融结构发挥着重要的作用;(3)金融结构通过刺激“企业家精神”、影响企业的融资约束等因素,影响企业技术创新,推动产业结构高度化。
D-GalN处理后,大量细胞被Annexin V-EGFP绿染,细胞皱缩,膜泡形成,部分细胞碎裂(Fig 3A),Hoechst 33342染色显示胞核缩小,呈致密浓染(高亮)(Fig 3C),呈典型的凋亡特征变化。部分细胞双重着色(凋亡中晚期),少量细胞红染(坏死)。BAPTA-AM有明显的抗凋亡作用,浓度为5 nmol·L-1时作用最佳(Fig 3B)。
2.4 BAPTA-AM抑制D-GalN所致的△Ψm崩溃由Fig 4可见,D-GalN处理6 h使MDCK细胞线粒体摄取Rh123能力降至正常细胞的21.4%,出现ΔΨm崩溃。BAPTA-AM浓度依赖性维持ΔΨm,表明BAPTA-AM能有效保护线粒体,稳定ΔΨm,维持膜功能,最佳浓度为5 nmol·L-1。
2.5 BAPTA-AM抑制Caspase-8、Caspase-9激活Caspase-8、Caspase-9的活性可反映死亡受体和线粒体凋亡通路的激活程度。由Fig 5可知模型组Caspase-8、Caspase-9活性均约为正常对照组的2倍。BAPTA-AM对Caspase-8、Caspase-9激活均有明显抑制作用,对后者抑制作用尤强,5 nmol·L-1时几乎完全抑制其激活。
2.6 BAPTA-AM抑制A23187/CaCl2诱导的细胞损伤 A23187诱导细胞内钙超载导致细胞损伤。由Fig 6可知,细胞活力随着A23187浓度的升高而降低。BAPTA-AM浓度依赖性提高细胞活力,5 nmol·L-1时效果最佳。
2.7 BAPTA-AM降低[Ca2+]iD-GalN损伤MDCK细胞后,[Ca2+]i较正常对照组明显升高。BAPTA-AM剂量依赖性降低[Ca2+]i,其浓度为50 nmol·L-1时,[Ca2+]i达到(149.62 ± 28.41)nmol·L-1,与正常对照组相当,证明BAPTA-AM能完全取消钙超载。
3 讨论
D-GalN是常用的肝毒剂。D-GalN与LPS(内毒素)合用,促进TNF-α生成,通过死亡受体通路诱导大量细胞凋亡,致鼠急性HF[3]。一般认为D-GalN干扰半乳糖代谢,导致三磷酸尿苷耗竭,抑制RNA和蛋白质合成。然而D-GalN的确切毒性机制尚不清楚。本课题组证明D-GalN通过钙超载损伤肝细胞,致大量细胞凋亡,少量细胞坏死[1]。本文发现D-GalN攻击 MDCK细胞后,[Ca2+]i明显升高,细胞活力下降,出现细胞凋亡形态学特征性改变(Fig 3),细胞凋亡通路激活(Fig 5)和ΔΨm崩溃,充分证明D-GalN能诱导细胞凋亡与坏死,线粒体是其作用的靶细胞器,该结果与人胚肝细胞实验一致[1]。

Fig 3Morphological analysis of MDCK cells by Annexin V-EGFP/PI or Hoechst 33342/PI double staining(±s,n=6)
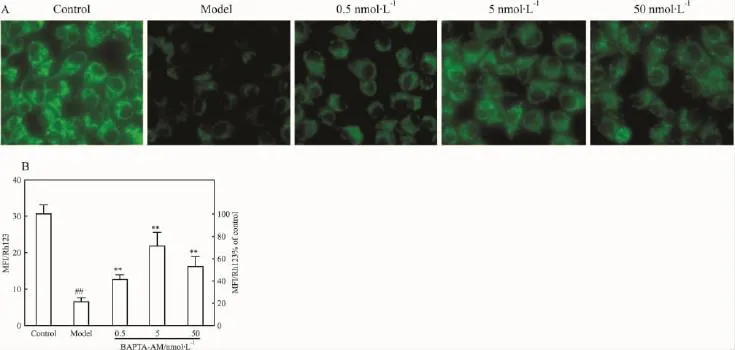
Fig 4 Inhibition of BAPTA-AM on dissipation of the ΔΨm of MDCK cells by DGalN attack(±s,n=6)A:ΔΨm was labeled with rhodamine123 and detected by fluorescence microscope;B:Bar graph:quantitative analysis of the mean fluorescent intensity(MFI)analyzed by Image J software.##P <0.01 vs control group;**P <0.01 vs model group
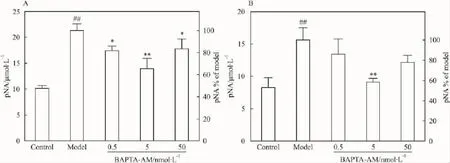
Fig 5BAPTA-AM blocked activation of caspase-8 and caspase-9 in MDCK cells attacked by D-GalN(±s,n=3)

Fig 6 BAPTA-AM prevented MDCK cells from the injury of ionophore A23187 combined with CaCl2of 0.4 g·L-1(±s,n=6)
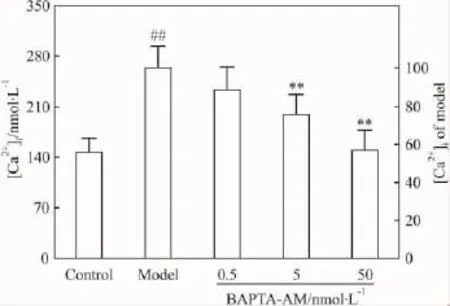
Fig 7 BAPTA-AM attenuated cytoplasmic free Ca2+concentrations in MDCK cells attacked by D-GalN(±s,n=6)
一般认为,细胞凋亡存在两条主要信号通路:线粒体通路死亡受体通路。细胞凋亡与Ca2+超载密切相关。Ca2+超载使线粒体内膜形成通透性转换孔(mitochondrial permeability transition pore,MPTP),膜通透性高,造成线粒体肿胀,ATP耗竭,ΔΨm崩溃,引起细胞凋亡和坏死[9]。同时线粒体外膜形成大孔径的凋亡诱导孔(mitochondrial apoptosis-inducedchannel,MAC),细胞色素C(CytC)经此通道释放到细胞质,进而激活 Caspase-9,始动下游Caspases级联反应[10],完成凋亡。我们系列工作证明D-GalN通过Ca2+超载损伤线粒体,使MPTP开放,ΔΨm 崩溃,CytC 释放[2],激活 Caspase-9(Fig 5),即通过线粒体通路引起细胞凋亡。Caspase-8是死亡受体通路的起始者。本文发现D-GalN也能使Caspase-8激活(Fig 5),提示其对死亡受体通路有易化作用。该结果有助于理解D-GalN与LPS协同诱发急性HF,但其确切分子机制尚待研究。
细胞死亡机制复杂,涉及的信号通路和信号分子很多,仅阻断某一环节对改善全局帮助不大。而Ca2+超载在多环节参与细胞死亡信号过程。理论上,直接降低[Ca2+]i,迅速消除 Ca2+超载,恢复细胞内Ca2+稳态,可在多环节协同产生高效有益作用,是目前最佳可选策略。由于Ca2+可经多种通道、转运蛋白、内源储库释放、直接通过损伤的膜等多种途径进入细胞[11],故钙通道阻滞剂疗效不佳。
BAPTA-AM是一种快速高效的细胞内Ca2+络合剂,有效控制 [Ca2+]i,消除 Ca2+超载[12]。本文工作表明,BAPTA-AM对肾细胞有强力保护作用,能减少细胞凋亡与坏死,大大降低细胞死亡率。该药通过消除Ca2+超载保护线粒体,稳定ΔΨm,抑制主要凋亡通路激活而产生强大的抗凋亡作用。由Fig 3(双重荧光染色)可见,BAPTA-AM大大减少凋亡;即使少量细胞发生凋亡,也是处于早期(膜PS外翻),几乎见不到中晚期凋亡与坏死细胞。膜PS外翻是可逆转的改变[13],处于此期的细胞尚可挽救。该结果与肝细胞实验结果一致[1-2]。
BAPTA-AM的浓度-效应曲线特点是存在最佳剂量,超过该剂量则作用减弱,故应注意控制剂量。该现象的机制尚不清楚。考虑到5 nmol·L-1时,BAPTA-AM能明显降低[Ca2+]i但尚未降至正常对照水平,此时效果最佳;而 50 nmol·L-1时[Ca2+]i与正常对照组相当(Fig 7)但药效有所降低,表明药效降低并非[Ca2+]i过度下降所致。由此我们提出一种新观点:如同适度的炎症、发热有助于机体康复一样,细胞受到损伤性刺激时,[Ca2+]i适度升高是一种有益的适应性保护反应,取消这种反应导致疗效减弱;[Ca2+]i过度升高则导致严重危害反应,必须控制。
我们还发现,BAPTA-AM对脑细胞有很强的保护作用(待发表)。这些结果表明BAPTA-AM是一种很有希望的HF治疗药,不仅护肝,还能对其严重并发症肝肾综合症和肝性脑病的产生良好影响,也可能用于肾、脑梗死的治疗。该药作为抗细胞死亡、抢救濒危细胞药物,有极佳的研发前景。
[1] 蔡 雁,付再林,顾喜燕,宋必卫.BAPTA-AM抗D-GalN致LO2细胞损伤作用[J].浙江工业大学学报,2010,38(3):326-31.
[1] Cai Y,Fu Z L,Gu X Y,Song B W.Protective effects and mechanism of BAPTA-AM on D-galactosmine-induced injury of L-O2 cells[J].J Zhejiang Univ Technol,2010,38(3):326 -31.
[2] 付再林,宋必卫,施水娟,杨 毅.BAPTA-AM对HepG-2细胞MT的保护作用及其机制[J].中国药理学通报,2011,27(6):859-63.
[2] Fu Z L,Song B W,Shi S J,Yang Y.Protective effects of BAPTAAM on hydrogen peroxide-induced mitochondria injury in HepG-2 cells[J].Chin Pharmacol Bull,2011,27(6):859 -63.
[3] Takano H,Inoue K,Shimada A,et al.Urinary trypsin inhibitor protects against liver injury and coagulation pathway dysregulation induced by lipopolysaccharide/D-galactosamine in mice[J].Lab Investigat,2009,89:833 -9.
[4] Oriowo O M,Cullen A P,Sivak J G.Impairment of eye lens cell physiology and optics by broadband ultraviolet A-ultraviolet B radiation[J].Photochem Photobiol,2002,76:361 -7.
[5] Darzynkiewicz Z,Traganos F,Staiano-coico L,et al.Interaction of rhodamine 123 with living cells studied by flow cytometry[J].Cancer Res,1982,42:799 -806.
[6] Jiang T,Acosta D.An in vitro model of cyclosporine-induced nephrotoxicity[J].Fundam Toxicol Appl,1993,20:486 -95.
[7] Cai L,Wang H,Li Q,et al.Salidroside inhibits H2O2-induced apoptosis in PC12 cells by preventing cytochrome c release and inactivating of caspase cascade[J].Acta Biochim Biophys Sin,2008,40(9):796-802.
[8] Itoh T,Kanmura Y,Kuriyama H.A23187 increases calcium permeability of store sites more than of surface membranes in the rabbit mesenteric artery[J].J Physiol,1985,359:467 -84.
[9] Di Lisa F,Carpi A,Giorgio V,Bernardi P.The mitochondrial permeability transition pore and cyclophilin D in cardioprotection[J].Biochim Biophys Acta,2011,1813(7):1316 -22.
[10] Kinnally K W,Antonsson B.A tale of two mitochondrial channels,MAC and PTP,in apoptosis[J].Apoptosis,2007,12(5):857 -68.
[11] Szydlowska K,Tymianski M.Calcium,ischemia and excitotoxicity[J].Cell Calcium,2010,47:122 -9.
[12]宋必卫,储昭兴.BAPTA-AM的研究现状[J].中国药理学通报,2009,25(7):851 -3.
[12] Song B W,Chu Z X.The research progress of BAPTA-AM[J].Chin Pharmacol Bull,2009,25(7):851 -3.
[13] Kroemer G,El-Deiry W S,Golstein P,et al.Classification of cell death:recommendations of the Nomenclature Committee on Cell Death[J].Cell Death Differ,2005,12(Supp l 2):1463 -7.

