川续断皂苷Ⅵ诱导大鼠骨髓间充质干细胞向成骨细胞方向分化的研究
武密山,赵素芝,任立中,王 茹,白 霞,韩红伟,李 彬
(1.河北医科大学中医学院方剂学教研室,河北石家庄 050091;2.石家庄市桥东区医院,河北石家庄 050041;3.河北医科大学第一医院骨科,河北石家庄 050031;4.河北医科大学生物化学教研室,河北石家庄 050017)
骨髓间充质干细胞(mesonchymal stem cells,MSCs)是理想的组织工程种子细胞[1]。骨髓组织除含有造血干细胞外,还含有MSCs,早期分离培养时,发现其形状呈成纤维细胞样而称为成纤维细胞集落形成单位(colony-forming unit-fibroblastic,CFU-F),或骨髓基质成纤维细胞(marrow stromal fibroblastic,MSF),又因其来自骨髓基质而称为骨髓基质细胞(bone marrow stromal cells,BMSCs)。近年来因其在不同诱导条件下,具有向中胚层组织细胞,如成骨细胞、成软骨细胞、脂肪细胞等分化的能力,又称其为间充质干细胞、间充质祖细胞(mesenchymal progenitor cells,MPC)或骨源性干细胞(osteogenic stem cells,OSC)[2]。骨组织由细胞和骨基质组成,各种病因造成的骨质疏松症(osteoporosis,OP)都表现为破骨细胞(osteoclast,OC)溶解基质形成骨洞的作用超过成骨细胞(osteoblast,OB)形成基质填充骨洞的作用。前期研究表明,由川续断组成的补肾复方在抑制骨量丢失,改善骨密度方面有明显疗效[3-5],体外实验也证实续断可通过促进成骨细胞增殖、分化,提高成骨细胞的活性和数量,促进基质钙化、骨痂生长等途径防治骨质疏松、促进骨折愈合[6]。2010年《中国药典》指定川续断皂苷Ⅵ(akebia saponin D,ASD)为川续断科植物川续断 Dipsacus asper Wall.ex Henry的含量测定标准,目前国内外ASD对成骨细胞核心结合因子α-1(Cbfα1)mRNA表达影响的研究较少。深入开展ASD诱导大鼠骨髓间充质干细胞分化为成骨细胞的研究,对于研究川续断抗骨质疏松的作用机制具有重要意义。
1 材料和方法
1.1 材料
1.1.1 主要试剂、药物与动物 噻唑蓝、碱性磷酸酶(ALP)试剂盒(日本 Wako公司),胰蛋白酶(Sigma USA),Collagenase type Ⅱ(Worthington,USA),DMEM培养基(Gibco公司),α-minimal essential medium(α-MEM,Gibco,USA),胎牛血清(Hyclone 公司),考马斯亮蓝购自上海生物工程技术服务有限公司。川续断皂苷Ⅵ(akebia saponin D,ASD批号:110728-201002,购自中国药品生物制品检定所,其结构见Fig 1),ASD用PBS溶液溶解后,调 pH至7.2~7.4,滤膜过滤除菌,-4℃密封保存,使用时用DMEM培养液进行稀释。6周龄SD大鼠(河北医科大学实验动物中心提供)。Northern blot增强化学发光试剂盒(PIERCE),RT-PCR试剂盒与RNA提取试剂盒(TaKaRa公司),RT反转录试剂盒、Taq DNA聚合酶、dNTP和Trizol总RNA提取试剂盒均为 MBI公司产品,Cbfα1 ELISA 试剂盒(ADL,USA),Cbfα1和 GAPDH 引物由 Invitrogen公司合成,Cbfα1 引物序列:上游 5'-ATGCTTCATTCGCCTCACAAAC-3',下 游 5'-CCAAAAGAAGCTTTGCTG-3',扩增片段长度为261 bp。内参GAPDH引物序列:上游 5'-GACTACCTCATGAAGATCCT-3',下游5'-GCGGATGTCCACGTCACACT-3',扩增片段长度为313 bp。

Fig 1 Chemical structure of Akebia saponin D
1.1.2 仪器 CO2恒温培养箱(美国 SHELL LAB),96 孔培养板(Costar,USA),35 mm 组织培养皿(Corning-Costar,NY,USA),倒置相差显微镜(日本Olympus),UV 1601紫外分光光度计(日本岛津),DYY-Ⅲ-7 B稳压稳流型电泳仪(北京六一仪器厂),PCR 扩增仪(Gene Amp PCR System 2400,美国),Gel Doc 2000凝胶成像系统(美国BIO RAD),美国MIS-2000 SP型3 Y显微图像分析仪,3 Y分析软件(Pro,Ver,4.0)。
1.2 方法
1.2.1 大鼠骨髓间充质干细胞的分离纯化、培养扩增 参照文献[7]并作改进,选用6周龄健康SD大鼠,颈椎脱臼法处死,无菌条件下分离股骨胫骨,切去骨两端,用含 15%FBS、100 kU·L-1青霉素 G、100 mg·L-1硫酸链霉素的α-MEM(含酚红)冲洗骨髓腔得到骨髓细胞悬液,1 000 r·min-1,离心10 min,弃上清。用L-DMEM重悬细胞,将细胞悬液贴壁轻轻加入到预置等体积淋巴细胞分离液(比重1.077)的离心管中,2 000 r·min-1,离心 30 min。收集云雾状白膜层的单个核细胞,用L-DMEM洗涤两次(1 000 r·min-1,离心 5 min),用含 10% 新生小牛血清、1×105U·L-1青霉素、1 ×105U·L-1链霉素的L-DMEM培养基重悬。以1×108·L-1接种细胞于培养瓶中,于饱和温度37℃、pH 7.2条件下培养于5%CO2恒温培养箱。5 d时首次换液,以后每周换液两次,根据细胞贴壁性能不同,每次换液弃除悬浮生长的造血系细胞,每次传代用0.25%胰蛋白酶(0.1 ml·cm-2)消化2 min,将 MSCs与混杂的淋巴细胞、单核细胞分开,重复上述操作,反复传代扩增,使MSCs得到纯化。然后将MSCs培养条件改为无酚红α-MEM培养液中继续培养,进行以下分组,供实验待用。
1.2.2 实验设计分组 实验共分 4组:对照组(control,无酚红α-MEM),川续断皂苷Ⅵ用无酚红α-MEM 培养液稀释成以下低(L-ASD,0.1 μmol·L-1)、中(M-ASD,1 μmol·L-1)、高(H-ASD,10 μmol·L-1)不同浓度培养组,每组药物浓度均设8个平行孔。
1.2.3 大鼠骨髓MSCs的生长曲线测定 各组细胞用质量浓度为0.25 g·L-1胰蛋白酶消化,1×108·L-1接种于96孔板,每天各取8孔计数,每孔计数5次,计算均值,连续8 d。以培养时间为横轴,细胞数为纵轴,描绘生长曲线。计算群体倍增时间:TD=t[log 2/(log Nt- log No)],No 和 Nt分别代表接种后和培养t小时的细胞数。
1.2.4 成骨细胞内碱性磷酸酶(alkaline phosphate,ALP)活性测定 将各组MSCs诱导分化过程中细胞在第4,5,6天时用 PBS洗涤细胞2次,0.04 g·L-1蛋白酶 E(含 1.25 mmol·L-1EDTA),消化并收集细胞。细胞内ALP活性测定底物为9×10-2mol·L-1pNPP,反应液 pH 为 10.3,37℃反应 30 min,加0.1 mol·L-1NaOH终止反应,400 nm处测定吸光度,同时用考马斯亮蓝测定培养细胞蛋白质含量。ALP 活性表示为 mmol·L-1·min-1·g-1Pro。
1.2.5 骨钙素(osteocalcin,OC)检测 试验方法及药物和浓度同1.2.4,每组各设8孔,各组分别诱导至第4,5,6天时,分别取培养液进行细胞的骨钙素含量测定,采用双抗夹心ELISA法。以OD值为纵坐标,以标准品浓度为横坐标,绘制标准曲线。根据样品的OD值在标准曲线上查出其浓度,以μg·L-1表示,具体操作步骤按试剂盒说明书进行。
1.2.6 RT-PCR 法检测 Cbfα1 mRNA 表达 ① 组织总RNA提取:采用异硫氰酸胍-苯酚-氯仿一步法提取总RNA,紫外分光光度计测定总RNA浓度,A260/A280均在1.8~2.0。总RNA浓度=OD260值×8(g·L-1),用前调整浓度至 1 g·L-1。② 反转录(reverse transcription,RT):所提取总 RNA 1 μl加入0.5 μl Oligt dT(500 mg·L-1),离心混匀后加入:dNTP(mix)2 μl,5 × buffer 6 μl,R Nase Ribonuclease Inhibitor 1 μl,AMV-RT 1 μl,无菌 DEPC 水 8.5 μl,反应体系为 20 μl,振荡混匀,42℃ 60 min,90℃ 5 min,4℃ 5 min。③ PCR 反应:2 × Primer 2 μl,Taq聚合酶 buffer 2.5 μl,Taq 聚合酶 0.5 μl,dNTP 2 μl,样本模板 2 μl,DEPC 水 16 μl,总反应体积为 25 μl。④ PCR扩增条件:Cbfα1:94℃变性30 s,55℃退火1 min,72℃延伸2 min共30个循环。β-actin:94℃变性30 s,55℃退火1 min,72℃延伸2 min共25个循环,72℃ 5 min,4℃保存。⑤ 琼脂糖凝胶电泳:取扩增产物10 μl与溴酚蓝上样缓冲液2 μl混合后行质量分数为1%的琼脂糖凝胶电泳,电泳结果在凝胶成像分析系统中分析基因条带的光密度值,并求出与内参照基因GAPDH的光密度比值。
2 结果
2.1 各组成骨细胞的生长曲线 各组生长曲线图形基本相似,经过1~3 d的潜伏适应期后进入对数生长期,第6天达顶点,以后进入平台期,群体倍增时间平均约48 h。与对照组(control)相比,川续断皂苷Ⅵ低浓度组(L-ASD,0.1 μmol·L-1)OB 的生长曲线差异无显著性(P>0.05)。川续断皂苷Ⅵ中浓度组(M-ASD,1 μmol·L-1)和川续断皂苷Ⅵ高浓度组(H-ASD,10 μmol·L-1)OB 的生长曲线明显升高(P<0.01),提示大鼠骨髓MSCs在川续断皂苷Ⅵ中、高浓度稳定扩增,未出现衰老征象,有较强的扩增潜能。见Fig 2。

Fig 2 Cells growth curve of akebia saponin D
2.2 川续断皂苷Ⅵ对大鼠骨髓MSCs诱导分化为成骨细胞过程中碱性磷酸酶(ALP)活性的影响与对照组相比,川续断皂苷Ⅵ低浓度组对大鼠骨髓MSCs诱导分化为OB过程中第4、5、6天的ALP活性差异无显著性(P>0.05)。川续断皂苷Ⅵ中浓度组和川续断皂苷Ⅵ高浓度组对大鼠骨髓MSCs诱导分化为OB过程中第4、5、6天的ALP活性明显升高(P<0.01)。见 Tab 1。
Tab 1 Effects of akebia saponin D on ALP activity in different concentrations of MSCs cells to osteoblasts during differentiation(mmol·L-1·min-1·g-1Pro,±s,n=8)
**P<0.01 vs control group
Group Concentration/μmol·L -1 Incubation time/d 4 5 6 Control - 2.51 ±0.12 3.16 ±0.14 3.62 ±0.14 L-ASD 0.1 2.62 ±0.16 3.31 ±0.17 3.75 ±0.18 M-ASD 1 3.23 ±0.13** 3.49 ±0.16** 3.84 ±0.16**H-ASD 10 3.75 ±0.15** 3.56 ±0.12** 3.98 ±0.15**
2.3 川续断皂苷Ⅵ对大鼠骨髓MSCs诱导分化为成骨细胞过程中骨钙素(OC)的影响 与对照组相比,川续断皂苷Ⅵ低浓度组对大鼠骨髓MSCs诱导分化为OB过程中第4、5、6天的骨钙素差异无显著性(P>0.05)。川续断皂苷Ⅵ中浓度组和川续断皂苷Ⅵ高浓度组对大鼠骨髓MSCs诱导分化为OB过程中第4、5、6天的骨钙素明显升高(P<0.01)。见Tab 2。
Tab 2 Effects of akebia saponin D on osteocalcin in different concentrations of MSCs cells to osteoblastsduring differentiation(μg·L-1,±s,n=8)
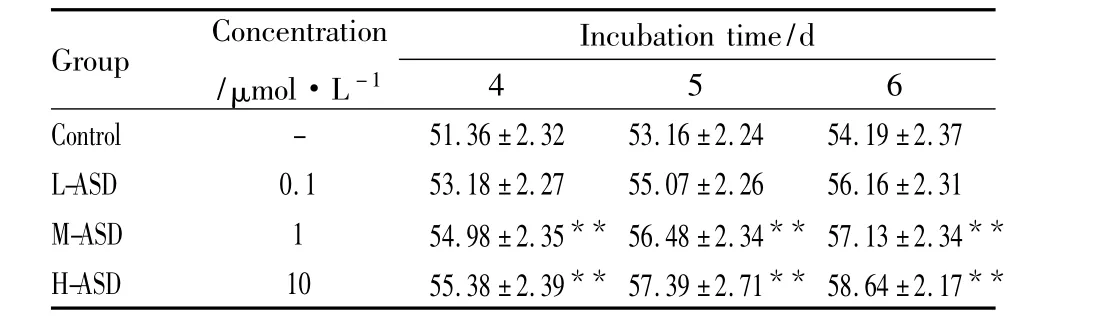
Tab 2 Effects of akebia saponin D on osteocalcin in different concentrations of MSCs cells to osteoblastsduring differentiation(μg·L-1,±s,n=8)
**P<0.01 vs control group
Group Concentration/μmol·L -1 Incubation time/d 4 5 6 Control - 51.36±2.32 53.16±2.24 54.19 ±2.37 L-ASD 0.1 53.18 ±2.27 55.07 ±2.26 56.16 ±2.31 M-ASD 1 54.98±2.35** 56.48±2.34** 57.13 ±2.34**H-ASD 10 55.38±2.39** 57.39±2.71** 58.64 ±2.17**
2.4 川续断皂苷Ⅵ对大鼠骨髓MSCs诱导分化为成骨细胞过程中Cbfα1 mRNA表达的影响 与对照组相比,川续断皂苷Ⅵ低浓度组对大鼠骨髓MSCs诱导分化为OB过程中第5天的Cbfα1 mRNA表达差异无显著性(P>0.05)。川续断皂苷Ⅵ中浓度组和川续断皂苷Ⅵ高浓度组对大鼠骨髓MSCs诱导分化为OB过程中第5天的Cbfα1 mRNA表达明显升高(P<0.01)。见Tab 3。
3 讨论
干细胞可分为三种类型:一类是全能干细胞,如胚胎干细胞,来源于胚胎早期原始生殖细胞,可分化为机体所有类型细胞;第二类是多能干细胞;第三类是专能干细胞。第二、三类干细胞存在于成年组织中,又称成体干细胞,如造血干细胞、神经干细胞、间充质干细胞,可分化为一、二种类型的分化细胞。传统认为骨髓MSCs的主要功能是参与造血干细胞生存和分化,近年发现还具有向多种细胞系转化的潜能,自体获取的骨髓MSCs回输后不会发生免疫排斥反应,体外基因转染率高,骨髓MSCs成为组织工程、基因治疗的研究热点[8-9]。成年后长骨骨髓腔内以黄骨髓(含脂肪细胞多)为主,若以此为骨髓MSCs的来源,则脂肪细胞多,MSCs很少;幼年动物骨髓腔内以未分化幼稚细胞为主,本实验骨髓MSCs分离、纯化选择了具有多向分化潜能的幼年动物的骨髓MSCs为诱导成骨细胞的来源。
Tab 3 Effects of akebia saponin D on expression of Cbfα1 mRNA in different concentrations of MSCs cells to osteoblasts during differentiation(±s,n=8)

Tab 3 Effects of akebia saponin D on expression of Cbfα1 mRNA in different concentrations of MSCs cells to osteoblasts during differentiation(±s,n=8)
**P<0.01 vs control group
Group Concentration/μmol·L -1 Cbfα1/β-actin/%Control - 6.58 ±2.12 L-ASD 0.1 8.03 ±2.49 M-ASD 1 10.27 ±2.64**H-ASD 10 11.02 ±2.81**
目前对于骨髓中MSCs的分离、纯化、培养还没有统一的方法,比较常用的方法是密度梯度离心法、贴壁细胞分离法、流式细胞仪和免疫磁珠分离法。实验中我们把密度梯度离心法与贴壁细胞分离法相结合,首先根据比重差别,用比重为1.077的淋巴细胞分离液分离骨髓MSCs,经密度梯度离心后,能有效地将绝大部分红细胞、粒细胞、脂肪细胞和血小板除去,获得纯度较高的单个核细胞,然后利用贴壁细胞分离法,根据骨髓MSCs贴壁生长而造血系细胞悬浮生长的特性差异,随换液弃除悬浮生长的造血细胞,剩下的是贴壁生长的MSCs,经几次传代,对二者进行完整分离,从而使MSCs得到进一步纯化。
MSCs生长曲线显示为潜伏适应期、对数生长期和平台期,每个时期的细胞系都有其特性,从生长曲线的形状,判定骨髓MSCs的生长繁殖潜力基本稳定,细胞为均一的成纤维样细胞,潜伏适应期在第1~3天,对数生长期为第4~6天,以后进入平台期,在对数生长期,群体倍增时间46 h,传代周期约7 d,每传代一次细胞增加约3.2倍,高、中浓度的川续断皂苷Ⅵ与对照组相比,生长曲线有明显差异。随着成骨细胞分化的逐渐进展,其增殖能力减弱,到成熟的成骨细胞不具备增殖能力[10]。ALP是主要分布于细胞膜的钙结合转运蛋白,促进细胞成熟、钙化[11]。骨钙素是骨质钙化必需的因子,维持骨组织的正常矿化[12]。ALP和骨钙素分别是成骨细胞早期和中期分化的标志物[13-14]。实验发现加入诱导剂高、中浓度的ASD组,诱导分化的细胞具有与成骨细胞相似的形态和生长特征,与对照组相比,碱性磷酸酶活性增强,骨钙素含量增加,说明ASD诱导分化为成骨细胞的作用较强。
核心结合因子α1(core-binding factor alpha 1,Cbfα1)是脊椎动物成骨细胞分化的关键调节因子,除了作为核蛋白与成骨细胞上的特异顺式作用元件结合以激活骨钙素表达外,还调节所有关键成骨细胞基因的表达,在成骨细胞分化中起主要作用。Cbfα1基因缺失没有其它平行通路可取代Cbfα1的作用[15-16]。Cbfα1 还能控制分化的成骨细胞进一步成骨,控制分化成骨细胞的成骨速率,调节骨钙素基因(bgp)表达,bgp的表达仅限于分化完全的成骨细胞,该基因的启动子上存在2个成骨细胞特异顺式作用元件OSE 1和OSE 2。胚胎发育时Cbfα1的表达限于成骨细胞,Cbfα1是骨生成最早和最特异的标志,而作用于Cbfα1上下游的转录因子可能为非特异性的[17]。本实验研究表明,Cbfα1与骨髓基质细胞向成骨细胞分化过程密切相关,中、高浓度的ASD可使该过程中Cbfα1 mRNA的表达加强,Cbfα1 mRNA的表达始于成骨细胞诱导分化的早期,至第6天时达到高峰,并持续表达于成骨分化全过程中。
综合本实验结果认为,川续断皂苷Ⅵ具有促进MSCs增殖和向成骨细胞分化的能力,并在基因水平上为筛选促进骨形成的有效药物提供了作用靶点,详细的机制有待于进一步研究。
[1] Jiang Y,Jahagirdar B N,Reinhardt R L,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41-9.
[2] Pittenger M F,Mackay A M,Beck S C,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5411):143-7.
[3] 武密山,李 恩,赵素芝,等.抗骨松颗粒对去卵巢大鼠骨质含量和生物力学的影响[J].中国老年学杂志,2008,28(23):2289-92.
[3] Wu M S,Li E,Zhao S Z,et al.The effects of Kang Gu song Pellet(KGSKL)on bone quality and biomechanics performances of the lumbovertebral bone in ovariectomized rats[J].Chin J Gerontol,2008,28(23):2289 -92.
[4] 武密山,李 恩,赵素芝,等.补肾方含药血清对大鼠成骨细胞雌激素受体mRNA及其蛋白表达的影响[J].中国药理学通报,2008,24(10):1396 -7.
[4] Wu M S,Li E,Zhao S Z,et al.Effect of tonifying kidney contained serum on mRNA and protein expression of estrogen receptor in osteoblast rats[J].Chin Pharmacol Bull,2008,24(10):1396 -7.
[5] 武密山,赵素芝,李 恩,等.抗骨松丹杞颗粒含药血清对成骨-破骨细胞共培养体系中破骨细胞功能的影响[J].中国病理生理杂志,2010,26(8):1635 -6,9.
[5] Wu M S,Zhao S Z,Li E,et al.Effect of Kang Gu Song Dan Qi instant granules contained serum on the activity of osteoclasts in osteoblasts and osteoclasts co-culture system[J].Chin J Pathophysiol,2010,26(8):1635 -6,9.
[6] 程志安,吴燕峰,黄智清,等.续断对成骨细胞增殖、分化、凋亡和细胞周期的影响[J].中医正骨,2004,16(12):1 -3.
[6] Cheng Z A,Wu Y F,Huang Z Q,et al.The influence of Radix Dipsaci on the proliferation,differentiation ,withering and cell cycle of osteoblasts[J].J Trad Chin Orthopedics Traumatol,2004,16(12):1-3.
[7] Conget P A,Minguell J J.Phenotypical and functional properties of human bone marrow mesenchymal progenitor cells[J].J Cell Physiol,1999,181(1):67 -73.
[8] Lee K,Majumdar M K,Buyaner D,et al.Human mesenchymal stem cells maintain transgene expression during expansion and differentiation[J].Mol Ther,2001,3(6):857 -66.
[9] Van Damme A,Vanden Driessche T,Collen D,et al.Bone marrow stromal cells as targets for gene therapy[J].Curr Gene Ther,2002,2(2):195-209.
[10] Aubin J E.Advances in the osteoblast lineage[J].Biochem Cell Boil,1998,76(6):899 -910.
[11] Howlett C R,Cave J,Williamson M,et al.Mineralization in vitro cultures of rabbit marrow stromal cells[J].Clin Orthop Relat Res,1986,213:251 -63.
[12] Brown J P,Delmas P D,Malaval L,et al.Serum bone Gla-protein:a specific marker for bone formation in postmenopausal osteoporosis[J].Lancet,1984,1(8386):1091 - 3.
[13] Aubin J E.Advances in the osteoblast lineage[J].Biochem Cell Boil,1998,76(6):899 -910.
[14] Sun Y Q,Ashhurst D E.Osteogenic growth peptide enhances the rate of fracture healing in rabbits[J].Cell Biol Int,1998,22(4):313-9.
[15] Karsenty G.Role of Cbfa1 in osteoblast differentiation and function[J].Sem in Cell Dev Biol,2000,11(5):343 -6.
[16] Ducy P.Cbfa1:a molecular switch in osteoblast biology[J].Dev Dyn,2000,219(4):461 -71.
[17] Ducy P,Schinke T,Karsenty G.The osteoblast:a sophisticated fibroblast under central surveillance[J].Science,2000,289(5484):1501-4.

