热休克蛋白90在氯化钴对抗血清-葡萄糖剥夺引起的心肌细胞损伤中的作用
何金莲,董 颀,林春喜,张 梅,王秀玉,郭润民,沈 宁,冯鉴强,杨春涛
(1.广东省人民医院,广东省医学科学院,广东省老年医学研究所,广东 广州 510080;2.广州医学院生理学教研室,广东广州 510182;3.中山大学附属第一医院CCU科,广东 广州 510080;4.广州医学院药理学教研室,广东广州 510182;5.中山大学中山医学院生理学教研室,广东 广州 510080)
血清-葡萄糖剥夺(serum&glucose derivation,SGD)是血管闭塞后心肌缺血或梗死的病理生理机制之一。减轻SGD诱导的心肌损害对于缺血/缺氧性心肌疾病的治疗具有重要的现实意义和临床实用价值。
长期以来,氯化钴(cobalt chloride,CoCl2)被认为是一种化学性缺氧模拟剂,可造成组织细胞(包括心肌细胞)的缺血/缺氧性损伤[1]。然而,许多研究显示,CoCl2可以提高多种细胞保护基因的表达和(或)活性,如缺氧诱导因子(hypoxia-inducible factor,HIF)-1α、血红素加氧酶(heme oxygenase,HO)-1以及热休克蛋白(heat shock protein,HSP)90等。Xue等[2]的研究发现,选择性上调心肌组织内HIF-1α的表达可以对抗糖尿病小鼠的心肌损害。本研究组最近的研究显示,在损伤性浓度(600 μmol·L-1)的CoCl2处理H9c2心肌细胞(H9c2细胞)的过程中,HSP90的表达明显升高[3],这可能是一种内在的防御机制。另外,过表达HSP90可以保护猪的心脏对抗缺血/再灌注引起的损伤[4]。Budas等[5]进一步证实,HSP90诱导的心肌保护作用与活化蛋白激酶C(protein kinase C,PKC)有关。然而,低浓度的CoCl2是否可以保护心肌细胞对抗SGD诱导的损伤以及HSP90在其中的作用尚未见报道。
为此,本文拟观察CoCl2对SGD诱导心肌细胞损伤的影响并探讨HSP90在CoCl2心肌细胞保护中的作用。
1 材料与方法
1.1 材料 CoCl2、17-烯丙胺-17-脱甲氧格尔德霉素 (17-allylamino-17-demethoxy geldanamycin,17-AAG)、双氯荧光素(2',7'-dichlorfluorescein-diacetate,DCFH-DA)和罗丹明 123(rhodamine123,Rh123)购自美国Sigma-Aldrich公司,细胞计数试剂盒(cell counter kit,CCK)-8 购自日本 Dojindo Lab.,DMEM-F12培养基和胎牛血清购自美国Gibco公司,兔抗大鼠HSP90抗体购自美国Bio-World公司,其它试剂均为国产分析纯。
1.2 细胞培养及处理 H9c2心肌细胞由中山大学实验动物中心提供,该细胞来源于大鼠胚胎期心脏组织,在37℃、5%CO2条件下培养于含有15%胎牛血清的 DMEM-F12培养基中。SGD处理:将H9c2心肌细胞培养于不含葡萄糖的培养基中,并不加血清。CoCl2配制成不同的终浓度后,单独使用或与SGD共同作用于H9c2心肌细胞。17-AAG为HSP90的抑制剂,在SGD和CoCl2作用前1 h使用,作为预处理。
1.3 细胞存活率的检测 H9c2心肌细胞接种于96孔培养板中,每组4个复孔,约80%融合时,给予不同的处理因素。处理结束后,每孔加100 μl(1∶10稀释)CCK-8溶液,轻摇,37℃孵育3 h,用酶标仪(λ=450 nm)记录各孔的吸光度(optical density,OD)。取4孔OD值的平均数,按公式计算细胞存活率,细胞存活率/%=处理组OD/对照组OD×100%,重复3次。
1.4 细胞内活性氧含量的检测 按照文献[1]介绍的方法检测胞内活性氧(reactive oxygen species,ROS)的含量。当细胞生长到约80%融合时,根据实验需要进行不同的处理:SGD单独作用2 h;SGD与CoCl2共同作用2 h;在二者作用前用2 μmol·L-117-AAG预处理1 h;CoCl2或17-AAG单独处理。处理完成后,PBS洗2次,细胞在10 μmol·L-1DCFH-DA染液中37℃孵育10 min。在荧光显微镜下随机选取3个不重复区摄片,用Image J 1.41o软件的Color Histogram模块分析DCF的平均荧光强度,其大小能反映ROS的含量。
1.5 线粒体膜电位的检测 按照文献[1]介绍的方法检测线粒体膜电位(mitochondrial membrane potential,ΔΨm)大小。当细胞生长到约80%融合时,根据实验需要进行不同的处理:SGD 24 h;SGD与CoCl2共同作用24 h;在二者作用前用 2 μmol·L-117-AAG预处理1 h;CoCl2或17-AAG单独处理。处理结束后,用PBS洗2次,在含100 μg·L-1Rh 123的无血清培养基中37℃孵育30 min。在荧光显微镜下随机选取3个不重复区摄片,细胞核周围绿色的亮点即为摄取了Rh123的线粒体。用Image J 1.41o软件对绿色荧光强度进行半定量分析。
1.6 Western blot法检测HSP90蛋白的表达H9c2心肌细胞接种于35 mm培养皿内,约80%融合时,给予终浓度为 100 μmol·L-1的 CoCl2培养处理6、12 h及24 h;SGD与不同浓度的CaCl2共同处理24 h。处理完成后,用预冷的PBS洗2次,加入细胞裂解液,4℃静置 30 min。12 000 r·min-1离心10 min,取上清,采用BCA法进行蛋白定量。总蛋白经SDS-PAGE分离后,转移至PVDF膜上。用5%脱脂奶粉封闭1.5 h。随后加入HSP90抗体(1∶1 000),室温孵育2 h,用TBST洗3次,加入相应的二抗,孵育1 h,漂洗3次。ECL显色后,用Image J 1.41进行半定量分析,每样本重复3次。
1.7 统计学处理 实验数据用SPSS 13.0软件进行统计分析,所有结果以±s表示,组间比较采用One-way ANOVA及LSD-t检验。
2 结果
2.1 CoCl2对抗SGD诱导的H9c2心肌细胞损伤
Fig 1显示,H9c2心肌细胞经SGD处理24 h,细胞存活率明显降低,与对照组相比差异有统计学意义(P<0.01)。在SGD处理同时,分别应用50~400 μmol·L-1的 CoCl2处理 H9c2心肌细胞,细胞存活率检测结果显示,50、100 μmol·L-1和 200 μmol·L-1的CoCl2可分别明显对抗SGD引起的细胞存活率降低(P <0.05),100 μmol·L-1的 CoCl2在本身不改变细胞存活率的情况下(数据未显示),具有最强的心肌细胞保护作用(P <0.01),200 μmol·L-1CoCl2的心肌细胞保护作用开始减弱,400 μmol·L-1CoCl2已无心肌细胞保护作用(P>0.05)。因而在后续的实验中选择100 μmol·L-1的 CoCl2作为有效的细胞保护浓度。
2.2 CoCl2对抗SGD引起的H9c2心肌细胞内HSP90表达下调 通过检测H9c2心肌细胞内HSP90 的表达发现,100 μmol·L-1CoCl2处理 6 ~24 h可时间依赖性地上调HSP90的表达(Fig 2 A,B)。进一步的研究显示(Fig 2 C,D),SGD作用24 h可使H9c2心肌细胞内HSP90的表达明显降低(P<0.05),而在SGD处理过程中给予不同浓度的CoCl2可以不同程度地拮抗SGD诱导的HSP90表达下调,其中 50 μmol·L-1的 CoCl2处理开始增加HSP90的表达,在100μmol·L-1浓度时达到高峰,200 μmol·L-1时 HSP90 表达有所减少,但与 SGD组比较差异仍有统计学意义(P<0.01)。此结果表明,上调HSP90的表达可能是CoCl2对抗SGD诱导心肌毒性的机制之一。
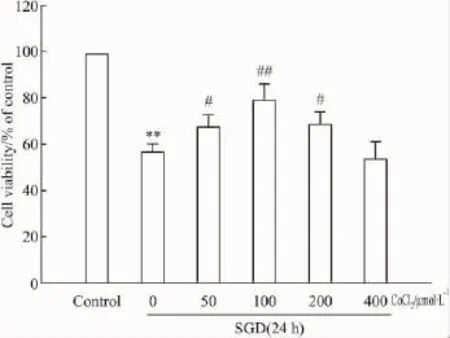
Fig 1 Effect of CoCl2on SGD-induced decrease in cell viability in H9c2 cells(n=3)
2.3 HSP90介导CoCl2对SGD诱导的心肌细胞毒性的抑制作用 为了进一步明确HSP90在CoCl2诱导的心肌细胞保护中的作用,应用HSP90的抑制剂17-AAG预处理H9c2心肌细胞。结果显示(Fig 3),2 μmol·L-117-AAG 预处理 1 h 可明显拮抗CoCl2处理引起的细胞存活率提高,提示CoCl2保护H9c2心肌细胞对抗SGD诱导的细胞毒性至少部分地与其上调HSP90的表达有关。
2.4 HSP90参与CoCl2保护心肌细胞对抗SGD引起的ROS水平的升高 氧化应激是SGD诱导细胞损伤的重要方式,为了明确CoCl2诱导的心肌细胞保护作用是否与其改善氧化应激状态有关,本文检测胞内ROS的水平显示(Fig 4),SGD处理2 h可明显提高H9c2心肌细胞内ROS的水平(P<0.01)(Fig 4 A-2),而同时给予CoCl2可拮抗胞内ROS水平的升高(P<0.05)(Fig 4 A-3)。CoCl2本身不影响胞内ROS的水平(Fig 4 A-5)。结果提示CoCl2的心肌细胞保护作用可能与抑制ROS生成有关。进一步的研究证实,17-AAG预处理能拮抗CoCl2对ROS生成的抑制作用(Fig 4 A-4),提示HSP90可能参与CoCl2的抗氧化作用。
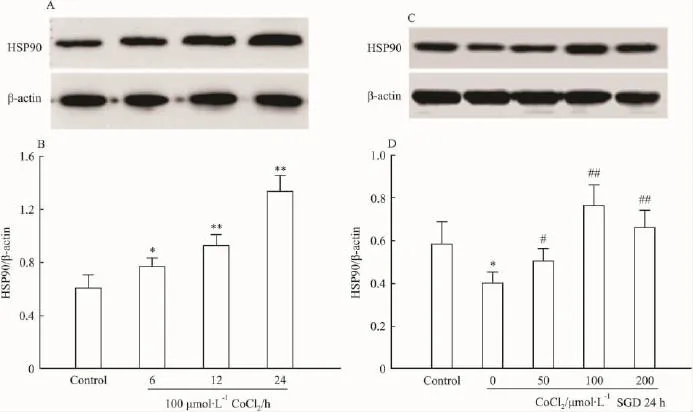
Fig 2 Effects of CoCl2and SGD on the expression of HSP90 in H9c2 cells(n=3)
2.5 HSP90参与CoCl2对抗SGD引起的ΔΨm受损 Rh123染色及荧光显微镜照相的结果显示(Fig 5),SGD处理24 h可明显抑制线粒体对Rh123的摄取,提示ΔΨm丢失线粒体功能受损(Fig 5 A-2),而同时给予CoCl2可明显改善线粒体的功能,表现为ΔΨm升高(P<0.05)(Fig 5 A-3),CoCl2本身对ΔΨm没有明显的影响(Fig 5 A-5)。而在CoCl2和SGD处理前,给予17-AAG预处理能明显减弱CoCl2对ΔΨm的改善作用(Fig 5 A-4),提示HSP90可能参与了CoCl2对线粒体功能的改善作用。

Fig 3 Effect of different treatments on cell viability in H9c2 cells(n=3)
3 讨论
缺血性器官损伤是临床常见的病理生理过程,在体外研究中可以通过SGD的方法来模拟实现[6-7]。如 Yao 等[6]在 SGD 损伤的心肌细胞上,探讨了存活素的心肌保护作用及其机制。H9c2心肌细胞来源于大鼠胚胎期的心脏组织,具有心肌细胞的许多重要特性和功能,是目前研究心肌细胞损伤与保护的常用模型。因而,本文采用 SGD处理H9c2心肌细胞可为缺血性心肌损伤的研究提供一个实用的实验模型。
本课题组的前期研究显示,800 μmol·L-1CoCl2处理H9c2心肌细胞36 h可降低细胞存活率,增加细胞凋亡率[1]。但是也有报道显示,低浓度的CoCl2处理可上调HIF-1α的表达,并促进肝细胞瘤HepG2细胞的生长[8]。而低浓度的CoCl2处理是否能保护H9c2心肌细胞对抗缺血引起的损伤,尚未见报道。本文的结果显示,100 μmol·L-1CoCl2处理可明显抑制SGD诱导的H9c2心肌细胞存活率降低,这提示低浓度CoCl2处理对心肌细胞同样具有保护作用。
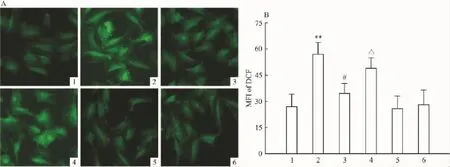
Fig 4 Effect of different treatments on intracellular ROS level in H9c2 cells(n=3)
氧化应激是SGD诱导细胞损伤的一种重要机制。抗氧化剂百里醌可保护PC12神经细胞对抗SGD引起的氧化应激损伤[7]。本文研究显示,SGD处理可使H9c2心肌细胞内ROS的水平明显升高,而CoCl2处理可以明显降低细胞内的ROS水平。这和以前关于高浓度CoCl2处理引起氧化应激损伤的报道[1,3]是不一致的。其中的一个机制可能是,高浓度的CoCl2主要以诱导ROS生成为主,而低浓度的CoCl2则主要启动细胞的一些保护基因的表达,继而通过这些细胞保护基因的表达对抗氧化应激损伤,但是尚需要更多的实验证实。

Fig 5 Effect of different treatments on ΔΨm in H9c2 cells(n=3)
线粒体是缺血性细胞损伤过程中易受累的细胞器之一。ΔΨm的丢失是线粒体受损的早期表现,任何原因引起的线粒体通透性转变孔(mitochondria permeability transition pore,MPTP)的开放以及 H+跨膜梯度的降低均可导致ΔΨm丢失[9]。MPTP的开放及其引起的细胞色素C释放是引起线粒体通路介导的凋亡性细胞死亡的原因。Bialik等[10]研究发现,SGD可引起线粒体功能受损、caspase-3活化及细胞凋亡,这与本文的结果类似。重要的是,本文研究发现CoCl2处理可以减轻SGD引起的ΔΨm丢失,这可能是CoCl2保护心肌细胞的另一重要机制。
为了进一步明确CoCl2处理诱导的心肌细胞保护的分子机制,本文观察了CoCl2对H9c2心肌细胞内HSP90表达的影响。发现SGD处理可明显抑制胞内HSP90的表达,CoCl2不仅本身可以时间依赖性地促进HSP90的表达,而且还可对抗SGD引起的HSP90表达下调。进一步的研究显示,CoCl2对抗SGD对HSP90表达的抑制作用与浓度有关,在50 μmol·L-1时开始起拮抗作用,100 μmol·L-1时达到高峰,200 μmol·L-1时这种拮抗作用开始降低。Latchman等[11]认为,适度地上调HSP的表达可以发挥心肌保护作用。有研究显示[5],过表达HSP90可以抑制缺血/再灌注引起的心肌细胞凋亡。HSP90可以通过稳定HIF-1α从而诱导多种细胞保护基因的表达,其机制与c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)信号通路有关[12]。重要的是,本文还观察了HSP90在CoCl2诱导的心肌细胞保护中的作用,即通过应用HSP90的选择性抑制剂17-AAG预处理H9c2心肌细胞,探讨其对CoCl2诱导的心肌细胞保护作用的影响。结果显示,抑制HSP90后,CoCl2的抗氧化作用、线粒体保护以及细胞存活率的改善作用均被明显减弱。提示低浓度CoCl2的心肌细胞保护作用至少部分地是通过促进HSP90表达而实现的,这与HSP90介导硫化氢心肌细胞保护作用的报道类似[13]。
综上所述,本文的研究首次证实,低浓度CoCl2处理具有对抗SGD引起的心肌细胞损伤的作用。上调心肌细胞内HSP90的表达可能是低浓度CoCl2诱导心肌细胞保护的重要机制之一。然而,CoCl2是通过何种机制诱导HSP90表达的,有待于在以后的实验中深入探讨。
[1] 廖新学,杨春涛,杨战利,等.硫化氢对抗化学性缺氧引起的心肌细胞损伤及其机制[J].中国药理学通报,2009,25(8):1012-7.
[1] Liao X X,Yang C T,Yang Z L,et al.Hydrogen sulfide protects H9c2 cells against chemical hypoxia-induced injury and the underlying mechanisms[J].Chin Pharmacol Bull,2009,25(8):1012 -7.
[2] Xue W,Cai L,Tan Y,et al.Cardiac-specific overexpression of HIF-1alpha prevents deterioration of glycolytic pathway and cardiac remodeling in streptozotocin-induced diabetic mice[J].Am J Pathol,2010,177(1):97 - 105.
[3] Yang Z,Yang C,Xiao L,et al.Novel insights into the role of HSP90 in cytoprotection of H2S against chemical hypoxia-induced injury in H9c2 cardiac myocytes[J].Int J Mol Med,2011,28(3):397-403.
[4] Kupatt C,Dessy C,Hinkel R,et al.Heat shock protein 90 transfection reduces ischemia-reperfusion-induced myocardial dysfunction via reciprocal endothelial NO synthase serine 1177 phosphorylation and threonine 495 dephosphorylation[J].Arterioscler Thromb Vasc Biol,2004,24(8):1435 - 41.
[5] Budas G R,Churchill E N,Disatnik M H,et al.Mitochondrial import of PKCepsilon is mediated by HSP90:a role in cardioprotection from ischaemia and reperfusion injury[J].Cardiovasc Res,2010,88(1):83 -92.
[6] Yao L L,Wang Y G,Cai W J,et al.Survivin mediates the antiapoptotic effect of delta-opioid receptor stimulation in cardiomyocytes[J].J Cell Sci,2007,120(Pt 5):895 -907.
[7] Mousavi S H,Tayarani-Najaran Z,Asghari M,et al.Protective effect of Nigella sativa extract and thymoquinone on serum/glucose deprivation-induced PC12 cells death[J].Cell Mol Neurobiol,2010,30(4):591 -8.
[8] Piret J P,Lecocq C,Toffoli S,et al.Hypoxia and CoCl2protect HepG2 cells against serum deprivation-and t-BHP-induced apoptosis:a possible anti-apoptotic role for HIF-1[J].Exp Cell Res,2004,295(2):340 -9.
[9] Kluck R M,Bossy-Wetzel E,Green D R,et al.The release of cytochrome c from mitochondria:a primary site for Bcl-2 regulation of apoptosis[J].Science,1997,275(5303):1132 -6.
[10] Bialik S,Cryns V L,Drincic A,et al.The mitochondrial apoptotic pathway is activated by serum and glucose deprivation in cardiac myocytes[J].Circ Res,1999,85(5):403 -14.
[11] Latchman D S.Heat shock proteins and cardiac protection[J].Cardiovasc Res,2001,51(4):637 -46.
[12] Zhang D,Li J,Costa M,et al.JNK1 mediates degradation HIF-1alpha by a VHL-independent mechanism that involves the chaperones Hsp90/Hsp70[J].Cancer Res,2010,70(2):813 -23.
[13]孟金兰,兰爱平,杨春涛,等.热休克蛋白90在硫化氢保护PC12细胞对抗化学性缺氧损伤中的作用[J].中国药理学通报,2010,26(1):103 -7.
[13] Meng J L,Lan A P,Yang C T,et al.Role of heat shock protein 90 in protective effect of hydrogen sulfide against PC12 cells injuries induced by chemical hypoxia[J].Chin Pharmacol Bull,2010,26(1):103-7.

