pEGFPN1-dnEGFR对胃癌细胞的放疗增敏作用*
秦 宇,王子卫,杨宁波,查 郎,朱代亮
(重庆医科大学附属第一医院胃肠外科 400016)
胃癌发病率在男性恶性肿瘤中仅次于肺癌占第2位,我国胃癌发病率在居恶性肿瘤的第1位[1]。近年来虽然外科手术、放疗、化疗取得长足进步,然而进展期胃癌的5生存率却不到20%[2]。胃癌的免疫治疗及基因治疗等也伴随着分子生物学和基因工程技术的提高而逐渐成为新型的治疗方法[3]。国外报道表皮生长因子(EGFR)与胃癌的病理临床分期、浸润层次、淋巴转移及预后密切相关[3-5]。以往一直认为胃癌大多为腺癌,对放射线不敏感,故对胃癌很少用放疗。随着放疗设备的更新及放疗技术的改进,开展术前、术中、术后放疗能够提高疗效,放疗对胃癌有了新的应用前景。为此本文研究人EGFR显性负性突变体真核表达载体(pEGFPN1-dnEGFR)对胃癌细胞放疗敏感性的影响,寻求提高胃癌放疗敏感性的新方法,现报道如下。
1 材料与方法
1.1材料 人胃癌细胞株SGC-7901和NCI-N87购自中国科学院,质粒pEGFP-N1购自美国Clontech公司,质粒pEGFPN1-dnEGFR前期试验已构建成功。胎牛血清(FBS)购自杭州四季青公司,MTT、DMSO购自Sigma公司。RNAiso Plus、PrimeScript RT、Premix Taq购自 TaKaRa公司;Bax抗体及Cyclin D1抗体购自碧云天公司。配胶试剂盒、蛋白定量试剂盒、ECL发光试剂盒购自碧云天,PVDF膜(Millipore,美国)。
1.2方法
1.2.1细胞培养 细胞用含10%FBS的RPMI 1640培养基于37℃,5%CO2恒温孵箱中培养,选用对数生长期细胞进行试验。将SGC-7901、NCI-87两种胃癌细胞分别分为3组:未处理组、pEGFP-N1空载体质粒转染组(空质粒组)、pEGFPN1-dnEGFR质粒转染组(目的质粒组)。
1.2.2放疗方法 采用60Co放疗机(GWGP-80,中国),6MV的X射线,在源皮距为100cm、射野20cm×20cm下对指数生长期的稳定细胞株室温下分别采用2、4、6、8、10Gy剂量照射,并设立未照射组。
1.2.3MTT法检测抑制率 将各组细胞(1×105/mL)接种于96孔培养板内,每孔100μL。每组设3个平行孔。在CO2孵箱中培养72h后每孔加入MTT溶液20μL,继续孵育4h,弃上清液加入二甲基亚砜,每孔100μL,在微量震荡仪上轻微震荡至结晶物充分溶解。酶标仪检测570nm处各孔吸光度(A值),抑制率=(1-实验组A570/对照组A570)×100%。
1.2.4RT-PCR检测Bax、Cyclin D1基因表达 引物序列设计如下。Bax基因上游:5′-GCA AAC TGG TGC TCA AGG C-3′,下游:5′-AGA AAC ACC GCC CTC ACG-3′,产物大小189bp;Cyclin D1基因上游:5′-GGA TGC TGG AGG TCT GCG AGG AAC-3′,下 游:5′-GAG AGG AAG CGT GTG AGG CGG TAG-3′,产物大小514bp;β-action基因上游:5′-GCA AAC TGG TGC TC-3′,下 游:5′-GAT CCA CAT CTG GAA-3′,产物大小500bp。PCR扩增条件:94 ℃预变性5 min,进入循环94℃变性30s,55℃退火30s,72℃延伸30s,共30个循环,最后72℃延伸10min。取5μL产物行2%琼脂糖凝胶电泳。Quantity One软件分析图片,以各产物与β-action丰度的比值作为表达水平的参数。实验重复3次。
1.2.5Western blot检测 Bax、Cyclin D1蛋白表达 收集细胞,提取总蛋白,加适量上样缓冲液,煮沸变性,配制浓缩胶和4%~12% 的分离胶(内参7-actin为5%浓缩胶和8%分离胶),电泳60V30min,160V140min(内参60V30min,160 V 90min)。电泳结束后,22V100min(内参15V,15min)恒压半干转膜,封闭2h,以鼠抗人MMP-2单抗、鼠抗人caspase-3抗体和鼠抗人Cyclin D1抗体作为一抗(1∶100稀释),4℃反应过夜,PBST洗膜4次,每次20min。再加入兔抗鼠二抗(1∶1 000稀释),37℃孵育90min,洗膜同前。采用Pierce化学发光试剂盒进行显色。实验重复3次。
1.3统计学处理 采用SPSS17.0软件进行统计分析,计量资料用s表示,各组间均数比较采用t检验,计数资料比较采用配对χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1MTT法检测X射线照射对各组细胞的抑制影响 相同剂量X射线照射下,目的质粒组细胞对X射线敏感性均显著高于空质粒组和未处理组(P<0.05),空质粒组和未处理组之间比较差异无统计学意义(P>0.05)。见表2、3。
2.2RT-PCR检测X射线照射后各组细胞Bax mRNA和Cyclin D1mRNA相对含量 经X射线照射后目的质粒组的Bax mRNA表达明显升高,而Cyclin D1mRNA表达则明显降低(P<0.05)。空质粒组和未处理组差异无统计学意义(P>0.05)(图1、2)。照射后各组细胞的基因相对表达强度,见表4。
2.3Western blot检测X射线照射后各组细胞Bax蛋白和Cyclin D1蛋白表达水平 经X射线照射后目的质粒组的Bax蛋白表达明显升高,Cyclin D1蛋白表达则明显降低。X射线照射后空质粒组和未处理组差异无统计学意义(P>0.05)(图3、4)。X射线照射后各组细胞的蛋白表达相对强度,见表5。
表2 SGC-7901细胞经X射线照射处理后的抑制率(s,%)

表2 SGC-7901细胞经X射线照射处理后的抑制率(s,%)
*:P<0.05,与未处理组和空质粒组比较。
X射线照射剂量(Gy)未处理组 空质粒组 目的质粒组**
表3 NCI-N87细胞经X射线照射处理后的抑制率(s,%)

表3 NCI-N87细胞经X射线照射处理后的抑制率(s,%)
*:P<0.05,与未处理组和空质粒组比较。
X射线照射剂量(Gy)未处理组 空质粒组 目的质粒组**

图1 pEGFPN1-dnEGFR对胃癌细胞株SGC-7901中Bax和Cyclin D1mRNA表达的影响
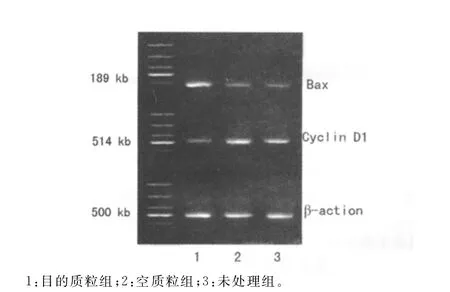
图2 pEGFPN1-dnEGFR对胃癌细胞株NCI-N87中Bax和Cyclin D1mRNA表达的影响
表4 两种胃癌细胞各组基因表达相对强度比较(s)

表4 两种胃癌细胞各组基因表达相对强度比较(s)
*:P<0.05,与未处理组和空质粒组比较。
基因SGC-7901 NCI-N87未处理组 空质粒组 目的质粒组Bax 0.41±0.05 0.34±0.09 1.21±0.15* 0.39±0.02 0.48±0.05 1.15±0.09未处理组 空质粒组 目的质粒组*Cyclin D1 1.08±0.11 1.11±0.11 0.24±0.04* 1.04±0.13 0.98±0.18 0.41±0.07*
表5 两种胃癌细胞各组蛋白表达相对强度比较(s)

表5 两种胃癌细胞各组蛋白表达相对强度比较(s)
*:P<0.05,与未处理和空质粒组比较。
蛋白SGC-7901 NCI-N87未处理组 空质粒组 目的质粒组Bax 0.32±0.13 0.26±0.06 0.95±0.09* 0.32±0.09 0.24±0.06 0.95±0.21未处理组 空质粒组 目的质粒组*Cyclin D1 0.56±0.21 0.61±0.09 0.24±0.07* 0.98±0.24 0.89±0.21 0.28±0.15*

图3 pEGFPN1-dnEGFR对胃癌细胞株SGC-7901中Bax和Cyclin D1蛋白表达的影响

图4 pEGFPN1-dnEGFR对胃癌细胞株NCI-N87中Bax和Cyclin D1蛋白表达的影响
3 讨 论
EGFR在胃癌组织中的表达率为40%~65%,EGFR信号转导通道参与细胞分裂、侵袭、血管形成等过程[6]。Lieto等[7]和Gennaro等[8]发现EGFR高表达促使胃癌细胞增殖、凋亡抑制,并与胃癌病理和临床分期相关。Cunninghem等[9]研究发现EGFR表达阴性的患者比阳性患者的肿瘤相关死亡相对危险明显降低。目前,EGFR的生物阻滞剂作为胃癌的治疗药物正逐渐应用于临床[10-11]。显性负性策略是指通过基因工程技术获得特定受体的显性负性突变体,从而产生负性调节效应[12]。dnEGFR能够诱导胃癌细胞凋亡,使胃癌细胞侵袭能力降低,对胃癌细胞恶性表型具有部分逆转作用[13-14]。
本研究发现,dnEGFR导入人胃癌细胞SGC-7901和NCIN87后,Cyclin D1的基因和蛋白表达水平降低。因此,本研究认为可能dnEGFR与EGFR竞争结合上皮生长因子(EGF),EGF的缺乏使 GSK-3β激活使 Cyclin D1-CDK4/6含量减少,Cyclin D1表达水平降低。
Li等[15]研究显示,Bax基因能够激活Caspase家族启动凋亡程序,裂解蛋白酶基板和释放Cyt-c,最终导致染色质凝集、细胞核崩解。本研究发现,dnEGFR目的质粒组Bax mRNA/蛋白的表达水平高于未经任何处理的野生型细胞,本研究认为可能dnEGFR诱导人胃癌凋亡是通过上调Bax基因/蛋白的表达水平从而激活Caspase家族来实现的,这从另外一个角度进一步证实了凋亡相关基因在dnEGFR诱导肿瘤细胞凋亡中扮演角色。
本实验发现dnEGFR能够显著提高两种胃癌细胞对X射线放疗的敏感性。尽管dnEGFR增强放疗的具体机制并不明确,但是本研究在体外初步证实了dnEGFR转染两种胃癌细胞后,胃癌细胞对放疗的敏感性显著提高,抑制胃癌生长和诱导凋亡,这为今后针对dnEGFR的靶向治疗以及联合放疗的研究提供了一定的理论依据。
[1]Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics 2002[J].CA Cancer J Clin,2005,55(2):74-108.
[2]Berardi R,Scartozzi M,Romagnoli E,et al.Gastric cancer treament:a systematic review[J].Oncol Rep,2004,11(4):911-916.
[3]Gamboa-Dominguez A,Dominguez-Fonseca C,Quintanilla-Martinez L,et al.Epidermal growth factor receptor expression correlated with poor survival in gastric adenocarcinoma from Mexican patients:a multivariate analysis using a standardized immunohistochemical detection system[J].Mod Pathol,2004,17(5):579-587.
[4]Ito R,Nakayama H,Yoshida K,et al.Expression of Cbl linking with the epidermal growth factor receptor system is associated with tumor progression and poor prognosis of human gastric carcinoma[J].Virchows Arch,2004,444(4):324-331.
[5]Sako Y,Minoghchi S,Yanagida T.Single-molecule imaging of EGFR signalling on the surface of living cells[J].Nat Cell Biol,2000,2(1):168-172.
[6]王国栋,李侠,王连聪,等.胃癌组织EGFR和VEGF的表达及其意义[J].实用肿瘤杂志,2009,24(1):34-39.
[7]Lieto E,Ferraraccio F,Orditura M,et al.Expression of vascular endothelial growth factor(VEGF)and epidermal growth factor receptor(EGFR)is an independent prognostic indicator of worse outcome in gastric cancer patients[J].Ann Surg Oncol,2008,15(1):69-79.
[8]Gennaro G,Lieto E,Michele O,et al.Epidermal growth factor(EGFR)expression is associated with aworse prognosis in gastric cancer patients undergoing curative surgery[J].World J Surg,2007,31(7):1458-1468.
[9]Cunningham D,Humblet Y,Siena S,et al.Cetuximab monotherapy and cetuximab plus irinotecan in irinotecanrefractory metastatic colorectal cancer[J].N Engl J Med,2004,351(4):337-345.
[10]Shepherd FA,Rodrigues Pereira J,Ciuleanu T,et al.Erlotinib in previously treated non-small-cell lung cancer[J].N Engl J Med,2005,353(2):123-132.
[11]Ott D,Taraborrelli C,Aguzzi A.Novel dominant negative prion protein mutants identified from a randomized library[J].Protein Eng Des Sel,2008,21(10):623-629.
[12]Gang L,Ziwei W,Lin Z,et al.Inhibitory effects of cytoplasmic-domain substituted epidermal growth factor on growth,invasion and angiogenesis of human gastric cancer cells[J].Mol Med Report,2010,3(2):287-294.
[13]Chan JK,Pham H,You XJ,et al.Suppression of ovarian cancer cell tumorigenicity and evasion of cisplatin resistance using a truncated epidermal growth factor receptor in a rat model[J].Cancer Res,2005,65(8):3243-3248.
[14]Lukas J,Bartbova J,Rohde M,et al.Cyclin D1is dispensable for G1control in retinoblastoma gene-deficient cells independently of cdk4activity[J].Mol Cell Biol,1995,15(5):2600-2611.
[15]Li X,Marani M,Yu J,et al.Adenovirus-mediated Bax overexpression for the induction of therapeutic apoptosis in prostate cancer[J].Cancer Res,2001,61(1):186-191.

