普罗布考不同预处理疗程对肝硬化大鼠肝脏缺血再灌注损伤保护作用的研究*
王金涛,郑 军△,郑卫红,刘 伟,罗春华,王雅琴
(1.三峡大学第一临床医学院普外科,湖北宜昌443003;2.三峡大学医学院药理研究室,湖北宜昌443002;3.三峡大学第一临床医学院检验科,湖北宜昌443003;4.三峡大学医学院病理研究室,湖北宜昌443002)
普罗布考(Probucl)具有较强的抗氧化剂作用,除了具有减少氧自由基、丙二醛(MDA)、氧化性低密度脂蛋白(ox-LDL)及肿瘤坏死因子-α(TNF-α)的合成与释放,以及降低超氧化物歧化酶(SOD)的过度消耗之外,新近研究还表明,其对心、肾、脑等脏器的缺血再灌注(ischemia/reperfusion,I/R)损伤有保护作用[1-2]。本研究选择普罗布考预处理肝硬化大鼠,观察其不同预处理疗程对硬化肝脏I/R损伤的保护作用及探讨其可能机制,现报道如下。
1 材料与方法
1.1实验动物 健康雄性Wistar大鼠50只,6~8周龄,体质量(220±20)g,购于湖北省实验动物研究中心。
1.2药品和试剂 普罗布考片(齐鲁制药厂),分析纯CCl4,橄榄油。血清学检测,于三峡大学第一临床医学院临床检验中心检测。SOD、MDA、髓过氧化物酶(MPO)试剂盒(南京建成生物工程研究所)。
1.3模型建立及分组
1.3.1肝硬化模型的建立 Wistar大鼠自购回后适应性喂养1周,给予单因素法CCl4-橄榄油溶液腹腔注射法肝硬化造模。具体方法为:首次腹腔注射40%CCl4-橄榄油溶液2.5 mL/kg,后每3天腹腔注射CCl4-橄榄油溶液2.0mL/kg,共用药8周死亡率为20%,剩余40只,随机选择10只病理切片证实肝硬化成模率100%。
1.3.2实验分组 取剩余30只肝硬化大鼠随机分为5组(n=6)。(1)假手术组(A组),不进行任何药物处理,开腹后不阻断肝门;(2)对照组(B组),同剂量生理盐水(1mL/100g体质量)灌胃处理,再进行肝门阻断;(3)短期预处理组(C组),术前10日每天普罗布考-生理盐水溶液灌胃给药,再进行肝门阻断;(4)中期预处理组(D组),术前20d每天普罗布考-生理盐水溶液灌胃给药,再进行肝门阻断。(5)长期预处理组(E组),术前30d,每天普罗布考-生理盐水溶液灌胃给药,再进行肝门阻断。
1.3.3普罗布考预处理 参照文献[3]普罗布考大鼠灌胃剂量为500mg·kg-1·d-1,使用前用生理盐水配成25mg/mL溶液,给予大鼠1mL/100g灌胃处理,2次/日。
1.3.4大鼠肝脏I/R模型的建立 术前禁食8h,自由饮水,3%戊巴比妥那(30~50mg/kg)腹腔注射麻醉,常规消毒铺巾,上腹正中切口进腹,参照Pringle法建立大鼠70%肝脏I/R模型[4],以无菌橡皮筋缠绕肝门做肝门阻断,阻断肝门30min后,恢复入肝血流2、4h。
1.4标本处理及检测指标 分别于术前1d及再灌注2h时,在大鼠颈静脉体外穿刺采血1.5mL,再灌注4h时将各组大鼠迅速处死,下腔静脉采血2mL后,随即切取肝脏标本,部分用于检测SOD、MDA、MPO;部分用于普通光学显微镜下观察;部分用于电镜下观察。所采血液标本均常温下放置60 min,以3 000r/min离心10min,取上层血清,进行血清学检测。
1.5统计学处理 采用SPSS11.0软件进行统计分析。数据以s表示,采用单因素方差分析,组间两两比较,方差齐时用LSD法和SNK法进行,方差不齐时用Tamhane′s T2检验。以P<0.05为差异有统计学意义。
2 结 果
2.1各组大鼠手术前后各时间点血清ALT、AST、LDH及AKP的水平 术前1d各组大鼠血清ALT、AST、LDH及AKP的水平差异无统计学意义。再灌注2h,B、C、D组ALT、AST及LDH水平均明显高于 A组(P<0.01),A、C、D、E组ALT及LDH水平均明显低于B组(P<0.05);AKP水平B组高于 A、E组(P<0.05)。再灌注4h,B、C、D组 ALT、AST及LDH水平均明显高于 A组(P<0.05),A、D、E组 ALT、AST、LDH 及 AKP水平均明显低于 B组(P<0.01),见表1~4。
2.2各组大鼠再灌注4h后肝组织中SOD、MDA及MPO的活性测定 B、C、D组SOD活性均明显低于A组(P<0.01),A、E组SOD活性均明显高于 B组(P<0.01);B、C、D、E组MDA活性均明显高于 A组(P<0.01),A、D、E组 MDA及MPO活性均明显低于B组(P<0.01);B、C组 MPO活性均明显高于A组(P<0.01),见表5。
2.3病理组织学改变 HE染色后切片光镜下观察,各组大鼠肝组织均呈典型肝硬化表现。A组:假小叶形成,炎性反应轻微,胆管增生,未见明显肝细胞坏死区;B组:假小叶形成,炎性反应非常明显,并且出现炎性反应带,肝细胞大量坏死,肝索排列紊乱;C组:假小叶形成,脂肪变性,炎性反应稍轻,肝窦充血扩张和点状肝细胞肿胀变性及坏死;D组:假小叶形成,肝细胞核固缩,炎性反应轻微;E组:较B、C、D组的损害程度为轻(封2图1、封3图2)。


表1 各组大鼠手术前后各时间点血清ALT水平(s,U/L,n=6)

表1 各组大鼠手术前后各时间点血清ALT水平(s,U/L,n=6)
#:P<0.01,与A组比较;△:P<0.05,▲:P<0.01,与B组比较。
1d 2h 4h A组 136.17±43.59 135.50±43.39▲ 156.50±49.40组别 术前▲B组 134.83±37.69 733.17±168.62# 1035.17±185.14#C组 135.00±33.88 410.00±32.79#△ 710.67±83.91#D组 128.50±36.48 280.50±31.71#△ 393.50±81.96#▲E组 137.33±41.21 228.17±73.54▲ 305.33±34.67▲
表2 各组大鼠手术前后各时间点血清AST水平(s,U/L,n=6)

表2 各组大鼠手术前后各时间点血清AST水平(s,U/L,n=6)
#:P<0.01,与A组比较;△:P<0.05,▲:P<0.01,与B组比较。
2h 4h A组 271.17±58.97 274.83±61.98▲ 277.83±61.13组别 术前1日▲B组 271.50±38.56 1 066.67±239.93# 1 253.83±258.27#C组 260.83±58.96 680.67±151.05# 808.50±159.59#D组 297.50±21.53 439.00±50.56#△ 563.50±84.84#▲E组 261.00±46.81 392.17±73.05▲ 480.50±107.89▲
表3 各组大鼠手术前后各时间点血清LDH水平(s,U/L,n=6)
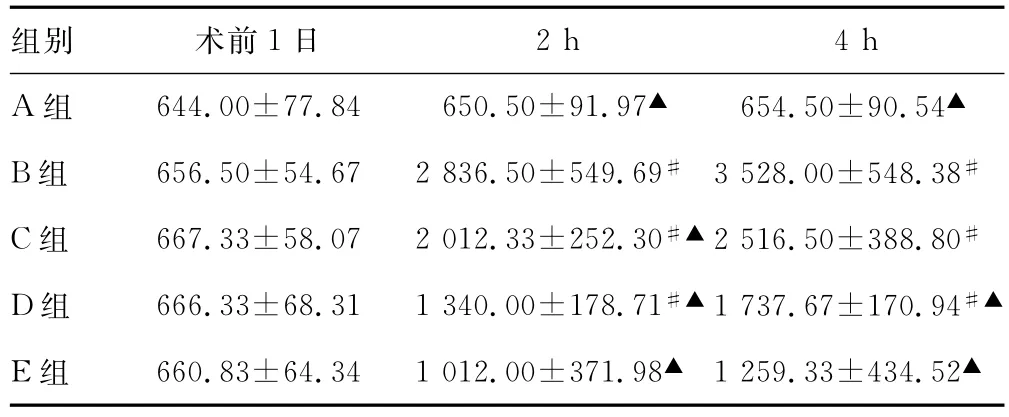
表3 各组大鼠手术前后各时间点血清LDH水平(s,U/L,n=6)
#:P<0.01,与A组比较;▲:P<0.01,与B组比较。
2h 4h A组 644.00±77.84 650.50±91.97▲ 654.50±90.54组别 术前1日▲B组 656.50±54.67 2 836.50±549.69# 3 528.00±548.38#C组 667.33±58.07 2 012.33±252.30#▲2 516.50±388.80#D组 666.33±68.31 1 340.00±178.71#▲1 737.67±170.94#▲E组 660.83±64.34 1 012.00±371.98▲ 1 259.33±434.52▲
表4 各组大鼠手术前后各时间点血清AKP水平(s,U/L,n=6)

表4 各组大鼠手术前后各时间点血清AKP水平(s,U/L,n=6)
#:P<0.01,与A组比较;△:P<0.05,▲:P<0.01,与B组比较。
2h 4h A组 144.50±29.30 144.00±40.43△ 148.67±39.08组别 术前1日▲B组 156.67±24.95 188.83±38.97 239.33±37.42#C组 165.00±29.03 179.50±26.36 227.83±35.61#D组 150.83±14.20 158.00±16.49 172.00±18.78▲E组 141.00±26.25 145.50±30.80△ 158.33±31.43▲
2.4各组大鼠肝脏细胞电镜下超微结构改变 A组线粒体轻微肿胀,嵴清晰,粗面内质网结构尚可,未见扩张;与A组相比,B组线粒体结构模糊,嵴断裂消失,粗面内质网数量大量减少,脱颗粒明显,胞质内水肿严重;C、D组线粒体与内质网较B组形态为好,粗面内质网有脱颗粒现象;E组形态趋于A组形态,线粒体肿胀明显减轻,嵴较少断裂,内质网轻度扩张,见图3。
表5 各组大鼠再灌注4h后肝组织中SOD,MDA及MPO的含量测定(s,n=6)

表5 各组大鼠再灌注4h后肝组织中SOD,MDA及MPO的含量测定(s,n=6)
*:P<0.01,与A组比较;#:P<0.01,与B组比较。
组别 SOD(nmol/mgProt)MDA(nmol/mgProt)MPO(U/g)A组 230.33±42.61# 1.32±0.18# 1.04±0.16#B组 139.67±30.85* 2.38±0.26* 1.55±0.20*C组 156.50±37.99* 2.22±0.15* 1.38±0.19*D组 172.00±18.78* 1.82±0.13*# 1.20±0.12#E组 204.00±39.35# 1.75±0.16*# 1.17±0.12#

图3 透射电子显微镜下各组肝细胞超微结构(×20k)
3 讨 论
如何防治硬化肝脏I/R损伤是处理各种肝脏切除、肝移植术后一系列后续问题的关键所在。目前肝脏I/R损伤机制还不明确,缺乏特异性防治措施,目前最为有效的手段就是药物预处理。
通过对I/R损伤发病机制的不断研究发现,I/R损伤过程中的肝脏处于相对缺氧的微环境,从而导致内源性抗氧化剂的缺失和氧化应激反应[5-6]。抗氧化剂已经被明确证实,可以通过改善内源性亲氧化剂与抗氧化剂之间的平衡,削弱氧化应激反应梯度,降低Kupffer细胞线粒体内源性活性氧的生产,减少肝细胞的炎性反应及凋亡[7-8]。实验证明,抗氧化剂在防治I/R损伤的作用越来越受到重视,而普罗布考是目前可用于临床的抗氧化作用最强的人工合成抗氧化剂,其在大鼠离体心脏I/R过程中,可以通过增加内源性抗氧化剂储备来降低I/R损伤;能明显改善肝损伤患者的肝功能储备;还可以抑制在I/R损伤过程中过渡表达的TNF-α诱导的内皮细胞凋亡[9-12]。
为了探讨普罗布考不同预处理疗程对硬化肝脏I/R损伤是否具有保护作用及能否常规用于肝门阻断术前,作者设计并完成了本实验。
当肝细胞发生损伤或坏死时,血清ALT、LDH、AKP及AST水平是目前临床上反映急、慢性肝损伤程度的敏感指标。SOD可以明显减少氧化应激反应中产生的氧自由基,从而减轻对正常细胞的攻击;MDA影响线粒体呼吸链复合物及线粒体内关键酶活性,具有细胞毒性;每个中性粒细胞中MPO的含量相对恒定,因此组织中MPO的含量基本可定量组织中中性粒细胞的数量[13],从而间接判断炎性反应以及肝脏受损的程度。图1及图2显示了普罗布考不同疗程预处理(C、D、E组)的大鼠肝脏细胞浸润、肝窦充血扩张和肝细胞肿胀变性坏死程度明显轻于B组。这表明普罗布考预处理可以显著减轻I/R损伤,对肝脏I/R具有明确的保护作用。
普罗布考在对大鼠硬化肝脏I/R损伤之前,就预先启动内源性保护机制[14],从而阻止I/R与肝损害之间的恶性循环,明显保护肝细胞损伤时线粒体的超微结构。
通过以上实验数据及观察表明:本研究证明抗氧化剂普罗布考在中长疗程(20、30d)预处理大鼠硬化肝脏I/R损伤时具有保护作用,其机制可能是:(1)通过增加内源性抗氧化剂的储备,降低SOD的过度消耗;(2)显著降低大鼠硬化肝脏I/R过程组织中MPO含量,从而抑制中性粒细胞浸润,降低对肝组织的损伤;(3)通过减少氧自由基及其攻击生物膜中的多不饱和脂肪酸形成的MDA,进一步减轻I/R对肝脏组织造成的损伤。存在局限性是:人鼠存在差异,普罗布考是否在临床上对硬化肝脏I/R损伤具有保护作用,这些都有待大量的实验研究,为最终的临床应用提供理论基础。
[1]Ruixing Y,Al-Ghazali R,Wenwu L,et al.Pretreatment with probucol attenuates cardiomyocyte apoptosis in a rabbit model of ischemia/reperfusion[J].Scand J Clin Lab Invest,2006,66(7):549-558.
[2]Hoshida S,Yamashita N,Igarashi J,et al.Long-term probucol treatment reverses the severity of myocardial injury in watanabe heritable hyperlipidemic rabbits[J].Arterioscler Thromb Vasc Biol,1997,17(11):2801-2807.
[3]杜九中,李双杰,周京敏.普罗布考对小鼠柯萨奇B3病毒性心肌炎的治疗作用[J].中华实用诊断与治疗杂志,2009,23(9):232-233.
[4]Yang YL,Li JP,Xu XP,et al.Protective effects of tumor necrosis factor antibody and ulinastatin on liver ischemic reperfusion in rats[J].World J Gastroenterol,2004,10(21):3161-3164.
[5]Bhogal RH,Curbishley SM,Weston CJ,et al.Reactive oxygen species mediate human hepatocyte injury during hypoxia/reoxygenation[J].Liver Transpl,2010,16(11):1303-1313.
[6]高元兴,秦华东,刘冬冬,等.抗氧化剂在降低肝缺血再灌注损伤中的作用[J].中国组织工程研究与临床康复,2009,13(5):911-914.
[7]Videla LA.Cytoprotective and suicidal signaling in oxidative stress[J].Biol Res,2010,43(3):363-369.
[8]Allan PF,Bloom BB,Wanek S.Reversal of hemorrhagic shock-associated hepatic ischemia-reperfusion injury with N-acetylcysteine[J].Mil Med,2011,176(3):332-335.
[9]Muriel P.Role of free radicals in liver diseases[J].Hepatol Int,2009,3(4):526-536.
[10]杨世杰.药理学[M].北京:人民卫生出版社,2005:343.
[11]Merat S,Aduli M,Kazemi R,et al.Liver histology changes in nonalcoholic steatohepatitis after one year of treatment with probucol[J].Dig Dis Sci,2008,53(8):2246-2250.
[12]段纬喆.辛伐他汀和普罗布考对TNF-α诱导的内皮细胞凋亡的影响[D].湖南:中南大学,2010.
[13]Locatelli F,Gauly A,Czekalski S,et al.The MPO Study:just a Eur opean HEMO Study or something very different?[J].Blood Purif,2008,26(1):100-104.
[14]Kumar D,Kirshenbaum LA,Li T,et al.Apoptosis in adriamycin cardiomyopathy and its modulation by probucol[J].Antioxid Redox Signal,2001,3(1):135-145.

