PRP对人皮肤成纤维细胞增殖、体外合成胶原与透明质酸的影响
常毅 邓辰亮 屈悦 郑江红 万伟东 杨松林
皮肤衰老与胶原蛋白、透明质酸的含量明显减少紧密相关。胶原作为一种结构蛋白,广泛存在于动物的皮肤、肌腱和其他结缔组织中。富含胶原蛋白的组织很容易表现出一些与年龄相关的生理变化。因此,胶原蛋白一直被当作探讨衰老机制的重要指标而备受重视[1,2]。 透明质酸(Hyaluronic acid,HA),是一种大分子酸性粘多糖,广泛存在于生物体的结缔组织中,皮肤中HA含量丰富。皮肤中HA含量的减少及破坏,可造成皮肤失水[3],弹性纤维和胶原纤维发生断裂老化[4],降低皮肤吸收性,使人表皮衰老,如果把20岁的人体内HA相对含量定为100%,则30岁、50岁和60岁时分别下降为65%、45%和25%。当皮肤衰老时,皮肤胶原蛋白与HA的含量会明显减少。
富血小板血浆(Platelet-rich plasma,PRP)是全血经过分离而得到的血小板浓缩物。众所周知,血小板在愈合过程中具有抗炎、促血管再生及组织修复的功能[5]。研究显示,PRP中血小板计数是普通全血中的4.38倍[6]。临床证据显示,PRP对硬组织及软组织明显有效的治疗作用是由于生长因子(GFs)储存于血小板中。当生长因子从血小板中释放出来,可以引发组织再生程序[7-8]。另外,PRP中含有其他内在和外在的血小板成分也能促进组织再生[9]。PRP中最主要的成分是血小板、白细胞和纤维蛋白。此外,血小板激活的过程中,通过脱颗粒作用释放大量的生长因子,如血小板源性生长因子(PDGF)、转移生长因子-β(TGF-β)、胰岛素样生长因子(IGF)、表皮生长因子(EGF)和血管内皮细胞生长因子(VEGF)等[10],还有纤维连接蛋白 (FN)、血小板反应蛋白(Thrombospondin,TSP)、 骨连接蛋白(Osteonectin,ON)、玻璃体连接蛋白(Vitronectin,VN)等。
由于PRP来源于自体,制作简单,且安全有效,已广泛运用于整形外科、骨科、血管外科、口腔科、颌面外科和胸外科等[11-16]。同时,各种关于PRP的基础研究也都展开,其中细胞实验包括了PRP对成纤维细胞、内皮细胞、角质细胞和上皮细胞、神经细胞的研究;动物实验涉及到PRP促进大鼠肠吻合和心肌损伤的修复、促进犬牙周组织的修复、促进大鼠神经组织的修复、对角膜穿孔及兔板层角膜移植术的辅助治疗等[17-25]。其中,PRP对齿龈成纤维细胞的促进增殖作用及对牙周组织的修复作用引起了我们的关注。本实验旨在探讨PRP能否通过促进人皮肤成纤维细胞增殖,及其有效成分的合成释放,以缓解皮肤老化的程度。
1 材料和方法
1.1 实验材料与仪器
胎牛血清(上海洛神生物科技有限公司);高糖DMEM培养基(Gibco公司,美国);透明质酸酶(Sigma公司,美国);96孔培养板、T75细胞培养瓶(Corning 公司,美国);0.22 μm 一次性滤器(Millipore公司,瑞士);Trizol试剂(Invitrogen 公司,美国);焦碳酸二乙酯(Amersco公司,美国);PCR引物(上海生工生物技术服务有限公司);逆转录试剂盒、PCR扩增试剂盒、DNA Marker、6× loading buffer(大连宝生物工程有限公司);琼脂糖(Biowest公司,西班牙)。
CO2恒温培养箱(Thermo Fisher公司,美国);超净工作台(苏州净化设备厂);恒温水浴箱(上海精宏实验仪器厂);离心机 (上海安亭实验仪器厂);XK 96-3型微量振荡器 (姜堰市新康医疗器械有限公司);高压锅 (Sanyo公司,日本);Milli-Q纯水机(Millipore公司,美国);蜗旋器(海门市麒麟医用仪器厂);高速低温离心机、普通PCR仪、紫外/可见分光光度计(Eppendorf公司,德国);水平电泳系统(北京六一仪器厂);凝胶成像系统 (Syngene公司,美国);全波长酶标仪(Bio-tek公司,美国);流式细胞仪(Beckman 公司,美国)。
1.2 PRP的制备及稀释
用预先装有3.0 mL ACD-A抗凝剂的50 mL针筒,以18 G针头取患者全血(获知情同意)30 mL,平均注入6支塑料离心管,以Aghallo法进行离心。分2次离心,第一次215 g离心10 min,吸取全部上清液至交界面下约3 mm,移至另一离心管,平衡后再次离心,第二次863 g离心10 min,离心管中液体分为两层,上层上清液为贫血小板血浆 (Plateletpoor plasma),下层为血小板浓缩物(Platelet concentrate,PC)。吸取约3/4上清液弃掉,剩余约0.7 mL摇匀,即PRP。
1.3 胶原蛋白酶消化培养
标本取自健康患者上睑或下睑手术时切除的皮肤,患者年龄20~56岁,获患者知情同意。将获取的皮肤置于含有青霉素(100 KU/L)和链霉素(100 mg/L)的PBS中反复漂洗后,去除皮下脂肪。将皮条剪成2 mm×6 mm的小条,以0.25%DispaseⅡ4℃消化8~11 h,用尖镊将表皮揭下,将分离的真皮用组织剪充分剪碎,置于0.1%Ⅰ型胶原酶中,37℃消化3.5 h,用吸管轻轻反复吹打,至上清浑浊,通过100目无菌不锈钢纱网过滤,离心10 min(1 000 r/min),台盼蓝染色,计数未着色细胞,以6×104cells/cm2的密度分别接种于T75培养瓶中,在 37℃、5%CO2培养箱中以15 mL的DMEM/F12进行培养,培养4 h后更换培养液,以后每周更换2~3次。
1.4 MTT法检测PRP对细胞增殖能力的影响
通过标准曲线确定每孔细胞数为1×104个。原代细胞胰酶消化,用DMEM/F12培养液配成单细胞悬液,以每孔1×104个细胞接种于96孔培养板中,接种3组,每组8个复孔,分别标记为1%、5%、10%、20%、30%、50%、-、+。第 2天,弃上清液,加入培养液及 PRP,用含不同浓度 PRP(1%、5%、10%、20%、30%、50%)的培养液进行细胞培养,无血清培养液为阴性对照,含10%新生小牛血清的培养液为阳性对照。第1组在加样培养3 d后,取出培养板进行检测。 每孔加入 MTT 溶液(5 g/L)20 μL,继续培养 4 h,终止培养,小心吸弃孔内培养上清液。每孔加入150 μL 二甲基亚砜(DMSO),振荡 10 min,使结晶物充分溶解。选择490 nm波长,用酶联免疫检测仪测定各孔光吸收值(A值)。进行统计学分析。第2组和第3组分别在加样后第5天、第7天进行同样操作。
1.5 RT-PCR检测胶原蛋白表达
原代细胞胰酶消化,用DMEM/F12培养液配成单细胞悬液,以每孔2×106个细胞接种于6孔培养板的3个孔中,分别标记为50%、-、+。第2天弃液,往“50%”孔中加入1 mL DMEM/F12和1 mL PRP;往“-”孔中加入 2 mL DMEM/F12;往“+”加入 2 mL 10%新生小牛血清,放入37℃、5%CO2培养箱中培养,隔天按相同方法换液。第5天根据Trizol试剂盒说明书提取细胞总RNA。以MQ水作为空白对照,分别记录RNA浓度及A260 nm/A280 nm。使用反转录酶分离RNA转化为cDNA。目的基因在Pubmed中得到序列号,通过Primer Premier 5.0软件设计COL1、COL3以及内参GAPDH的引物。然后使用Taq酶试剂盒及引物进行PCR反应。
1.6 ELISA分析测量HA
HA的分析测量使用特殊的酶联蛋白试剂盒。100 μL的样本加入96孔板,包括阴性对照组和阳性对照组,稀释缓冲液为空白对照组。除空白对照组外均加入50 μL的检测缓冲液。轻柔混匀,盖板,37℃恒温孵育30 min。孵育之后弃液,用缓冲液冲洗4次,每孔加入100 μL的有效酶。混匀后,加盖,37℃孵育30 min。然后,用冲洗缓冲液将检测板清洗4次,每孔加入100 μL酶作用物。暗室恒温孵育后,加入50 μL的反应终止溶液终止反应。15 min内,在405 nm波长下观察吸光率,测出HA的浓度。
1.7 统计分析
SPSS 11.0统计软件进行t检验,P<0.01为差异具有统计学意义。
2 结果
2.1 MTT法检测PRP对细胞增殖能力的影响
MTT结果显示,随细胞培养时间延长,细胞增殖数量增加;伴随PRP浓度的增加,细胞增殖有增强的趋势。PRP浓度在30%和50%时,细胞增殖最为明显(图 1)。
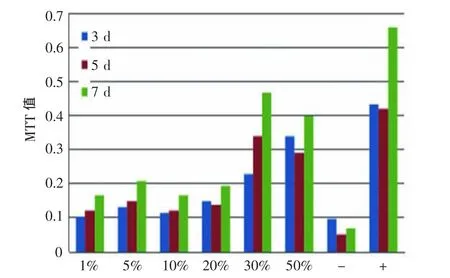
图1 MTT法检测培养第3、5、7天时各组细胞的增殖能力Fig.1 The proliferation of HSFs measured by MTT assay at the 3rd,5th and 7th day after culture
2.2 RT-PCR检测胶原蛋白表达
RT-PCR结果显示,目的基因COL1与COL3在50%PRP浓度组及阴性、阳性对照组中均显著表达,3组间未见明显差异(图2)。
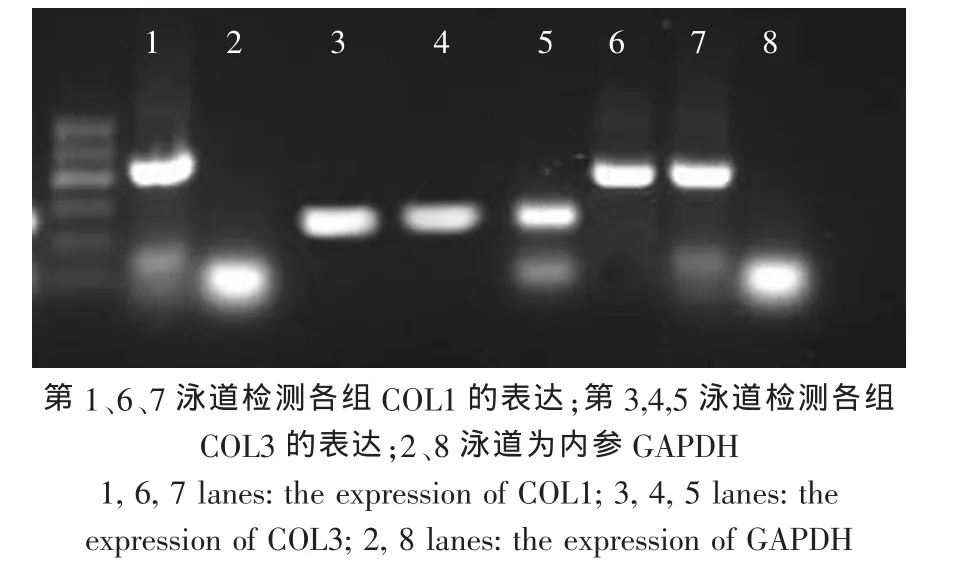
图2 RT-PCR检测目的基因COL1与COL3在50%PRP浓度组及阴性、阳性对照组中的表达Fig.2 The expression of COL1 and COL3 in the 50%PRP group,negative control group and positive control group
2.3 ELISA测量透明质酸含量
随细胞培养时间增加,HA量增加;伴随PRP浓度的增加,HA量有增加的趋势;在PRP浓度达到30%~50%时,增加幅度明显(图3)。
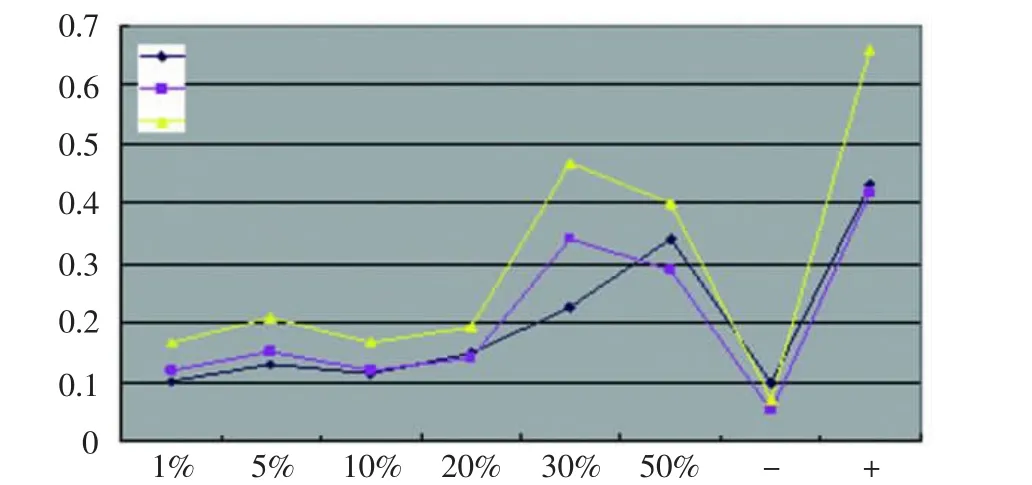
图3 ELISA检测培养第3、5、7天时各组细胞的HA含量Fig.3 The production of hyaluronic acid measured by ELISA at the 3rd,5th and 7th day after culture
3 讨论
Annunziata等的研究显示,PRP对齿龈成纤维细胞的活性具有促进作用;刘琪通过PRP处理生物膜,接种牙周韧带成纤维细胞以促进其增殖。而本实验研究PRP对皮肤成纤维细胞的体外作用,并且更着重于探索PRP对皮肤光老化的改善作用。
本实验在第 3、5、7天使用四甲基偶氮唑盐(MTT)法测定细胞增殖效果,分别应用RT-PCR测定胶原蛋白表达情况,ELISA测定HA功能变化,在体外探索PRP是否有直接改善皮肤光老化的可能。
MTT结果显示,随细胞培养时间延长,细胞增殖数量增加,伴随PRP浓度的增加细胞增殖有增强的趋势。PRP浓度在30%~50%时,细胞增殖最为明显,提示PRP可在体外促进人皮肤成纤维细胞的增殖。
RT-PCR 结果显示,含“PRP 浓度为 50%”、“+”、“-”3组均表达COL1与COL3,组间表达未见明显差异。由于RT-PCR为半定量测定,对目的基因的表达量之间的对比缺乏一定的敏感性,因此,应尝试选用更具有敏感性的Real time-PCR进行检测,以期达到更为精准的结果。
ELISA测定HA功能变化结果显示,随细胞培养时间增加,细胞产生的HA增加,伴随PRP浓度的增加细胞合成的HA有增加的趋势,在PRP浓度达到30%~50%时,其增加幅度明显。该结果与MTT结果存在一定的相关性,我们推测,皮肤成纤维细胞和HA含量之间存在正相关。
因此,我们认为PRP有直接改善皮肤光老化的可能。但体外和体内实验结果并不一致。如上皮细胞和角质细胞,在体外实验中,PRP对其具有一定的选择抑制作用。但动物实验已证明,PRP可促进上皮化的进程并提高上皮化质量。因此,我们的体外实验虽然可以说明PRP对HSFs合成胶原与HA的功能有明显促进效果,但无法证实其在体内的效果。下一步需进行体内实验,拟将皮肤皱纹的减少、皮肤含水量的增加、效果持续时间作为体内实验的检测指标。
[1]Halliwell B,Gutteridge JMC.Free Radicals in Biology and Medicine,3rd ed[M].Oxford:Oxford University Press,1999,48-69.
[2]Bos DC,de Ranitz-Greven WL,de Valk HW.Advanced glycation end products,measured as skin autofluorescence and diabetes complications:a systematic review[J].Diabetes Technol Ther,2011,13(7):773-779.
[3]李小迪.透明质酸的保湿特性及其在化妆品中的应用[J].中国学术期刊,2006(7):20-23.
[4]杜平中.透明质酸的皮肤保健功能[J].中国生化药物杂志,1998,19(5):283-284.
[5]Jurk K,Kehrel BE.Platelets:physiology and biochemistry[J].Semin Thromb Hemost,2005,31(4):381-392.
[6]Marx RE,Carlson ER,Eichstaedt RM,et al.Platelet-rich plasma:growth factor enhancement for bone grafts[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1998,85(6):638-646.
[7]Aghaloo TL,Moy PK,Freymiller EG.Investigation of plateletrich plasma in rabbit cranial defects:A pilot study[J].J Oral Maxillofac Surg,2002,60(10):1176-1181.
[8]Robinson CJ.Growth factors:therapeutic advances in wound healing[J].Ann Med,1993,25(6):535-538.
[9]Munirah S,Samsudin OC,Chen HC,et al.Articular cartilage restoration in load-bearing osteochondral defects by implantation of autologous chondrocyte-fibrin constructs:an experimental study in sheep[J].J Bone Joint Surg Br,2007,89(8):1099-1109.
[10]仇建军,张长青,袁霆,等.富血小板血浆所含相关生长因子在组织修复再生中的应用与作用[J].中国组织工程研究与临床康复,2009,13(41):8131-8134.
[11]Anitua E,Andia I,Ardanza B,et al.Autologous platelets as a source of proteins for healing and tissue regeneration[J].Thromb Haemost,2004,91(1):4-15.
[12]Powell DM,Chang E,Farrior EH.Recovery from deep-plane rhytidectomy following unilateral wound treatment with autologous platelet gel:a pilot study[J].Arch Facial Plast Surg,2001,3(4):245-250.
[13]Savarino L,Cenni E,Tarabusi C,et al.Evaluation of bone healing enhancement by lyophilized bone grafts supplemented with platelet gel:a standardized methodology in patients with tibial osteotomy for genu varus[J].J Biomed Mater Res B Appl Biomater,2006,76(2):364-372.
[14]Knighton DR,Doucette M,Fiegel VD,et al.The use of platelet derived wound healing formula in human clinical trials[J].Prog Clin Biol Res,1988,266:319-329.
[15]Englert SJ,Estep TH,Ellis-Stoll CC.Autologous platelet gel applications during cardiovascular surgery:effect on wound healing[J].J Extra Corpor Technol,2005,37(2):148-152.
[16]Hanna R,Trejo PM,Weltman RL.Treatment of intrabony defects with bovine-derived xenograft alone and in combination with platelet-rich plasma:a randomized clinical trial[J].J Periodontol,2004,75(12):1668-1677.
[17]Gassling VL,Acil Y,Springer IN,et al.Platelet-rich plasma and platelet-rich fibrin in human cell culture[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2009,108(1):48-55.
[18]Annunziata M,Oliva A,Buonaiuto C,et al.In vitro cell-type specific biological response of human periodontally related cells to plateletrich plasma[J].J Periodontal Res,2005,40(6):489-495.
[19]刘琪,Victor M,Mark B.富血小板血浆和贫血小板血浆处理的生物降解膜对牙周韧带成纤维细胞影响的扫描电镜观察[J].牙体牙髓牙周病学杂志,2004,18(4):439-442.
[20]Hu Z,Peel SA,Ho SK,et al.Platelet-rich plasma induces mRNA expression of VEGF and PDGF in rat bone marrow stromal cell differentiation[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2009,107(1):43-48.
[21]Kawasaki T,Murata S,Takahashi K,et al.Activation of human liver sinusoidal endothelial cell by human platelets induces hepatocyte proliferation[J].J Hepatol,2010,53(4):648-654.
[22]Zhang S,Mao T,Chen F.Influence of platelet-rich plasma on ectopic bone formation of bone marrow stromal cells in porous coral[J].Int J Oral Maxillofac Surg,2011,40(9):961-965.
[23]张卫兵,洪光祥,王发斌,等.自体富血小板血浆提取液对周围神经再生的作用[J].中华实验外科杂志,2006,23(9):1143.
[24]Yol S,Tekin A,Yilmaz H,et al.Effects of platelet rich plasma on colonic anastomosis[J].J Surg Res,2008,146(2):190-194.
[25]李晓红,周欣,恽佶例,等.移植活化富血小板血浆上清液促进实验性大鼠心肌梗死后组织修复[J].中国动脉硬化杂志,2008,16(11):869-872.

