津黑两地大白菜褐腐病病原菌鉴定及生物学特性的比较
苗国辉, 闻凤英, 张耀伟*
(1.东北农业大学园艺学院,哈尔滨 150030;2.天津市农业科学院科润蔬菜研究所,天津 300384)
大白菜[Brassica campestris L.ssp.pekinensis(Lour.)Olsson]是我国广泛种植的蔬菜。褐腐病是大白菜生产中近几年逐渐发展起来的病害,在武汉、天津、哈尔滨等地呈现出蔓延的趋势,并被误认为细菌性软腐病。大白菜褐腐病主要危害大白菜的叶柄,导致叶柄腐烂,使大白菜品质降低,产量下降,其区别于细菌性软腐病的特征是腐烂斑为褐色,无臭味。大白菜褐腐病致病菌为Rhizoctonia solani Kühn[1]。刘志恒[2]等对辽宁地区白菜叶腐病进行鉴定,确定白菜叶腐病的病原菌是立枯丝核菌(Rhizoctonia solani Kühn)。何苏琴等[3]通过对辣椒茎腐和根腐病的病组织进行分离鉴定,发现辣椒茎腐和根腐病的致病菌是立枯丝核菌。立枯丝核菌是一类广泛存在于自然界中、并能引起多种作物病害的土壤习居真菌,到目前为止,立枯丝核菌共划分为14个融合群、21个融合亚群[4],Yang G H 等[5]确定甘蓝叶腐病的病原菌是立枯丝核菌AG-4融合群;段春芳[6]等对云南地区的白菜、薄荷、莴苣叶腐病进行鉴定,确定引起白菜、薄荷、莴苣叶腐病的病原菌是立枯丝核菌的AG-1IB亚群。Kuramae等[7]从巴西莴苣上分离的立枯丝核菌被鉴定属于AG1-IA亚群;从花茎甘蓝、菠菜、甜瓜、番茄4种作物上分离的立枯丝核菌被鉴定属于AG-4融合群。肖勇等[8]通过对四川省水稻立枯丝核菌(Rhizoctonia solani)进行鉴定,分离得到55株立枯丝核菌,确定除D42菌株外,其余均属于AG-1IA群;郭庆元等[9]研究发现立枯丝核菌的 AG-1、AG-2、AG-4也可危害豆类作物。
本试验通过对天津、黑龙江两省市大白菜褐腐病进行田间症状观察、病原菌的形态学鉴定及分子鉴定,确定两地大白菜褐腐病的病原菌,并对两地区的病原菌进行生物学特性的比较分析。
1 材料与方法
1.1 田间症状调查与取样
对天津市农业科学院科润蔬菜试验站和哈尔滨市东北农业大学实验实习基地的大白菜褐腐病症状进行田间观察,并取样。
1.2 病原菌鉴定
1.2.1 病原菌的分离和纯化
将上述采集的病组织用水琼脂法分离[10],病原菌经分离纯化后保存于PDA斜面培养基上,置于4℃冰箱储存备用。
1.2.2 病原菌形态学鉴定
将供试菌株接种于PDA平板上,25℃恒温黑暗培养3d后,对其菌落形态进行观察。12d后观察是否产生菌核。菌丝形态观察采用邓振山[11]、许志刚的方法[12]。
1.2.3 病原菌致病性测定
采用苗期离体叶片法对分离的菌株进行致病性测定。在接种时取完整的幼嫩叶片,洗净后置于铺有无菌吸水纸的铁盘中,并在铁盘中加入少许无菌水以保持湿度。将菌株在PDA上进行扩繁,在25℃恒温黑暗条件下培养3d,用直径为6mm的打孔器在活化好的菌落边缘打取菌丝块,用无菌接种针将菌丝块接种于叶柄上,每个菌株接种20个叶片,以琼脂块接种的叶片作为对照。
1.2.4 病原菌分子鉴定
病原菌DNA提取采用Sun的方法[13]。用真菌的ITS序列通用引物ITS1和ITS4[14]对病原菌的ITS序列进行PCR扩增,PCR反应体系总体积为50μL,反应液组分为:10×Buffer(含 mg2+)5μL,10mmol/L dNTP 4μL,5U/μLTap酶0.5μL,模板DNA1.0μL,用ddH2O使总体积达到50μL。PCR反应程序为:95℃预变性3min;94℃变性1min;55℃退火1min,72℃延伸1min,共30个循环;最后72℃延伸10min。PCR产物通过1%琼脂糖凝胶电泳检测后,克隆至pEASY-T3克隆载体上,再转化至大肠杆菌感受态细胞中(两者均由全式金公司提供),在含IPTG、X-gal、氨苄青霉素的LB平板上进行蓝白斑法筛选,PCR检测后送北京华大生物工程技术服务有限公司测序。测序结果在GenBank数据库(www.ncbi.nlm.nih.gov)中进行BLAST比对分析,并从GenBank中下载23个菌株的相关ITS序列,用DNAStar软件Meglign程序构建系统进化树。
1.2.5 病原菌融合群鉴定
融合群鉴定标准菌株由华中农业大学周而勋教授提供,采用陈延熙等改进的玻片配对法[15],将已分离鉴定出的立枯丝核菌TJ、DB两菌株分别与AG1~AG8及AG-BI标准测试菌株配对培养进行融合群鉴定。
1.3 津黑两地病原菌生物学特性比较
1.3.1 不同碳源对菌丝生长、菌核形成的影响
基本培养基为查氏培养基[16],以其蔗糖含碳量42.07%为标准,碳源用等质量含碳量的葡萄糖、蔗糖、乳糖、果糖、可溶性淀粉代替。供试菌株在PDA平板上25℃恒温黑暗培养3d,在无菌条件下沿菌落边缘打取直径6mm的菌丝块接种到不同碳源的查氏培养基上,25℃恒温黑暗条件下培养。3d后测其菌落直径,12d后测定气生菌核干重。3次重复。
1.3.2 不同氮源对菌丝生长、菌核形成的影响
基本培养基为查氏培养基[16],以其硝酸钠含氮量16.47%为标准,氮源用等质量含氮量的硝酸钾、蛋白胨、硝酸铵、甘氨酸、硫酸铵5种氮源代替。供试菌株在PDA平板上25℃恒温黑暗培养3d,在无菌条件下沿菌落边缘打取直径6mm的菌丝块,接种到含不同氮源的查氏培养基上,置于25℃恒温黑暗条件下培养。3d后测其菌落直径,12d后测定气生菌核干重。3次重复。
1.3.3 不同温度对菌丝生长、菌核形成的影响
供试菌株在PDA平板培养基上25℃恒温黑暗培养3d,在无菌条件下沿菌落边缘打取直径6mm的菌丝块移植到PSA培养基平板中央,置于21、23、25、27、29℃不同温度下恒温黑暗培养。3d后测定菌落直径,12d后测定气生菌核干重。3次重复。
1.3.4 不同pH对菌丝生长、菌核形成的影响
供试菌株在PDA平板培养基上25℃恒温黑暗培养3d,在无菌条件下沿菌落边缘打取直径6mm的菌丝块移植到pH 分别为5.0、6.0、7.0、8.0、9.0的PSA培养基平板中央。于25℃恒温黑暗条件下培养。3d后测定菌落直径,12d后测定气生菌核干重。3次重复。
1.3.5 不同光照条件对菌丝生长、菌核形成的影响
供试菌株在PDA平板培养基上25℃恒温黑暗培养3d,在无菌条件下沿菌落边缘打取直径6mm的菌丝块移植于PSA培养基平板中央,于25℃恒温培养。光照分别为24h光照、12h光照、全黑暗。3d后测定菌落直径,12d后测定气生菌核干重。3次重复。
1.3.6 菌丝、菌核致死温度测定
菌丝致死温度测定:用水浴锅设定40、42、44、46、48、50℃,将装有无菌水的试管在水浴锅里升至与水浴锅的水相同温度。供试菌株在PDA平板培养基上25℃恒温黑暗培养3d,在无菌条件下从边缘打取直径6mm的菌丝块移植于装有无菌水的试管里,在不同温度下处理10min后,移植于PSA平板上,3d后观察其菌丝生长状况。3次重复。
菌核致死温度测定:供试菌株在PDA平板培养基上25℃恒温黑暗培养12d后选取大小一致的菌核,将菌核移植于装有无菌水的试管里,在不同温度下处理10min后,在无菌环境下将菌核移植于PSA平板上,5d后观察菌核萌发状况。3次重复。
2 结果与分析
2.1 大白菜褐腐病症状
大白菜褐腐病主要危害大白菜叶柄;病害初期从叶柄基部发病,病斑大小为1~4cm,病斑浅黄色且中间着生小黑点,以后逐渐扩大凹陷成褐色至深褐色大斑,有时病斑表面呈现隐约的轮纹,湿度大时病斑上密生灰白色菌丝,逐渐聚集成团,并形成褐色菌核;后期叶柄腐烂(图1a、b)。

图1 大白菜褐腐病症状
2.2 大白菜褐腐病病原菌分离
2.2.1 病原菌形态特征
菌丝初期白色,绒毛状,有隔,近分支处有缢缩,分支初期成直角,后渐近锐角(图2a)。生长后期,天津地区分离的TJ菌株的菌丝由白色变为褐色乃至深褐色(图2b),黑龙江地区分离的DB菌株的菌丝由白色变为淡褐色(图2c),并在生长后期均形成菌核(图2d)。
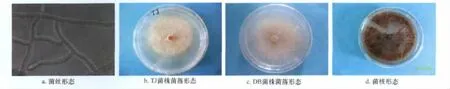
图2 立枯丝核菌菌丝及菌落形态特征
2.2.2 致病性测定结果
将分离到的病菌菌丝块接种到大白菜叶柄上,结果表明,叶柄接种2d后,出现黑褐色腐烂病斑,接种5d(图1c、d)后,病斑扩大至整个叶柄,且叶柄腐烂。接种发病率为100%,且症状与田间发病症状相同。对照叶片未发病。对发病叶片进行再分离,可分离到与接种菌株形态一致的病原菌。说明该菌为致病菌株。
2.2.3 大白菜褐腐病分离菌株的分子鉴定
用引物ITS1和ITS4扩增了两个菌株的核糖体基因ITS序列,利用1%琼脂糖凝胶电泳检测PCR扩增产物。结果显示,分离菌株的核糖体基因ITS序列全长为650bp左右,这与预期片段长度一致。经北京华大基因公司对PCR产物测序,确定两菌株的ITS序列全长均为663bp。将两菌株的序列与GenBank数据库中相关的立枯丝核菌菌株的基因序列进行比对分析,结果表明TJ菌株ITS序列与Rhizoctonia solani isolate(JF817349.1、AY241 672.1、AY154 317.1,AB054 852.1、DQ279 002.1、EF532 828.1)相似性为100%,DB菌株序列与Rhizoctonia solani isolate(EU-591 761.1、DQ356 412.1、AF354 063.1、FJ435 141.1)相似性最高为99%。
将两个菌株与GenBank数据库中立枯丝核菌5.8S rDNA-ITS序列比对,构建系统进化树。从系统进化树(图3)可以看出,从大白菜褐腐病组织上分离的TJ菌株与Rhizoctonia solani isolate JF817 349列在同一组,表明它们之间差异不明显,亲缘关系近。而DB菌株独立于其他立枯丝核菌菌株,表明DB菌株与其他已分离的立枯丝核菌菌株不同,为一株新的立枯丝核菌菌株,GenBank登录号JN412 624。

图3 基于5.8SrDNA-ITS核苷酸序列构建的系统进化树
2.2.4 病原菌融合群鉴定
融合群鉴定表明,天津地区分离的TJ菌株与AG-2-1融合群融合,而与AG-1-IA等其他9个菌株不融合;黑龙江地区分离的DB菌株与AG-1融合,而与AG-2等其他9个菌株不融合(表1)。因此确定TJ菌株属于AG-2融合群,DB菌株属于AG-1融合群。

表1 TJ、DB两菌株的融合群鉴定1)
2.3 津黑两地菌株的生物学特性比较
2.3.1 不同碳源对菌丝、菌核生长的影响比较
由图4a①可知,不同碳源对两菌株菌丝生长具有明显的影响。两菌株利用碳源相同点均是在以淀粉为碳源的查氏培养基上生长最快,在果糖上生长最慢,且与其他碳源呈显著差异;不同点是以可溶性淀粉、葡萄糖为碳源时,DB菌株生长速率较快,以果糖为碳源时,TJ菌株生长速率较快。
由图4a②可知,两菌株在不同碳源查氏培养基上生长时,其菌核形成有明显的差异。相同点是两菌株在以可溶性淀粉为碳源生长时最先形成气生菌核,且两菌株在以蔗糖为碳源时形成的气生菌核量均是最多,且与其他碳源呈显著性差异。葡萄糖和可溶性淀粉次之,以乳糖和果糖为碳源时形成的气生菌核量最少。半埋式菌核形成量均是蔗糖最多,葡萄糖和可溶性淀粉次之。两菌株菌核形成差异是,TJ菌株在以乳糖和果糖为碳源的查氏培养基上生长时均生成半埋式菌核;DB菌株在以乳糖和果糖为碳源的查氏培养基上生长时未见半埋式菌核。并且TJ菌株在不同碳源的查氏培养基上生长时菌核形成量均快于并且多于DB菌株。

图4 TJ和DB菌株生物学特性比较
2.3.2 不同氮源对菌丝、菌核生长的影响比较
由图4b①可知,不同氮源对两菌株生长具有明显影响。两菌株利用氮源相同点是在以蛋白胨为氮源时生长最快,在以甘氨酸为氮源时生长最慢,且菌丝在两氮源上的生长呈显著性差异。两菌株在氮源不同的查式培养基上生长时均是DB菌株生长速率快于TJ菌株。
由图4b②可知,在不同氮源查式培养基上生长时,两菌株菌核形成的相同点是,两菌株均在以硝酸铵和硫酸铵为氮源时最先形成气生菌核,气生菌核量均是硫酸铵最多,且均以甘氨酸为氮源时形成气生菌核量最少,并且两氮源之间呈显著性差异。两菌株菌核形成差异是,TJ菌株在以硝酸钾为氮源时最先形成半埋式菌核,且形成半埋式菌核量最多,与其他氮源呈显著性差异;DB菌株在以硝酸铵为氮源时最先形成半埋式菌核,且形成半埋式菌核最多;在不同氮源上生长时TJ菌株与DB菌株相比菌核形成速度快且形成量大。
2.3.3 不同温度对菌丝、菌核生长的影响比较
由图4c①可知,两菌株均在25℃时生长最快且菌丝层最厚,21~25℃菌丝生长差异不显著,29℃时菌丝均生长最慢且菌丝层最薄,25℃和29℃条件下菌丝生长呈显著性差异。并且在不同温度下生长速度DB菌株普遍快于TJ菌株,DB菌株菌丝层厚度大于TJ菌株,气生菌丝多于TJ菌株。
由图4c②可知,在不同温度下生长时,两菌株形成菌核的相同点是,均在25℃时气生菌核和半埋式菌核量最多。两菌株不同点是,TJ菌株半埋式菌核量及气生菌核量在29℃时均是最少,而DB菌株则是在21℃时半埋式菌核量最少,气生菌核量则是29℃时最少;两种菌株在不同温度下生长时菌核形成速度及形成量均是TJ菌株快于并且大于DB菌株。
2.3.4 不同pH对菌丝、菌核生长的影响比较
由图4d①可以看出,不同pH对两菌株的菌丝生长影响也有明显影响。两菌株在pH7时生长均是最快且菌丝层最厚,pH9时均是生长最慢且菌丝层最薄且两者之间呈显著性差异,pH5~7菌丝生长差异不明显。在不同pH条件下DB菌株的菌丝生长速度快于TJ菌株。
由图4d②可知,两种菌株均在pH7时气生菌核和半埋式菌核量最多,pH5时气生菌核量均是最少,且pH5和pH7的菌核量呈显著性差异,不同的是TJ菌株的菌核量多于DB菌株,并先于DB菌株形成菌核。
2.3.5 不同光照对菌丝、菌核生长的影响比较
由图4e①可知,两菌株均是在12h光照时菌丝生长最快且菌丝层最厚,而在全黑暗时菌丝生长最慢且菌丝层最薄。并且在不同光照条件下菌株生长速度DB菌株普遍快于TJ菌株。
由图4e②可知,两种菌株均是在12h光照时气生菌核和半埋式菌核量最多,全黑暗时气生菌核和半埋式菌核量最少。不同的是TJ菌株的菌核量多于DB菌株,并先于DB菌株形成菌核。
2.3.6 致死温度比较
由表2可知两菌株相同点是在低于40℃下均能存活,而在42℃以上时菌丝均不能生长。两菌株的不同点是菌核致死温度TJ菌株为46℃,而DB菌株则为48℃。

表2 TJ、DB两菌株菌丝、菌核致死温度的比较
3 结论与讨论
通过对天津和黑龙江两个地区的大白菜褐腐病病原菌常规分离鉴定、分子鉴定,确定导致两地区大白菜褐腐病的致病菌为立枯丝核菌(Rhizoctonia solani Kühn),通过融合群鉴定及5.8SrDNA-ITS序列系统进化树分析确定两菌株分别属于AG-2和AG-1两个融合群,并且DB菌株为一个新菌株,GenBank登录号JN412 624。
不同培养条件对菌丝生长影响的测定结果表明,TJ、DB两菌株生长最适pH为7,与刘志恒等研究结果相似[1,18];两菌株均是在以可溶性淀粉和蛋白胨为碳源和氮源的培养基上生长时菌丝生长最快,这与林清等人研究结果相似[17],而刘志恒等人从番茄茎基腐病分离的立枯丝核菌,最适氮源为硝酸钠[18]。试验确定TJ、DB两菌株的最适生长温度为25℃,在12h光照时菌丝生长最快且菌丝层最厚,这与刘志恒结果不一致,其研究发现黑暗条件有利于白菜丝核菌叶腐病病原菌(Rhizoctonia solani Kühn)菌丝生长,而全光照与12h光暗交替条件下菌丝生长缓慢[2];同时刘志恒认为导致番茄茎基腐病的立枯丝核菌最适温度为20℃[18]。在菌核形成方面,TJ、DB菌株均是在pH7时、以可溶性淀粉为碳源的培养基上生长时最先形成气生菌核,这与刘志恒等研究结果相似[2]。两菌株在氮源、温度对菌核形成影响上与刘志恒等结果有所差异[2,18];两菌株均在12h光照条件下气生菌核和半埋式菌核形成量最多,全黑暗条件下最少,而刘志恒等认为光照对白菜丝核菌叶腐病病原菌(Rhizoctonia solani Kühn)菌核形成量无关[2]。同时张丽等认为甘蓝立枯丝核菌球腐病病原菌在连续光照下有利于菌核形成[4]。据此认为,寄主来源不同的立枯丝核菌由于其各自发生环境不同或是菌群分化等的影响,致使病原菌某些生物学特性存在一定差异。
本试验测定致死温度时,先将试管温度升至设定的温度,确定两菌株的菌丝致死温度均为42℃,菌核致死温度则分别为TJ菌株46℃,DB菌株48℃;而刘志恒等认为从番茄茎基腐病分离的立枯丝核菌菌丝致死温度为50℃,菌核致死温度为59℃[18];张丽等人认为包菜立枯丝核菌球腐病病原菌菌丝致死温度为45℃,菌核致死温度为50℃[4]。这些差异还需进一步研究验证。
在不同碳源、氮源、温度、pH下,DB菌株菌丝生长速度快于TJ菌株,但TJ菌株先于DB菌株形成菌核,并且菌核量多于DB菌株,说明两个菌株在生长发育过程中存在明显差异,形成了与两地生态环境相适应的无性繁殖过程。同时发现在不同碳源、氮源、温度、pH下,两菌株菌核形成存在明显差异,如TJ菌株在以硝酸钾为氮源的培养基上形成半埋式菌核量最多;DB菌株以硝酸铵为氮源的培养基上形成半埋式菌核最多,这可能与两菌株分属于不同融合群、具有不同生态适应性有关。
[1]吕佩珂,李明远,吴钜文,等.中国蔬菜病虫害原色图谱[M].第2版.北京:农业出版社,1998.
[2]刘志恒,李艳君.白菜丝核菌叶腐病病原菌鉴定及生物学特性研究[J].北方园艺,2009(5):57-60.
[3]何苏琴.引起辣椒茎腐和根腐的立枯丝核菌的生物学特性及致病性研究[J].甘肃农业科技,2002(9):44-45.
[4]张丽.包菜立枯丝核菌球腐病的病原学研究[D].武汉:华中农业大学植物科技学院,2008.
[5]Yang G H,C hen X Q.First report of foliar blight in Brassica rapassp.chinensis caused by Rhizoctonia solani AG-4[J].Plant Pathology,2004,53:260.
[6]段春芳,杨根华.立枯丝核菌AG-1IB引起白菜、薄荷、莴苣叶腐病的研究[J].云南农业大学学报,2008,23(3):422-425.
[7]Kuramae E E ,Buzeto A L,Ciampi M B,et al.Identification of Rhizoctonia solani AG 1-IB in lettuce,AG4HG-I in tomato and melon,and AG-4HG-III in broccoli and spinach in Brazil[J].European Journal of Plant Pathology[J].2003,109(4):391-395.
[8]肖勇,刘明伟,李刚,等.四川省水稻立枯丝核菌(Rhizoctoniasolani)的遗传分化与致病力[J].中国水稻科学,2008,22(1):87-92.
[9]郭庆元,杨金红,季良.新疆6种豆科作物立枯丝核菌菌丝融合群研究[J].新疆农业科学,2005,42(6):382-385.
[10]周而勋,杨媚.从植物病组织中分离立枯丝核菌的快速、简便技术[J].华南农业大学学报,1998,19(1):125-126.
[11]邓振山,张宝成,孙志宏,等.立枯丝核菌营养菌丝多型性观察[J].微生物学杂志,2005,6(25):56-58.
[12]许志刚.普通植物病理学[M].第4版.北京:高等教育出版社,2009.
[13]Sun Y,Zhang W,Li F L,et al.Identification and genetic mapping of novel genes that regulate leaf development in Arabidopsis[J].Cell Research,2000,10(4):325-335.
[14]White T J,Bruns T,Lee S.Analysis of phytogenetic relationships by amplification and direct sequencing of ribosomal RNA genes[M]∥Innis M A,Gelfand D H,Sninsky J J,et al.PCR protocols:A guide to methods and applications.New York:Academic,1990:15-22.
[15]陈延熙.关于Rhizoctonia solani菌丝融合群分类和有性世代的研究[J].植物病理学报,1985,3(1):139-143.
[16]方中达.植病研究方法[M].第3版.北京:农业出版社,1998:50.
[17]林清,陶家凤.立枯丝核菌对碳、氮营养的需求[J].四川农业大学学报,1992,10(3):484-490.
[18]刘志恒,马家瑞,杨红,等.番茄茎基腐病病原菌的生物学特性[J].植物保护,2010,36(2):94-97.

