人VEGF基因腺病毒表达载体修饰大鼠骨髓间充质干细胞①
刘艳枚,刘小慧,方 宁,刘金伟,章 涛
(遵义医学院附属医院暨贵州省细胞工程重点实验室,贵州 遵义 563000)
干细胞临床转化应用寄托了各种难治性组织损伤疾病治疗的新希望[1,2]。除了干细胞直接移植应用外,将干细胞作为基因治疗的载体,由此形成基因与干细胞的联合也是重要的新的研究关注点[3]。这一治疗新策略成功的前提是选择易于病毒载体转染的干细胞类型,并将病毒转染干细胞带来的可能伤害降至最低。骨髓间充质干细胞(bone marrow derived-mesenchymal stem cells,BMMSCs)是最具应用前景的成体干细胞来源,在肢体缺血性疾病等的治疗应用研究中已取得了理想的结果[4]。最近,已有采用基因修饰BM-MSCs的治疗实验研究报道,初步证实了采用BM-MSCs携带外源基因治疗的可行性[5]。本研究选择具有促进血管新生的血管内皮生长因子(vascular endothelial growth factor,VEGF),用腺病毒介导VEGF基因转染大鼠BM-MSCs,通过转染报告基因表达、转染效率和细胞活性检测等评价该策略的可行性,为VEGF基因修饰大鼠BM-MSCs移植治疗糖尿病下肢缺血等慢性缺血性疾病奠定基础。
1 材料与方法
1.1 病毒与细胞株 含人VEGF165基因腺病毒表达载体Ad-VEGF165与空载体Ad-GFP均由苏州大学杨吉成教授惠赠;HEK293细胞株为本实验室存留。
1.2 主要试剂与仪器 FITC anti-rat CD29、PE anti-rat CD90和PE anti-rat CD45购自BioLegend公司;LG-DMEM培养基、HG-DMEM培养基、胎牛血清(FBS)为Gibco公司产品;碱性成纤维细胞生长因子(bFGF)购自 Sigma公司。主要仪器:FACS Calibur流式细胞仪(Becton Dickinson);Leica Mirb倒置荧光显微镜 (Nikon);Vi-CELLTM XR细胞计数仪(Beckman Coulter)。
1.3 实验动物 实验用SD大鼠购自第三军医大学附属大坪医院实验动物中心,动物实验符合有关伦理要求。
1.4 大鼠BM-MSCs的分离培养与免疫表型分析 颈椎脱臼法处死2~3周龄SD大鼠,无菌条件下切取双侧完整股骨,剪开其两端,用D-PBS冲洗骨髓腔并收集冲洗液,1500 rpm离心5 min,弃上清,用含 10%FBS和 10 ng/ml的 bFGF的 LGDMEM培养液重悬细胞,接种于Corning T25一次性塑料培养瓶中进行原代培养。原代培养48 h首次换液,去除悬浮生长细胞。当贴壁细胞生长汇合度达80% ~90%时(通常为原代培养5~6 d),采用0.125%胰蛋白酶消化,按5×105个/ml细胞密度进行传代培养。取第3代BM-MSCs进行表型标志物CD45、CD29和CD90流式细胞仪分析。
1.5 携带人VEGF基因腺病毒表达载体的扩增与效价分析
1.5.1 Ad-VEGF165扩增 采用含 10%FBS的HG-DMEM和T25培养瓶培养HEK293细胞,待细胞生长汇合度达50% ~80%时,从-20℃冰箱中取出Ad-VEGF165,放入37℃水浴箱中孵育15 min,取100 μl病毒液加入到1个弃培养基的HEK293细胞培养瓶中,作用1 h后,加入3 ml含2%FBS的HG-DMEM培养基维持培养。病毒转染48 h后,显微镜下观察细胞成葡萄状聚集时即可收集细胞,1 000 rpm离心5 min,留少许培养液的细胞沉淀置-80℃冰箱和37℃水浴箱反复冻融3次,使病毒从细胞中充分释放,再将冻融液2000 rpm离心5 min,收集含病毒的上清液(约0.5 ml),置-80℃冰箱保存备用。
1.5.2 Ad-VEGF165效价检测 采用96孔板,每孔接种100 μl密度为1×105/ml的HEK293细胞,培养24 h后,将上述步骤扩增收获的Ad-VEGF按10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8稀释后,每孔加10 μl病毒稀释液,于37℃、5%CO2条件下培养18 h,置荧光显微镜下进行荧光细胞计数,按下述公式计算制备的病毒原液的病毒效价:病毒效价(pfu/ml)=(平均荧光数×10)/相应稀释度。选择病毒效价≥108以上者用于后续干细胞转染实验。
1.6 Ad-VEGF165体外转染BM-MSCs 取第3代BM-MSCs,用6孔板,每孔接种1×105个细胞,于37℃、5%CO2环境下培养。待细胞生长汇合度达50%~80%时,弃培养基,取上述步骤扩增的重组腺病毒,以感染复数(MOI)为 20、50、100、200 的Ad-VEGF转染BM-MSCs,并加含2%FBS和10 ng/ml bFGF的 LG-DMEM 培养基400 μl,轻轻晃动培养板,使病毒混悬液均匀平铺于细胞上,1 h后再补加1.6 ml相同培养基,置37℃,5%CO2培养箱培养。24 h及48 h后进行流式细胞仪分析转染效率,结合台盼蓝染色细胞活力观察,以确定理论的MOI值。注:转染复数(MOI)为病毒数与待转染细胞数之比值,也等于病毒效价×病毒液体积/待转染细胞数,可理解为转染一个细胞需要多少病毒数,理想的MOI值的确定应当是在转染效率与细胞毒性之间求的平衡。
2 结果
2.1 大鼠BM-MSCs生长特点与免疫表型分析原代培养第5天的细胞可形成大小不等的细胞集落,细胞呈梭形、多角形及不规则形态(见图1A)。传代48 h后细胞形成漩涡状排列,呈典型的间充质干细胞形态特征(见图1B)。对第3代细胞进行流式细胞仪免疫表型鉴定结果表明,分离纯化的大鼠BM-MSCs高表达 CD90和CD29,不表达 CD45(见图1C)。
2.2 Ad-VEGF165的扩增及效价分析 转染Ad-VEGF165的HEK293细胞光镜出现细胞圆缩,细胞间隙变大的细胞损伤表现;荧光显微镜下可见GFP的表达强度随培养时间延长而增强(见图2)。收集扩增的 Ad-VEGF165病毒液,从10-1到10-8按10倍梯度稀释后转染HEK293细胞,转染18 h后荧光显微镜下可见GFP充满整个细胞轮廓,且GFP阳性表达细胞数(荧光数)随稀释倍数递增而逐渐减少。计数所有孔中的荧光数,病毒稀释度为10-7的孔板中荧光总数平均值为8(荧光数值为1~10),根据病毒效价(pfu/ml)=(平均荧光数×10)/相应稀释度,计算扩增制备的Ad-VEGF165病毒效价为8×108pfu/ml。
2.3 不同感染复数(MOI)Ad-VEGF165转染大鼠BM-MSCs的效果 转染Ad-VEGF165后的BMMSCs仍可贴壁生长,并呈梭形或多角形,但细胞分裂增殖速度减缓。转染24 h后可见细胞有GFP表达,但强度较弱;之后荧光渐增,并出现病毒毒性反应,如细胞变圆或死亡等;96 h荧光强度最强,随后逐渐减弱,但病毒毒性渐强,细胞变圆或死亡增多(见图3)。台盼蓝染色结果表明(见图4A),感染复数(MOI)为20和50组,Ad-VEGF对 BM-MSCs生长与Ad-GFP组和PBS组比较无明显差异,细胞活性无明显降低(P>0.05);MOI为100、200组,Ad-VEGF对BM-MSCs有明显的生长抑制作用,程度与Ad-GFP组比较无明显差异,但是与PBS组比较差异明显,细胞活性明显降低(P<0.05)。流式细胞仪检测结果表明,MOI为50的Ad-VEGF转染BM-MSCs效率最高,达53.15%(见图4B)。

图1 大鼠BM-MSCs生长特点与免疫表型特征
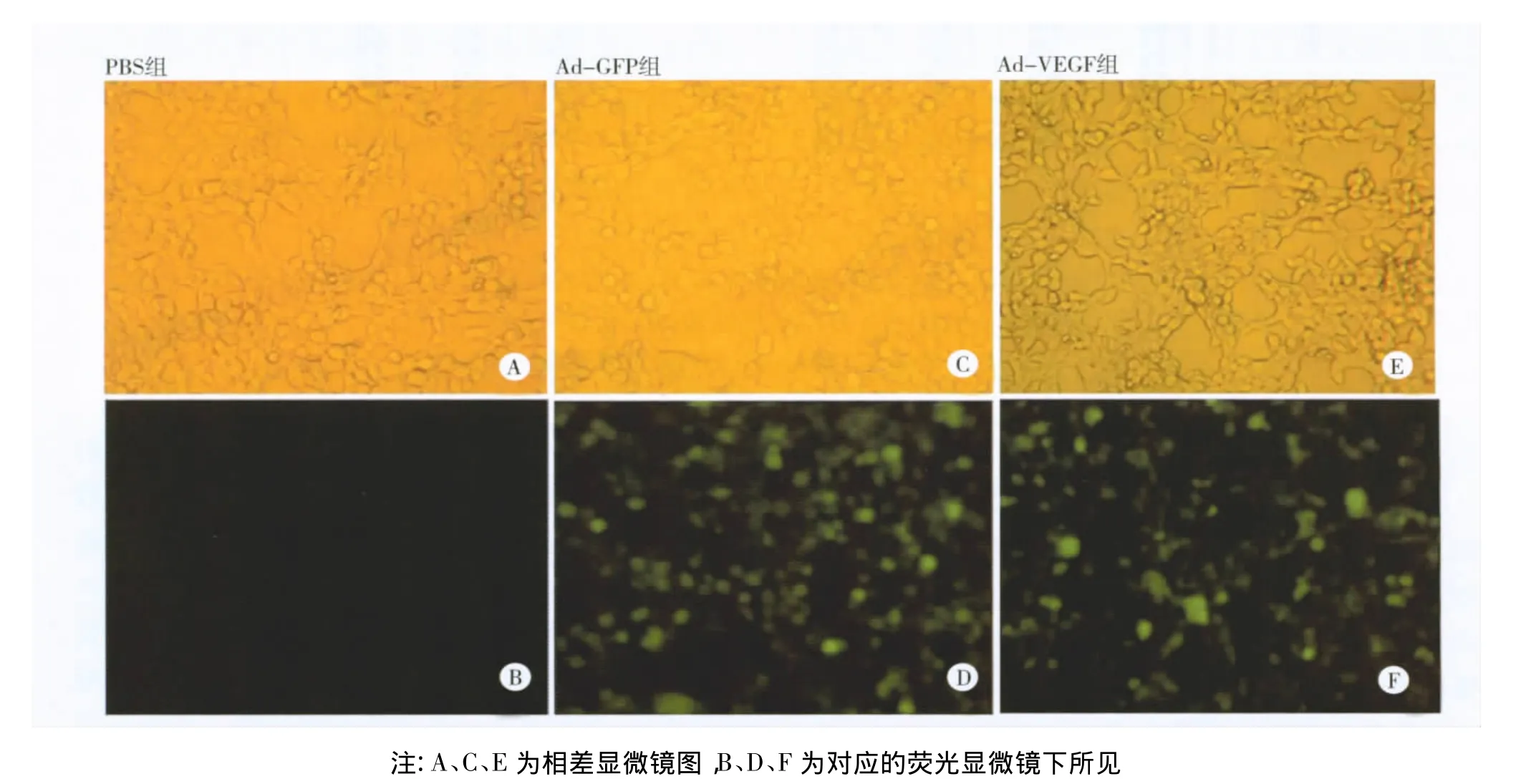
图2 重组腺病毒转染HEK293细胞24 h的显微镜所见(×100)
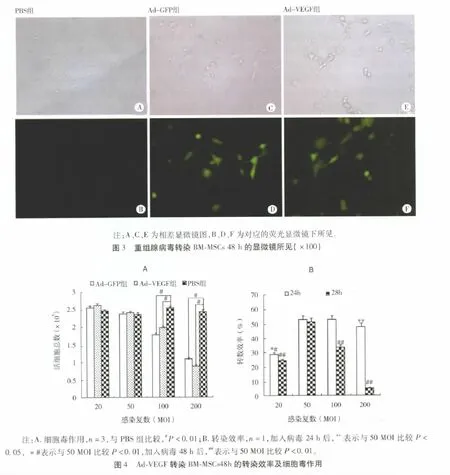
3 讨论
尽管基因治疗概念的提出已有20余年,但目前为止,全球范围内经FDA批准的基因治疗策略和药物仍寥寥无几,原因在于合适的载体选择、组织特异性定向转染表达困难以及应用安全性的担忧。虽然存在上述种种障碍,但科学界一直未放弃基因治疗的梦想。近年来,随着干细胞研究的不断拓展,已有将基因治疗与干细胞移植联合应用的研究报道,初步证实了基因修饰干细胞移植这一新治疗策略的可行性[6,7]。由于病毒与生俱来的感染性和对宿主细胞的毒性作用特点,是否可将病毒载体转染目的基因到BM-MSCs,以实现干细胞与基因治疗的完美结合,值得深入研究。本文就体外VEGF基因腺病毒表达载体转染BM-MSCs,并着重于对细胞的毒性作用、转染效率、最佳病毒剂量等进行研究,是探索这一新策略的前导性工作的有益探索。
重组腺病毒体外能高效、稳定的转染增殖和非增殖状态的干细胞,但是病毒效价低于1×108pfu/ml时转染效率低,即使增加病毒液体积,转染效率提高也不明显,且病毒毒性反应加重[8,9],我们在实验中也观察到类似现象。本实验采用文献[10]报道的病毒效价计算方法,获得扩增的Ad-VEGF病毒效价为8×108pfu/ml,高于1×108pfu/ml,说明经过本文扩增体系获得的病毒液可用于后续的干细胞转染实验。本研究还通过台盼蓝染色法检测不同浓度Ad-VEGF转染BM-MSCs对其细胞活性的影响,并就Ad-VEGF转染BM-MSCs的转染率进行分析,以探寻合理的病毒转染浓度值(也即理想的感染复数值)。实验结果表明,当Ad-VEGF感染复数(MOI)大于50,BM-MSCs接触到的Ad-VEGF病毒颗粒增多,病毒毒性作用增强,从而使BM-MSCs活性降低,生长受抑制,甚或大量细胞漂浮、死亡。当加入Ad-VEGF病毒的MOI为50时,Ad-VEGF对BM-MSCs的毒性降低,BM-MSCs细胞活性和生长状态良好,易于接受外源性基因,转染效率也达到最高值53%的水平。
采用VEGF基因或含VEGF基因质粒或缺陷性腺病毒直接注射的治疗方法,因存在基因表达时间短,局部水肿明显等问题,现已很少采用[11]。本实验采用Ad-VEGF成功转染BM-MSCs,是将BMMSCs作为腺病毒介导基因治疗平台,不但可以减少进入体内的腺病毒剂量以及腺病毒与机体网状内皮系统的直接接触,有利于减轻腺病毒的毒性反应,同时获得高水平分泌 VEGF的转基因 BMMSCs,在各种慢性缺血性疾病的治疗中有望达到促进血管新生和组织修复双重治疗效果,具有良好的应用前景。
[1]Kode JA,Mukherjee S,Joglekar MV,et al.Mesenchymal stem cells:immunobiology and role inimmunomod-ulation and tissue regeneration[J].Cytotherapy,2009,11(4):377-391.
[2]Strauer BE,Steinhoff G.10 years of intracoronary and intramyocardial bone marrow stem cell therapy of the heart[J].J Am Coll Cardiol,2011,58(11):1095-1104.
[3]Kalka C,Baumgartner I.Gene and stem cell therapy in peripheral arterial occlusive disease[J].Vasc Med,2008,13(2):157-172.
[4]Franz RW,Shah KJ,Johnson JD,et al.Short-to mid-term results using autologus bone-marrow mononuclear cell implantation therapy as a limb salvage procedure in patients with severe peripheral arterial disease[J].V-asc Endovascular Surg,2011,45(5):398-406.
[5]王艳俊,隗玉川,杨智翔,等.重组腺病毒载体介导IL-12基因在间充质干细胞中的表达[J].中国误诊学杂志,2011,11(3):516-518.
[6]祝荫,程明,吕农华,等.NK4基因慢病毒载体的构建及其在骨髓间充质干细胞中的表达[J].生物医学工程学杂志,2011,28(5):976-981.
[7]樊芙蓉,韦俊,刘毅,等.AdMaxTM重组腺病毒载体转染人脂肪间充质干细胞[J].上海交通大学学报,2008,28(2):141-144.
[8]Chen H,Xiang ZQ,Li Y,et al.Adenovirus-based vaccines:comparison of vectors from three species of adeno-viridae[J].J Virol,2011,84(20):10522-10532.
[9]Xiao X,Li J,Samulski RJ.Production of high-titer recombinant adeno-associated virus vectors in the absence of helper adenovirus[J].J Virol,1998,72(3):2224-2232.
[10]刘铁连,谢宇锋,杨吉成,等.人血管生成素1和血管内皮生长因子165重组腺病毒载体构建及目的基因表达[J].中国组织工程研究与临床康复,2008,12(41):8103-8106.
[11]Baumgartner I,Rauh G,Pieczek A,et al.Lower-extremity edema associated with gene transfer of naked DNA encoding vascular endothelial growth factor[J].Ann Intern Med,2000,132(11):880-884.

